电针对失神经骨骼肌萎缩大鼠胰岛素样生长因子1、肌肉生长抑制素及肌卫星细胞增殖的影响①
高睿琦,唐成林,曹净,郭全虎,张毅,田源,袁海洲
电针对失神经骨骼肌萎缩大鼠胰岛素样生长因子1、肌肉生长抑制素及肌卫星细胞增殖的影响①
高睿琦,唐成林,曹净,郭全虎,张毅,田源,袁海洲
目的 探讨电针延缓失神经骨骼肌萎缩的可能机制。方法 49只雄性Sprague-Daw ley大鼠随机分为正常组(A组,n= 7)、自然恢复组(B组,n=21)和电针治疗组(C组,n=21)。A组不做处理,其余两组切断坐骨神经制备失神经性骨骼肌萎缩模型。术后1 d,C组术侧腓肠肌给予电针足三里、承山治疗每天1次。术后7 d、14 d、21 d分别测定术侧腓肠肌湿重比,HE染色测定肌纤维直径及截面积,Western blotting检测胰岛素样生长因子1(IGF-1)、肌肉生长抑制素(Myostatin)以及增殖细胞核抗原(PCNA)蛋白,RT-PCR检测IGF-1、Myostatin和PCNA基因表达。结果 与A组比较,B组和C组腓肠肌湿重比、肌纤维截面积及直径均显著下降(P<0.001),但C组显著高于B组(P<0.001)。C组IGF-1、PCNA蛋白和基因表达高于B组(P<0.05),Myostatin蛋白和基因表达低于C组(P<0.05)。结论 电针能有效促进IGF-1的表达,抑制M yostatin的表达,从而促进肌卫星细胞增殖。这可能是电针延缓失神经性骨骼肌肌萎缩的机制之一。
失神经;骨骼肌萎缩;电针;胰岛素样生长因子1;肌肉生长抑制素;增殖细胞核抗原;肌卫星细胞;大鼠
[本文著录格式] 高睿琦,唐成林,曹净,等.电针对失神经骨骼肌萎缩大鼠胰岛素样生长因子1、肌肉生长抑制素及肌卫星细胞增殖的影响[J].中国康复理论与实践,2016,22(11):1259-1263.
CITED AS:Gao RQ,Tang CL,Cao J,etal.Effects of electroacupuncture on insulin-like grow th factor-1,myostatin and satellite-cell proliferation in ratswith denervated skeletalmuscleatrophy[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(11):1259-1263.
失神经性骨骼肌萎缩的发生除了神经受损,还与靶器官相关[1]。骨骼肌去神经支配后,失去相关神经因子营养,呈废用性萎缩,如不及时治疗,将造成极其严重的肢体功能障碍,严重影响患者的生活质量及劳动能力。研究失神经性骨骼肌萎缩的发病机制及其防治,已成为医学界的重要任务。
萎缩的骨骼肌必须依赖肌卫星细胞的激活、增殖和分化来修复和再生,肌卫星细胞在延缓骨骼肌萎缩的过程中起着至关重要的作用[2-4]。胰岛素样生长因子1(insulin-like grow th factor-1,IGF-1)作为刺激肌卫星细胞活性和增殖、再塑肌肉的重要细胞因子,它的高表达不仅能导致肌肉肥大,还可抑制骨骼肌萎缩[5]。肌肉生长抑制素(Myostatin)作为骨骼肌生长的负性调节因子,能抑制肌卫星细胞的增殖与分化。坐骨神经损伤后,在腓肠肌萎缩过程中,Myostatin表达呈显著升高趋势[6]。电针作为延缓失神经肌萎缩的一种有效手段,在临床上已得到广泛认可,但其作用机理尚未完全明确。本研究观察电针对IGF-1、Myostatin以及增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)蛋白和基因表达的影响,从肌卫星细胞激活角度探讨其作用机制。
1 材料与方法
1.1 实验动物
清洁级健康雄性Sprague-Daw ley大鼠49只,8周龄,体质量(250±20)g,由重庆医科大学动物实验中心提供。医学动物合格证号SCXK渝2012-0002。饲养于重庆医科大学动物实验中心SPF级动物房,室温(22±2)℃,相对湿度65%~75%,明暗12 h交替,饮食自由摄取。
1.2 主要试剂与仪器
IGF-1、Myostatin一抗:北京博奥森生物技术有限公司。PCNA一抗:美国诺伟司生物技术公司。TRNzol总RNA提取试剂:北京天根生化科技有限公司。Rever Tre Ace-a-逆转录试剂盒:TOYOBO公司。华佗牌无菌针灸针(直径0.30 mm,长13~25 mm)、SDZ-Ⅱ型电子针治疗仪:苏州医疗用品有限公司。柔软型实验大鼠固定器:温州原上草医疗科技有限公司。AL204型电子天平:梅特勒-托利多仪器有限公司。UV-1750型紫外可见光度计:日本津岛公司。电泳仪、CFX PCR仪:美国BIO RAD公司。低温高速离心机:SIGMA公司。BX51正置显微镜:OLYMPUS公司。
1.3 模型制备及分组
大鼠适应性喂养1周后,依次编为1~49号。通过计算机自动生成49个两位数随机数字表,按从左到右、由上而下依次对应1~49号大鼠。按随机数字的大小重新排列序号,序号1~7为正常组(A组),序号8~28为自然恢复组(B组),序号29~49为电针治疗组(C 组)。
其中B组和C组大鼠予10%水合氯醛3m l/kg腹腔注射麻醉,俯卧位固定于手术台上。无菌条件下右后肢股后外侧切口,沿臀大肌间隙钝性分离、暴露坐骨神经,中段切断,造成1.0mm神经缺损[7]。
1.4 干预方法
术后第2天,将C组大鼠固定于柔软型实验大鼠固定器[8]上,参照《实验针灸学》取术侧足三里、承山两穴[9],进针5~7mm,连接电针仪。连续波,频率5 Hz,强度1.5mA。每天1次,每次10min,连续治疗至取材[10-11]。A组和B组每天定时固定。动物的处置均符合重庆医科大学伦理委员会标准。
1.5 标本采集
A组于21 d后取材,B组和C组分别于造模后7 d、14 d、21 d随机抓取7只动物取材。大鼠10%水合氯醛3m l/kg腹腔注射麻醉,迅速分离腓肠肌;切取腓肠肌,PBS缓冲液冲洗;将腓肠肌分为两份,一份迅速放入液氮罐中,-80℃超低温冰箱储存待测,另一份4%多聚甲醛固定,石蜡包埋待测。
1.6 检测方法
1.6.1 腓肠肌湿重比
取材时观察术侧腓肠肌萎缩情况,包括肌肉饱满度、弹性、色泽等。观察后近端于股骨内、外髁起点剪下,远端从跟腱止点处剪断,完整取下双侧腓肠肌,电子天平称取腓肠肌湿重,以自身健侧作为对照,计算腓肠肌湿重比。
1.6.2 肌纤维截面积及直径
腓肠肌4%多聚甲醛固定,酒精梯度脱水,浸蜡包埋、切片、贴片、脱蜡,HE染色由重庆医科大学基础医学院组织切片室完成,400倍光学显微镜观察,每张切片随机选取5个视野拍照,Image-Pro Plu 6.0图像分析软件计算肌纤维直径和截面积。
1.6.3 Western blotting
取冰冻腓肠肌组织样本约50mg,低温匀浆后提取总蛋白;灌制SDS-PAGE凝胶电泳,取出凝胶,和相同大小的聚偏二氟乙烯膜(polyvinylidene fluoride,
PVDF)置于三层滤纸中间,放入转移槽中,加满转移液,300mA转膜约90m in;5%脱脂奶粉室温下封闭约4 h;加入IGF-1、Myostatin、PCNA一抗(1∶1000) 4℃过夜;复温后加相应二抗(1∶1000)室温下孵育1~2 h;将PVDF置于化学发光试剂增强反应1~3 m in,暗室中X光片爆光、显影及定影,GelDoc 2000凝胶成像系统分析图像计算相对灰度值。
1.6.4 RT-PCR
冰冻腓肠肌组织样本约50mg,加入TRNzol1m l充分匀浆,提取总RNA。紫外分光光度计检测总RNA浓度及纯度;按ReverTraAce-α-反转录试剂盒操作步骤进行逆转录,行PCR反应:94℃预变性5 min;94℃变性30m in,58℃退火45 s,72℃延伸45 s,共30个循环;72℃最终延伸7m in。取PCR产物15μl加入上样孔,5V/1cm电泳(事先制备好琼脂糖凝胶),凝胶成像系统计算相对荧光强度值。上下游引物序列如下。

1.7 统计学分析
2 结果
2.1 肌湿重比
A组腓肠肌肌肉饱满红润、富有弹性。B组和C组术侧腓肠肌均呈进行性萎缩,弹性减弱,色泽欠佳;肌湿重比随时间逐渐下降,均显著低于A组(P<0.001);各时间点,C组显著高于B组(P<0.001)。见表1。
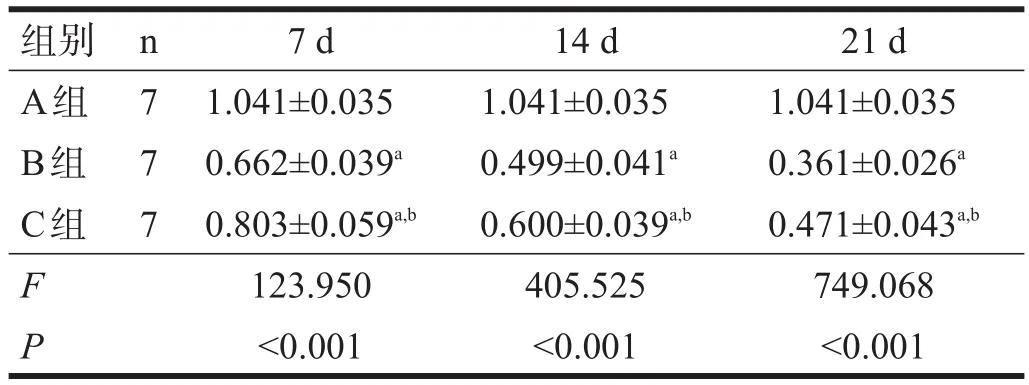
表1 各组各时间点骨骼肌湿重比
2.2 形态学
B组与C组随着时间延长,腓肠肌纤维截面积及直径呈逐渐下降趋势(图1),均显著低于A组(P<0.001);各时间点,B组均低于C组(P<0.001)。见表2、表3。

表2 各组各时间点肌纤维截面积(μm2)
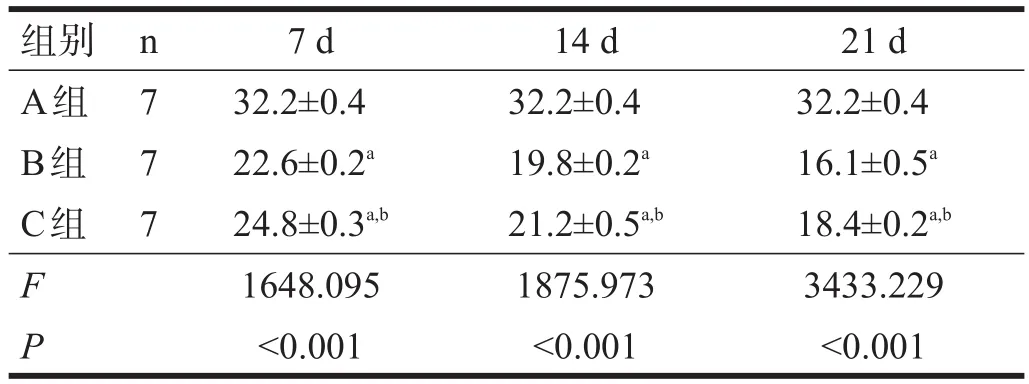
表3 各组各时间点肌纤维直径(μm)
2.3 IGF-1、Myostatin和PCNA表达
腓肠肌中IGF-1、Myostatin和PCNA蛋白与mRNA表达呈现相同趋势。与A组相比,B组IGF-1表达下降(P<0.05),而C组表达量显著升高(P<0.001);B组和C组Myostatin表达各时间点均升高(P<0.05),C组低于B组(P<0.001);B组与C组PCNA表达各时间点均升高(P<0.05),且C组高于B组(P<0.05)。见图2、图3。
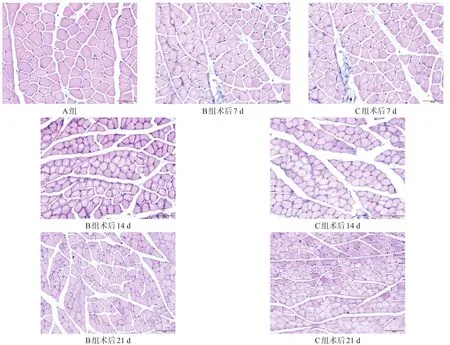
图1 各组各时间点腓肠肌病理改变(HE染色,bar=50μm)
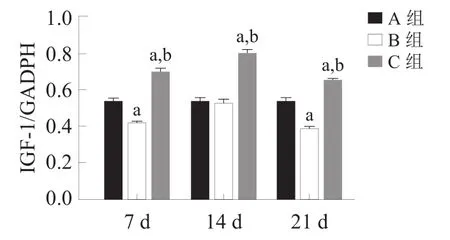
注:a:与A组比较,P<0.001;b:与B组比较,P<0.001IGF-1

图2 各组各时间点骨骼肌IGF-1、Myostatin和PCNA蛋白表达(Western boltting)
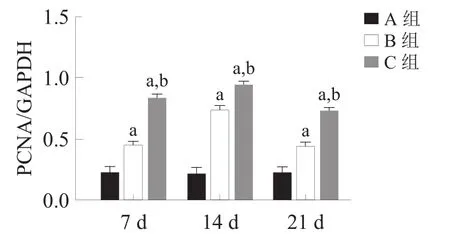
注:a:与A组比较,P<0.001;b:与B组比较,P<0.001PCNA

注:与A组比较,a:P<0.001;c:P<0.05;b: 与B组比较,P<0.001IGF-1

图3 各组各时间点骨骼肌IGF-1、Myostatin和PCNAmRNA表达(RT-PCR)
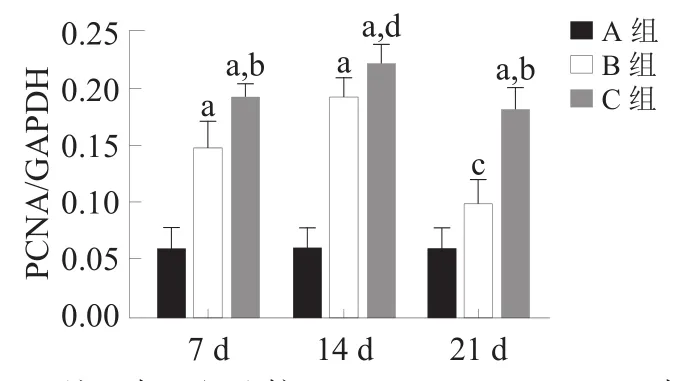
注:与A组比较,a:P<0.001;c:P<0.05;与B组比较,b:P<0.001;d:P<0.05PCNA
3 讨论
失神经骨骼肌萎缩在传统中医学中属于“痿症”范畴。“治痿独取阳明”,足三里为足阳明胃经合穴,具有强筋骨、舒筋活血的功能,是治疗下肢痿症的要穴;承山主治下肢痿症。两穴配用可改善局部血液循环,维持肌肉营养,增强肌肉运动功能,从而抑制肌肉萎缩。
针灸作为临床治疗失神经性肌萎缩的常见手段,效果显著。现代实验研究证实,电针可通过提高神经营养因子-3与酪氨酸激酶C的表达,维持神经元存活,促进受损神经修复,改善坐骨神经损伤大鼠的感觉功能[12]。电针拮抗大鼠坐骨神经损伤后腓肠肌萎缩可能与调节神经生长因子mRNA表达有关[13]。绝大部分研究集中于电针对坐骨神经功能恢复的作用,而对于萎缩的骨骼肌研究相对较少[14-16]。研究表明,电针能促进骨骼肌肌卫星细胞增殖,从而促进腓肠肌损伤的修复[17]。电针延缓骨骼肌萎缩的治疗作用也可能与骨骼肌肌卫星细胞增殖有关系。
骨骼肌的生长与退化受IGF-1调控。IGF-1作为肌肉生长正向调节信号,是刺激肌卫星细胞活性和增殖、再塑肌肉的重要细胞因子[18]。它促进机体生长发育、参与组织修复,对促进骨骼肌蛋白质合成具有显著作用[19]。Myostatin是骨骼肌生长发育负性调控因子,能抑制IGF-1诱导的肌卫星细胞增殖分化,对抗肌肉再生[20-21]。PCNA又称周期蛋白(Cyclin)[22],是真核细胞DNA合成所必须的一种核蛋白,作为细胞增殖的标记蛋白,能反映肌卫星细胞的增殖活性[23-25]。本研究中显示,电针能有效促进IGF-1表达,抑制Myostatin表达,从而促进肌卫星细胞的增殖,修复失神经支配的骨骼肌,延缓骨骼肌萎缩的程度。本研究还显示,B组和C组IGF-1和PCNA表达均在伤后14 d到达高峰,随后有所下降,为临床寻找电针治疗有效介入时间提供一定参考。
综上所述,电针延缓失神经性骨骼肌萎缩的机制可能与通过调节IGF-1和Myostatin的表达,从而调节肌卫星细胞的增殖与分化有关。
[1]陈波,陈振兵,杜远立,等.去神经支配骨骼肌萎缩变化及康复治疗研究进展[J].中国康复医学杂志,2011,26(8):792-795.
[2]Dhawan J,Rando TA.Stem cells in postnatalmyogenesis:molecular mechanisms of satellite cell quiescence,activation and replenishment[J].TrendsCell Biol,2005,15(12):666-673.
[3]Adams GR.Satellite cell proliferation and skeletal muscle hypertrophy[J].ApplPhysiolNutrMetab,2006,31(6):782-790.
[4]Sherwood RI,Wagers AJ.Harnessing the potential ofmyogenic satellite cells[J].TrendsMolMed,2006,12(5):189-192.
[5]连晓阳,陈少清,方忆生,等.电针三阴交、阴陵泉对腓肠肌损伤大鼠损伤后修复及生长因子表达的影响[J].中国康复理论与实践,2015,21 (11):1273-1276.
[6]Lin M,Zhang D,Shao C,et al.Expression pattern ofmyostatin in gastrocnemiusmuscle of rats after sciatic nerve crush injury[J].Muscle Nerve,2007,35(5):649-656.
[7]吴珍元,黄英如,冼华,等.电针对失神经骨骼肌萎缩及纤维化的影响[J].中国康复医学杂志,2016,31(2):177-182.
[8]张毅,唐成林,田源,等.电针联合饮食调控对非酒精性脂肪性肝病大鼠过氧化物酶体增殖物激活受体α和肝型脂肪酸结合蛋白的影响[J].针刺研究,2015,40(5):345-351.
[9]李忠仁.实验针灸学[M].北京:中国中医药出版社,2007:255-257.
[10]张毅,唐成林,田源,等.电针对非酒精性脂肪性肝病大鼠蛋白质二硫化物异构酶A3的影响[J].四川大学学报(医学版),2016,42(2): 208-213.
[11]王猛.注射性坐骨神经损伤后针刺对大鼠腓骨长肌GlyRS表达和超微结构改变的影响[D].遵义:遵义医学院,2016.
[12]潘璠,于天源,吴剑聪,等.电针对坐骨神经损伤大鼠背根神经节中神经营养因子-3及其受体TrkC的影响[J].中国康复医学杂志,2014,29 (12):1109-1112.
[13]陈家泽.电针对坐骨神经损伤后模型大鼠腓肠肌萎缩及NGF mRNA表达的影响[D].广州:广州中医药大学,2008.
[14]于战歌.足三里和阿是穴在电针促进神经肌肉接头再生中的作用及其机制研究[D].北京:北京中医药大学,2016.
[15]虎力,徐平,王晓南,等.针灸在骨骼肌萎缩中的研究现状与展望[J].中华中医药学刊,2015,33(4):890-893.
[16]陶星,马铁明.针刺治疗周围神经损伤及再生修复相关机制探讨[J].针刺研究,2016,41(1):90-93.
[17]陈欢,张莉,崔强,等.电针阿是穴对骨骼肌损伤大鼠肌肉再生及碱性成纤维细胞生长因子表达的影响[J].中国康复理论与实践,2013,19 (4):334-340.
[18]Park S,Brisson BK,Liu M,et al.Mature IGF-1 excels in promoting functional muscle recovery from disuse atrophy compared with pro-IGF-1A[J].JAppl Physiol,2014,116(7):797-806.
[19]Perez-Ruiz A,GnocchiVF,Zammit PS.Controlof Myf5 activation in adultskeletalmyonuclei requires ERK signalling[J].Cell Signal,2007, 19(8):1671-1680.
[20]Siriett V,Kambadur R,Sharma M,etal.Antagonism ofmyostatin enhancesmuscle regenration during sarcopenia[J].Mol Ther,2007,15 (8):1463-1470.
[21]刘通.电针“委中”穴对腰多裂肌卫星细胞增殖及PI3K/Akt/mTOR信号通路的影响[D].北京:北京中医药大学,2016.
[22]林凯,虞德兵,解晓东,等.TGF-β/Smad信号通路在Follistatin调节鸭骨骼肌卫星细胞增殖过程中的作用机制[J].中国农业科学,2015,48 (12):2460-2468.
[23]Haubold KW,Allen DL,CapetanakiY,etal.Loss of desmin leads to impaired voluntary wheel running and treadm ill exercise performance[J].JAppl Physiol,2003,95(4):1617-1622.
[24]陈立.大鼠肌卫星细胞体外培养及移植延缓失神经骨骼肌萎缩的实验研究[D].上海:复旦大学,2012.
[25]李景龙,刘红菊,王飞,等.肌卫星细胞在失重肌萎缩中的可塑性变化及机制[J].生物化学与生物物理进展,2016,43(6):1-9.
Effects of Electroacupuncture on Insulin-like Grow th Factor-1,M yostatin and Satellite-cell Proliferation in Rats with Denervated SkeletalM uscleAtrophy
GAO Rui-qi,TANGCheng-lin,CAO Jing,GUOQuan-hu,ZHANG Yi,TIANYuan,YUANHai-zhou
ChineseMedicalDepartment,Chongqing MedicalUniversity,Chongqing 400016,China
Objective To observe effects and mechanism of electroacupuncture(EA)on denervated skeletalmuscle atrophy.Methods Forty-ninemale Sprague-Daw ley ratswere random ly divided into normalgroup(group A,n=7),natural recovery group(group B,n=21)and EA group(group C,n=21).The groups B and C,established themodelof denervated skeletalmuscle atrophy by transecting the sciatic nerve of rats,were divided into subgroupsof 7 days,14 days,21 days postoperation,seven in each subgroup.Electroacupuncturewasgiven to the group C at Zusanli(ST36)and Chengshan(BL57)oncea day since 24 hoursaftermodeling.Themusclewetweight ratio of theaffected gastrocnem iuswas determ ined.Cross-sectional area and fiber diameter of the gastrocnem iusweremeasured with HE staining.The expression of insulin-like grow th factor-1(IGF-1),Myostatin and proliferating cellnuclear antigen(PCNA)protein and gene in thegastrocnemiuswere detected withWestern blotting and RT-PCR.Results Thewetweight ratio,cross-sectional area and fiber diameterwere less in the groups B and C than in the group A(P<0.001),and they weremore in the group C than in the group B(P<0.001).Compared with the group B,the protein and gene of IGF-1,PCNA increased in the group C(P<0.05),while the Myostatin decreased(P<0.05).Conclusion Electroacupuncture can increase the expression of IGF-1 and decrease the expression of M yostatin,to promote the proliferation of satellite cell,whichmay relatewith the prevention of denervated skeletalmuscle atrophy.
denervation;muscle atrophy;electroacupuncture;insulin-like grow th factor-1;Myostatin;proliferating cell nuclear antigen;satellite cell;rats
10.3969/j.issn.1006-9771.2016.11.004
R746.4
A
1006-9771(2016)11-1259-05
2016-06-20
2016-08-29)
1.国家自然科学基金项目(No.81273870);2.重庆市卫计委中医药科研项目(No.ZY20150249)。
重庆医科大学中医药学院,重庆市400016。作者简介:高睿琦(1990-),女,汉族,重庆市人,硕士研究生,主要研究方向:针灸推拿机制研究。通讯作者:唐成林(1966-),男,硕士,教授,主要研究方向:针灸推拿机制研究。E-mail:cytcl996@163.com。

