血清胃蛋白酶原与胃泌素检测对慢性萎缩性胃炎的诊断价值
孙雪飞,何 旭
(合肥市第三人民医院消化内科,合肥 230022)
血清胃蛋白酶原与胃泌素检测对慢性萎缩性胃炎的诊断价值
孙雪飞,何 旭
(合肥市第三人民医院消化内科,合肥 230022)
目的:研究血清胃蛋白酶原与胃泌素检测对慢性萎缩性胃炎的诊断价值。方法:选取2014年1月~2015年12月在我科行胃镜检查诊断为慢性胃炎的患者200例,按根据组织病理学诊断结果分为观察组及对照组各100例,对照组为慢性非萎缩性胃炎组,观察组为慢性萎缩性胃炎组,通过酶联免疫吸附试验(ELISA)法来定量测定空腹血清PGⅠ、PGⅡ和G-17的数值水平,并计算PGⅠ/PGⅡ的比值(即PGR)。采取14C-呼气试验判定幽门螺杆菌(Hp)的感染情况。结果:观察组的PG-Ⅰ的值(129.44 ±62.43)、G-17的值(9.78 ±15.49)均明显低于对照组的(151.62 ±76.32)、(18.92 ±18.88),且经统计学分析差异均具有显著性。观察组PGR的值(10.11 ± 5.23)低于对照组的(10.96 ±7.22),但经统计学分析差异不具有显著性。 HP阳性的PG-Ⅰ值(124.41 ±65.88)、PGR的值(8.97 ±7.74)均明显低于HP阴性的(154.20 ±65.15)、(11.65 ±5.78),且经统计学分析差异均具有显著性。HP阳性的G-17的值(10.84 ±15.53)低于HP阴性的值(10.69 ±19.13),但经统计学分析差异不具有显著性。结论:血清PG和G-17水平的降低提示慢性萎缩性胃炎可能,应行胃镜以及活检检查明确诊断,且Hp感染与PG水平的变化有关。
胃蛋白酶原;胃泌素;慢性萎缩性胃炎;幽门螺旋杆菌;诊断
作为临床中比较常见的胃部疾病之一,萎缩性胃炎(Atrophic gastritis,CAG)的主要特征是进行性胃腺体丢失和肠化,并伴有中、重度异型增生,可谓真正的胃癌癌前病变,它与胃癌尤其是肠型胃癌的发生存在显著的正相关性关联,因此在1978年WHO将它定义为所谓的“胃癌前期状态”。有研究已证实,CAG的发生和发展都与胃癌是密不可分的。由此可见,对CAG病变的监测和干预阻断应该是防治胃癌的重点研究课题[1]。本文选取2014年1月~2015年12月在我科行胃镜检查诊断为慢性胃炎的患者200例,按根据组织病
理学诊断结果分为观察组及对照组各100例,对照组为慢性非萎缩性胃炎组,观察组为慢性萎缩性胃炎组,通过酶联免疫吸附试验(ELISA)法来定量测定空腹血清PGⅠ、PGⅡ和G-17的数值水平,并计算PGⅠ/PGⅡ的比值(即PGR)。采用14C-呼气试验判定幽门螺杆菌(Hp)的感染情况[2]。现报告如下。
1 资料与方法
1.1 一般资料 选取2013年1月~2014年12月在我科行胃镜检查诊断为慢性胃炎的患者200例,按根据组织病理学诊断结果分为观察组及对照组各100例,对照组为慢性非萎缩性胃炎组,观察组为慢性萎缩性胃炎组。观察组100例,其中男44例,女56例,年龄22~81岁,平均53±11岁;对照组100例,其中男54例,女48例,年龄20~79岁,平均49±13岁。入选的病例中均无心脑血管等胃镜检查的禁忌证,近一个月内未使用抗生素、抑酸药以及胃黏膜保护剂;并且排除了合并本身其他系统或者器官疾病、恶性肿瘤以及严重肝肾功能不全的病例。两组患者一般资料如年龄、性别等比较差异无统计学意义。
1.2 方法[3]受检者在空腹状态下采集其静脉血3ml,进行分离血清后置于冰箱内-20℃的环境下以待测验。对血清采用酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)方法测定胃蛋白酶原和胃泌素的水平,其中试剂盒来自芬兰Biohit公司,由专人严格按照说明书进行操作。幽门螺杆菌(Hp)的测定采用14 C-或者13C-呼气试验和快速尿素酶试验。
1.3 评价指标[4](1)比较两组PG-Ⅰ、PGR、G-17水平;(2)比较Hp阳性与阴性者PG-Ⅰ、PGR、G-17水平。
1.4 统计学方法 利用SPSS 19.0统计软件对数据进行分析,计数资料,基于χ2检验和t检验进行分析,P<0.05表示差异有统计学意义。
2 . 结果
2.1 两组PG-Ⅰ、PGR、G-17水平比较 观察组的PG-Ⅰ的值(129.44 ±62.43)、G-17的值(9.78 ±15.49)均明显低于对照组的(151.62 ±76.32)、(18.92 ±18.88),且经统计学分析差异均具有显著性(P<0.05)。观察组PGR的值(10.11 ±5.23)低于对照组的(10.96 ±7.22),但经统计学分析差异不具有显著性(P>0.05)。见表1。
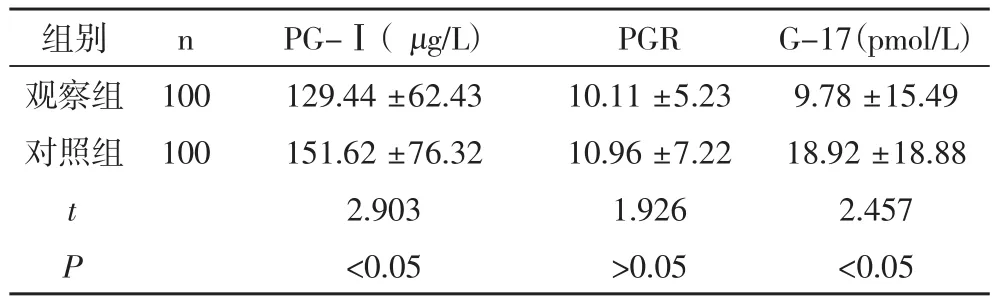
表1 两组PG-Ⅰ、PGR、G-17水平比较
2.2 Hp阳性与阴性者PG-Ⅰ、PGR、G-17水平比较
HP阳性的PG-Ⅰ值(124.41 ±65.88)、PGR的值(8.97 ±7.74)均明显低于HP阴性的(154.20 ±65.15)、(11.65 ±5.78),且经统计学分析差异均具有显著性(P<0.05)。HP阳性的G-17的值(10.84 ±15.53)低于HP阴性的值(10.69 ±19.13),但经统计学分析差异不具有显著性(P>0.05)。见表2。
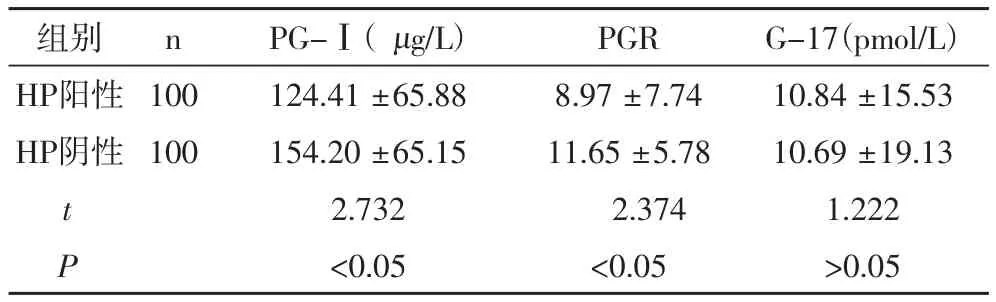
表2 Hp阳性与阴性者PG-Ⅰ、PGR、G-17水平比较
3 讨论
CAG的诊断和监测主要通过内镜活检病理检查。近年来,国外有的学者把血清胃蛋白酶原Ⅰ(PGⅠ)或者胃蛋白酶原Ⅰ与Ⅱ的比率(PGⅠ/PGⅡ)当做监测手段[5]。胃蛋白酶原是胃蛋白酶的前体。PGⅠ是由胃体的主细胞分泌而来的,由胃黏膜萎缩引起的主细胞减少和血清PGⅠ水平之间存在着一定的相关关系[,6]。PGⅡ则在胃窦和胃体黏膜均有分泌,当全胃黏膜萎缩时,PGⅡ的水平出现了下降。在CAG的发展过程中,胃黏膜萎缩越加剧,PGⅠ和PGⅠ/PGⅡ的比率也在降低。在CAG,胃窦腺体丧失会引起胃窦G细胞的数量减少,而G细胞是循环中17肽胃泌素(G-17)的主要来源,两者的丧失都致使进入血液循环的G-17减少,所以血清中的G-17水平可以看做是胃窦的血清学标志物[7]。由此可见,要注重采取办法测定胃蛋白酶原和胃泌素的含量变化,这有助于对胃部疾病的诊断[8]。
现在Hp已成为人类胃癌的第一类致癌物,它与CAG的关系也备受关注。在对CAG患者的调研中发现[9],Hp的检出率呈增高趋势,大约为60%~90%;多项长期临床随访的结果也表明[10],Hp相关性的胃炎中,约1/3的患者最终发展为了CAG,这个比例是Hp阴性胃炎的9~10倍。有另多年的研究发现[11],Hp相关胃炎中大概28%发展为CAG或者肠化。Hp感染的动物和志愿者在感染的后期都存在炎细胞浸润以及胃黏膜萎缩等现象。而长期的随访资料也显示,Hp感染相关的CagA血清抗体的存在量与萎缩和肠化的程度呈现正相关。
本文通过观察慢性萎缩性胃炎和慢性非萎缩性胃炎患者的血清PG-Ⅰ、PG-Ⅱ、胃泌素-17(G-17)水平变化,探讨慢性萎缩性胃炎(CAG)和慢性非萎缩性胃炎(CNAC)患者PG-Ⅰ、PG-Ⅱ、G-17的变化及其临床
意义。研究结果指出观察组的PG-Ⅰ的值(129.44 ± 62.43)、G-17的值(9.78 ±15.49)均明显低于对照组,且经统计学分析差异均具有显著性。观察组PGR的值(10.11 ±5.23)低于对照组的(10.96 ±7.22),但经统计学分析差异不具有显著性。这是由于胃黏膜萎缩导致的主细胞减少和胃窦G细胞的减少,从而导致慢性萎缩性胃炎患者PG-Ⅰ和G-17的下降,所以当血清胃蛋白酶原与胃泌素明显下降时提示有慢性萎缩性胃炎的可能。HP阳性的PG-Ⅰ值(124.41 ±65.88)、PGR的值(8.97 ±7.74)均明显低于HP阴性的(154.20 ±65.15)、(11.65 ±5.78),且经统计学分析差异均具有显著性。HP阳性的G-17的值(10.84 ±15.53)低于HP阴性的值(10.69 ±19.13),但经统计学分析差异不具有显著性,该研究结果与文献报导基本一致[12]。
综上所述,血清PG和G-17水平的降低提示慢性萎缩性胃炎可能,应行胃镜以及活检检查明确诊断,且Hp感染与PG水平的变化有关。所以临床上可将血清PG和G-17进行联合检测,有利于发现慢性萎缩性胃炎,值得临床进行进一步推广和应用。
[1] 盛菁. 慢性萎缩性胃炎患者血清胃蛋白酶原的研究[J]. 吉林医学, 2016, 1(3): 145-146.
[2] 项利. 胃蛋白酶原与促胃液素联合检测在慢性萎缩性胃炎诊断中的临床价值[J]. 中国现代药物应用, 2016, 2(2): 20-21.
[3] 褚美芬, 叶爱青, 吴怡春. 血清胃蛋白酶原及幽门螺杆菌抗体在胃癌早期诊断中的意义[J]. 中国卫生检验杂志, 2015, 23(11): 4063-4065.
[4] 杨勤, 姚玉玲. 胃蛋白酶原与胃泌素检测对慢性萎缩性胃炎的诊断价值探讨[J]. 实用临床医药杂志, 2012, 23(02): 23-24+31.
[5] 邱宏毅, 颜秀娟, 陈胜良. 血清胃蛋白酶原检测在胃癌预警和胃黏膜功能评价中的价值[J]. 胃肠病学, 2015, 10(01): 625-628.
[6] W. S. B. Lee, K. -F. Theag gern as icell: the key toun derstan ding the a natomy of the fron tal recess. Otol aryngol He ad Neck Surg. 2011, 12 (9): 497-507.
[7] Choi Bi, Lee H J, Han J K, et al. Detectionof hyperv as cularnod ularhe patocell urcarc in omas: value of triphasi chelical CT compared with io dizedoil CT[J]. AJR, 2010, 157(2): 219-224.
[8] KHANMA, COMBSCS, BRUNTEM, et al. Posi trone missi on to mogr aphysc an ningin the ev aluat io no fhe pato cellul arcarc in oma[J]. An nNuc lM ed, 2009, 14(2): 121-126.
[9] Tabit CE, Chung WB, Hamburg NM, et al. End othe liald ysfunct ioni dia betes mellit us: molecular mechanis ms and clinical im plicat io ns. Rev Endocr Metab Disord, 2010, 11(1): 61-74.
[10] Ende mann DH, Schiffr in EL. Endo the lial dys fun ction. J Am Soc Nep hrol, 20 10, 15(8): 1983-1992.
[11] 黄秀君, 龚武陵. 134例老年上消化道出血的临床诊治分析[J]. 湖南师范大学学报(医学版)2007, 4(4): 44-47.
[12] 王海杰, 孟晓旭, 王强, 等. 慢性胃炎内镜表现和病理相关性分析[J]. 湖南师范大学学报(医学版)2015, 9(5): 40-41.
Serum pepsinogen and gastrin detection in the diagnosis of chronic atrophic gastritis value
Sun Xue-fei, He Xu
(Department of Internal Medicine, The Third People's Hospital of Hefei, Hefei 230022, China)
Objective To study the serum pepsinogen and gastrin detection in the diagnosis of chronic atrophic gastritis value. Methods Select January 2014 to December 2015 in our department received 200 patients with chronic gastritis diagnosed by gastroscopy, according to pathological diagnosis were divided into observation group and control group with 100 cases in each, for chronic non atrophic gastritis group in the control group, the observation group for chronic atrophic gastritis group, by enzyme linked immunosorbent assay (ELISA)to quantitatively determine the level of fasting serum PG I and PG II and G-17 numerical, and calculate the PG I /PG II ratio (PGR). The 14C urea breath test method to determine the infection of Helicobacter pylori (HP). Results In the observation group, the PG I values (129.44±62.43), G-17 value (9.78±15.49)were significantly lower than those of the control group (151.62±76.32), 18.92±18.88), and the statistical analysis of differences has significant difference . The value of PGR (10.11±5.23)in the observation group was lower than that in the control group (10.96 ±7.22), but the difference was not statistically significant . HP positive value of PG- I (124.41±65.88), PGR value (8.97± 7.74)were significantly lower than HP negative (154.20±65.15), (11.65±5.78), and the difference was statistically significant . The value of HP positive G-17 (10.84±15.53)was lower than that of HP negative value (10.69±19.13), but the difference was not statistically significant . Conclusion The decrease of serum PG and G-17 levels suggests that chronic atrophic gastritis may be diagnosed by gastroscopy and biopsy, and Hp infection is related to the changes of PG levels.
pepsinogen; gastrin; chronic atrophic gastritis; helicobacter pylori ; diagnosis
R446.1
A
1673-016X(2016)05-0115-03
2016-06-11
孙雪飞,E-mail:zy_xf33@sohu.com

