顶空固相微萃取-气相色谱法检测白酒中吡嗪类化合物
黄家岭,廖妍俨,孙棣,张倩,龙四红
(贵州省产品质量监督检验院,国家酒类及加工食品质量监督检验中心,贵州贵阳550016)
顶空固相微萃取-气相色谱法检测白酒中吡嗪类化合物
黄家岭,廖妍俨*,孙棣,张倩,龙四红
(贵州省产品质量监督检验院,国家酒类及加工食品质量监督检验中心,贵州贵阳550016)
该研究从样品前处理、萃取条件两个方面对顶空固相微萃取-气相色谱法检测白酒中吡嗪类化合物进行优化,得到最佳检测条件为:用高纯水将白酒样稀释至酒精度为10%vol,同时向样品中加入NaCl,并使其质量浓度为0.05 g/mL,调节样品体系的pH值为8;在70℃条件下,采用50/30 μm DVB/CAR/PDMS固相萃取头萃取50 min,汽化室温度250℃的条件下解吸3 min。方法学研究表明,在0.05~20 mg/L的线性范围内具有良好的线性关系,相关系数R>0.99,8种吡嗪类物质方法的检出限(S/N=3)为1.37~6.78 μg/L,回收率87.6%~105.4%,相对标准偏差为4.61%~6.37%。用该方法对5种酱香型白酒检测,所测样品中吡嗪类物质含量在0~29 mg/L,其中1#酒样中吡嗪类物质的含量最高,达到25.72 mg/L。
吡嗪类物质;顶空-固相微萃取;气相色谱;白酒
吡嗪(pyrazines)是1,4位含氮的六元环化合物,具有明显的焦香或烤坚果香味,其衍生物广泛存在于天然和发酵食品中,是白酒中含氮化合物的主要成分,同时也是白酒香气成分的重要组成物质。由于其风味阈值极低,特别在大曲酱香型白酒中,吡嗪类化合物对优质酒陈香风味的贡献很大,因此越来越受到人们的重视[1-2]。
吡嗪在白酒中属于微量物质,虽然其含量不大,但种类并不少,不同种类的吡嗪类化合物含量又存在着明显差异,含量在0~20 000 μg/L范围内,所以对其定性定量检测存在不小的困难。早期的检测研究多体现在液液萃取方面;21世纪初,王柏文等[3-4]曾采用液液萃取和顶空-固相微萃取(headspace-solid phase micro extraction,HS-SPME)结合的方法分析检测中国白酒风味成分,检测到一批具有风味特征的吡嗪类化合物。SPME法因无需有机溶剂,没有复杂的前处理,从而成为研究者的追捧对象,SPME与气相色谱磷氮检测器(gas chromatography-nitrogen phosphorus detector,GC-NPD)联用技术已用于检测葡萄酒中吡嗪类化合物[5-6]。张艳红等[7]采用SPME与气相色谱火焰热离子检测器(gas chromatography-flame thermionic detector,GC-FTD)相结合的方法,检出了白酒中大量的含氮化合物,并定量了8种吡嗪类化合物。
火焰离子化检测器(flame ionization detector,FID)是目前广泛存在于检测机构及白酒企业的检验设备。本研究立足于FID检测器,通过从顶空条件、色谱条件及样品前处理条件等方面进行实验和优化,力求使白酒中吡嗪化合物的检测技术得到进一步地提升。
1 材料与方法
1.1材料与试剂
2-甲基吡嗪(纯度≥99%)、2,5-二甲基吡嗪(纯度≥98%)、2,6-二甲基吡嗪(纯度为98%)、2,3-二甲基吡嗪(纯度99%)、2-乙基-6-甲基吡嗪(纯度为95%)、2,3,5-三甲基吡嗪(纯度≥99%)、2,3,5,6-四甲基吡嗪(纯度≥98%):上海安谱科学仪器有限公司;2,3-二甲基-5-乙基吡嗪:山东省滕州市华东生物科技有限公司;NaCl(分析纯)、乙醇(色谱纯、纯度≥99.9%):国药集团化学试剂有限公司。5种酱香型白酒(分别编号为1#、2#、3#、4#、5#):市售。
1.2仪器与设备
Agilent 7890气相色谱仪(配备FID检测器)、Agilent GC Sample 80自动进样器、19091N-136 HP-INNOWAX毛细管柱(60 m×0.25 mm×0.25 μm)、75 μm Carboxen/PDMS萃取头、65 μm PDMS/DVB萃取头、85 μm Polyacrylate萃取头、50/30 μm DVB/CAR/PDMS萃取头:美国安捷伦公司;20 mL顶空进样瓶:日本岛津公司。
1.3实验方法
1.3.1样品处理
取1.0 mL酒样,加重蒸馏去离子水4.0 mL,使得各酒样中酒精度降低至10%vol左右,加入NaCl 0.25 g;并调节pH值为8;70℃萃取50 min,解吸3 min,解吸温度(进样口温度)250℃。
1.3.2色谱条件
气相色谱条件:19091N-136 HP-INNOWAX毛细管柱(60 m×0.25 mm×0.25 μm),汽化室温度250℃,分流比10∶1,载气为高纯氮气,流速0.8 mL/min。程序升温:起始温度50℃,保持2 min,然后以3℃/min的速率升温至70℃,保留4 min,再以8℃/min的速率升温至250℃保留2 min。
1.3.3定性定量分析
定性分析:将所测8种吡嗪标准品以单标的形式在相同的气相色谱条件下进样检测,确定出每一种的出峰时间,以此对8种吡嗪物质分别定性。
定量分析:准确称取8种吡嗪类化合物各0.01 g,用无水乙醇定容至10mL,得1 000 μg/mL标准储备液;取储备液各1mL混合后定容至10mL,得到100μg/mL的使用液备用;将使用液稀释成0.05 mg/L、0.1 mg/L、1.0 mg/L、10.0 mg/L、20.0 mg/L不同梯度标准物质混合液(体积为5 mL)分别进样检测,建立校正曲线。以此对所测样品中目标物进行定量分析。8种吡嗪类物质含量的计算公式如下:
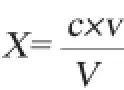
式中:X为试样中吡嗪类物质的含量,mg/L;c为试样处理液中吡嗪类物质的质量浓度,mg/L;v为试样定容体积,mL;V为试样的取样体积,mL。
2 结果与分析
2.1固相萃取头的选择
基于常见的4种固相萃取头(75 μm Carboxen/PDMS、65 μm PDMS/DVB、85 μm聚酰胺(polyacrylate,PA)、50/30 μm DVB/CAR/PDMS),按照各萃取头吸附吡嗪类化合物多少,即根据不同萃取头检测相同浓度标液所得的峰面积的大小,判断出各萃取头萃取吡嗪类化合物能力的强弱[8-9],结果如图1所示。

图1 不同萃取头对萃取效果的影响Fig.1 Effect of different extraction heads on extraction
2.2萃取温度的选择
萃取温度是影响顶空固相微萃取速度和效率的重要因素。一方面,随着温度的升高,较多的分析物会从基质中逸出,从而有利于固相微萃取;另一方面,随着温度的升高,萃取头吸附分析组分的能力会随之下降[10-11]。本实验比较了40℃、50℃、60℃、70℃、80℃温度梯度的萃取效果,结果如图2所示。
由图2可知,萃取温度为40~70℃时,吡嗪峰面积随着温度的升高而增大,当萃取温度为80℃时,吡嗪峰面积较70℃萃取时有所下降,因此选择70℃为萃取头50/30 μm DVB/CAR/PDMS的最佳萃取温度。实验还发现,针对不同的吡嗪类化合物,其萃取效果受温度的影响不尽相同,其中2-甲基吡嗪(2-methylpyrazine,2-MeP)受萃取温度变化的影响最小,而2,3,5,6-四甲基吡嗪则受萃取温度的影响最大。

图2 萃取温度对萃取效果的影响Fig.2 Effect of different extraction temperature on extraction
2.3萃取时间的选择
固相微萃取是被分析物在样品基质和萃取头涂层之间的一个富集平衡过程,萃取开始时萃取头固定相中物质浓度增加地很快,接近平衡时速度极其缓慢,一旦达到平衡,被分析物在两相间的浓度达到恒定[12-13]。本实验考察了萃取时间为20 min、30 min、40 min、50 min、60 min的萃取效果,结果如图3所示。

图3 萃取时间对萃取效果的影响Fig.3 Effect of extraction time on extraction
由图3可知,随着萃取时间的延长,8种吡嗪类物质的萃取率均随之增加,其中萃取率在20~30 min、30~40 min两个时间段增加幅度相对较大,40~50 min时间段增加的幅度开始减小,当萃取时间为50 min时萃取率达到最大,萃取时间延长至60 min时,萃取率较50 min时不增反降,所以50 min是萃取头富集平衡的时间,即最佳萃取时间。也有报道认为萃取达到平衡之前萃取头涂层中吸附的物质量与其最终浓度就已存在一个比例关系,所以不必达到完全平衡[14]。因此,萃取时间可以选择为50 min。
2.4离子浓度的选择
固相微萃取头对目标物的萃取效率在受到平衡温度和平衡时间影响的同时,受样品中离子强度的影响也比较大。在样品中加入氯化钠可降低极性有机化合物的溶解度、产生盐析、提高分配系数,从而增强了萃取头固定相对分析组分的吸附性。
本实验通过考察样品中NaCl质量浓度在0.0、0.02 g/mL、0.05 g/mL、0.1 g/mL、0.2 g/mL、0.4 g/mL离子强度条件下吡嗪的萃取效果,结果如图4所示。
从视觉景观的角度来讲,教堂广场区域属于中心聚集型景观,其视觉景观的核心为天主教堂主建筑,这也是广场空间的重要观赏面.通过对教堂广场区域的分析发现,广场空间的视线聚集性较高区域保持在天主教堂主建筑附近,是视域整合度核心区,但不合理的空间设计使得广场中心区域的视线聚集性骤减,成为中山路街区良性发展的阻碍.因此,完善教堂广场区域视觉廊道体系势在必行.

图4 离子浓度对萃取效果的影响Fig.4 Effect of ion concentration on extraction
由图4可知,氯化钠质量浓度为0~0.05 g/mL时,萃取效果随着氯化钠质量浓度的增加呈现出上升趋势;当氯化钠质量浓度达到0.10 g/mL后,吡嗪类物质的萃取效果随着氯化钠质量浓度的增加呈缓慢下降趋势,因此选择,氯化钠质量浓度为0.05 g/mL时最有利于吡嗪类物质的萃取。此条件下,8种吡嗪类物质的萃取效率均较未加氯化钠的条件下高50%以上,较HOWARD K L等[15]报道的萃取率提升效果更为明显。
2.5解吸时间的选择
萃取头在吸附待测物质后,在汽化室解吸时间的长短也影响到萃取的效果,若萃取时间太短,以至吸附到萃取头上的目标物质不能完全被解吸,从而降低了检测的灵敏度;反之,若萃取时间太长,远远超过将吸附到萃取头上的目标物完全解吸所需的时间,这样的操作会严重缩短萃取头的寿命[16]。本实验通过考察1 min、2 min、3 min、4 min、5 min解吸时间条件下吡嗪类物质的解吸效果,结果如图5所示。

图5 解吸时间对萃取效果的影响Fig.5 Effect of desorption time on extraction
由图5可知,在1~3 min内,随着解吸时间的延长,吡嗪类物质的峰面积逐渐增加,并且增加的幅度也呈上升趋势,当解吸时间超过3 min后,所测吡嗪类物质的峰面积较3 min时有所下降,并且其峰面积在4 min和5 min时差别不是特别明显。因此选择最适解吸时间为3 min。另外发现,在所测8种吡嗪类物质中,彼此受解吸时间长短影响的大小不同,其中2-甲基吡嗪受解吸时间的影响最小,而2,3,5,6-四甲基吡嗪则受解吸时间的影响最大。
2.6 pH值的选择
pH值可以改变物质的溶解度、提高分配系数。萃取酸性或碱性物质时,可以通过调节样品的pH值来改善组分的亲脂性,从而大大提高萃取效率。酸性物质在酸性条件下萃取更好,碱性物质在碱性条件下萃取更好。本实验拟通过考察pH值为2、4、7、8、10、13条件下8种吡嗪类化合物的萃取效果,结果如图6所示。
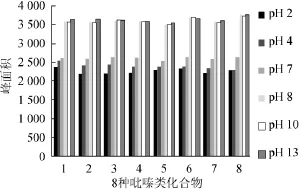
图6 pH值对萃取效果的影响Fig.6 Effect of pH on extraction
由图6可知,针对实验中8种吡嗪类化合物,其萃取效率受pH值的影响较大。各萃取效率随着pH值的增加而增加的幅度可以分为3个不同阶段:pH值为2~8时,吡嗪类物质的萃取效果随pH值的提高幅度相对明显,pH值为8时,各种物质的萃取效率提高的幅度最大;pH值为8~13时,随着pH值的增加,针对所测8种吡嗪类物质的萃取效率没有明显的变化,考虑到pH值过高或过低都将会对萃取头的固定相涂层造成损坏。因此选择最适萃取pH值为8。
2.7酒精度的选择
用双蒸水将色谱级无水乙醇稀释成5%vol、10%vol、15%vol、20%vol、40%vol等不同的酒精度梯度,再分别作为溶剂将8种吡嗪类物质稀释成相同浓度进行测试,结果如图7所示。
由图7可知,酒精度为10%vol~40%vol时,随着酒精度的增加,吡嗪类物质的萃取率呈明显的下降趋势。当酒精度<10%vol时,除2,3,5-三甲基吡嗪、2,3-二甲基-5-乙基吡嗪和2,3,5,6-四甲基吡嗪外,其他5种吡嗪受酒精度变化的影响不是很明显;与无酒精组相比,当酒精度为5%vol时,2-乙基-6-甲基吡嗪、2,3,5-三甲基吡嗪、2,3-二甲基-5-乙基吡嗪和2,3,5,6-四甲基吡嗪四种物质的萃取效率出现小幅度的增加。单从峰面积上来讲,5%vol是获得最佳萃取效果的最适酒精度;但当酒精度为0或5%vol时,所测8种吡嗪类物质的色谱峰半峰宽明显加大,同时2,5-二甲基吡嗪和2,6-二甲基吡嗪这2种物质难以获得较好的分离,因此选择萃取最适酒精度为10%vol。

图7 酒精度对萃取效果的影响Fig.7 Effect of alcohol content on extraction
2.8方法学考察
2.8.1线性范围及回归系数
经过上述7个因素的条件优化之后,即用高纯水将白酒样稀释至酒精度为10%vol,同时向样品中加入NaCl,并使其质量浓度为0.05 g/mL,调节样品体系的pH值为8;在70℃条件下,采用50/30 μm DVB/CAR/PDMS固相萃取头萃取50 min,汽化室温度250℃的条件下解吸3 min。对8种吡嗪的检测线性方程、线性范围及相关系数见表1。
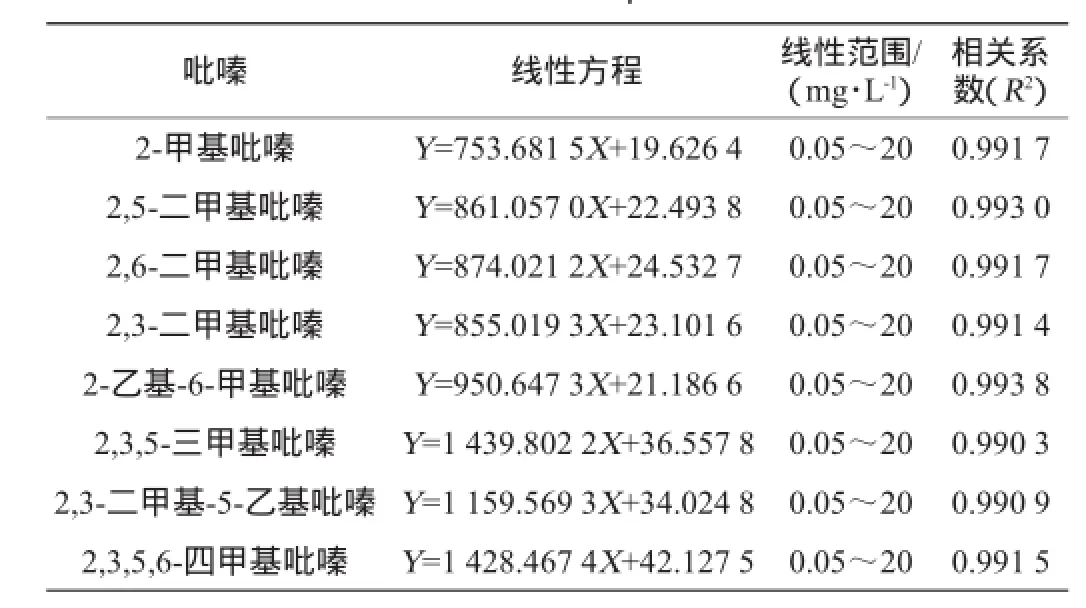
表1 方法的线性关系Table 1 Linear relationship of the method
从表1可以看出,8种吡嗪在本实验条件下可获得良好的分离效果,0.05~20 mg/L的线性范围内具有良好的线性关系,相关系数R2>0.99,可以满足准确定量分析要求。
2.8.2检出限、精密度及回收率
在酒精度为10%vol的乙醇水溶液中添加混合标准溶液,使样品中8种吡嗪的含量均为5 μg/L,在相同的优化前处理及色谱条件下测定,以信噪比S/N=3确定出方法检出限(limit of detection,LOD);另外,根据白酒中各种吡嗪含量的不同,在酒样中加入不同浓度的吡嗪标准品做加标回收率试验,其中2-甲基吡嗪、2,3-二甲基吡嗪、2,5-二甲基吡嗪分别添加0.1 mg/L、0.2 mg/L、0.5 mg/L不同水平质量浓度,另外5种吡嗪分别添加0.2 mg/L、1.0 mg/L、2.0 mg/L不同水平质量浓度,每个添加水平做6个平行样品,以6个平行样品的实验数据的相对标准偏差作为该方法的精密度(relative standard deviation,RSD),所得结果见表2。
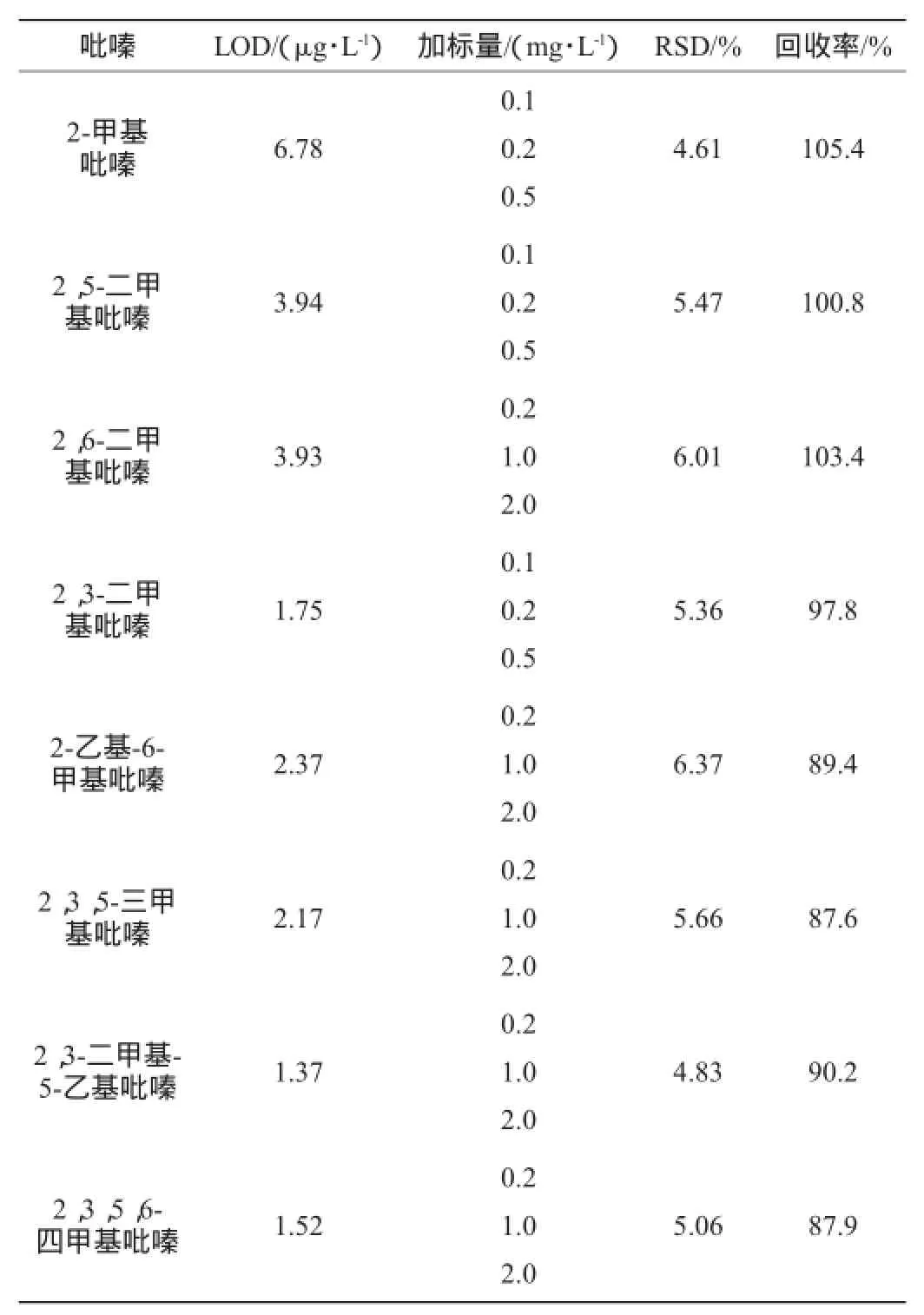
表2 方法的检出限、精密度及回收率试验结果Table 2 Tests results of LOD,precision,recovery rate of the method
由表2可知,本实验针对8种吡嗪化合物的检测方法8种吡嗪方法的检出限(S/N=3,LOD)为1.37~6.78μg/L,回收率87.6%~105.4%,相对标准偏差(RSD)为4.61%~6.37%。具有良好的精密度和回收率,检出限也能满足定量检测的要求。
2.9白酒样品中吡嗪类物质的检测
按照1.3.1给出的处理方法,结合1.3.2的色谱条件,对8种吡嗪标准品和5种酱香型白酒进行测定,标准物质和样品色谱图如图8、图9所示,5种酱香型白酒中吡嗪化合物的含量见表3。

图8 8种吡嗪类标准物质的GC-FID色谱图(0.5 mg/L)Fig.8 GC-FID chromatogram of eight kinds of pyrazine standard (0.5 mg/L)

图9 1#白酒样品中8种吡嗪类标准物质的GC-FID色谱图Fig.9 GC-FID chromatogram of eight kinds of pyrazine standard in 1#Baijiusample

表3 5种酱香型白酒中吡嗪化合物的含量Table 3 Contents of pyrazine compounds in five kinds of Moutai-flavourBaijiumg/L
由表3可知,1#酒样中8种吡嗪类化合物的总含量最高,为25.72 mg/L;2#酒样次之,5#酒样最少,为5.87 mg/L。2,3,5,6-四甲基吡嗪是所测8种吡嗪类化合物中最高的,1#酒样的含量达19.01 mg/L。
3 结论
实验结果表明,顶空固相微萃取-气相色谱法检测白酒中吡嗪类化合物的最佳条件为用高纯水将白酒样稀释至酒精度为10%vol,同时向样品中加入NaCl,并使其质量浓度为0.05 g/mL,调节样品体系的pH值为8;在70℃条件下,采用50/30μmDVB/CAR/PDMS固相萃取头萃取50min,汽化室温度250℃的条件下解吸3 min。
本实验所选的5种酱香型白酒中均富含吡嗪类物质。针对所测8种吡嗪,不同的白酒中含量不尽相同,但其中2,3,5,6-四甲基吡嗪、2,3,5-三甲基吡嗪、2,6-二甲基吡嗪的含量均排名前三,是所测白酒样品中表现出的共性。由于吡嗪类物质风味阈值极低,故会对白酒香味产生较大的影响,是形成白酒酱香型的重要物质。酱香型白酒的生产工艺中高温制曲、高温堆积发酵过程是生成吡嗪类物质的重要原因,所以吡嗪类物质的研究是酱香白酒研究的一个重要组成部分,本研究所得到的方法也将会为酱香白酒品质的研究以及真伪的鉴定提供有力的技术支持。
[1]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[2]孙棣,赵贵斌,杨波.酱香型白酒中吡嗪类化合物的检测及特点[J].中国酿造,2015,34(12):162-166.
[3]王柏文,信春晖,韩睛睛,等.顶空固相微萃取结合GC/NPD技术分析芝麻香白酒中含氮化合物[J].中国食品学报,2015(4):247-253.
[4]FAN W,QIAN M C.Headspace solid phase microextraction and gas chromatography-olfactometry dilution analysis of young and aged Chinese Yanghe Daqu liquors[J].J Agric Food Chem,2005,53(20):7931-7938.
[5]LOPEZ R,AZNAR M,CACHO J,et al.Determination of minor andtrace volatile compounds in wine by solid-phase extraction and gas chromatography with mass spectrometric detection[J].J Chromatogr A,2002,966 (1/2):167-177.
[6]SALA C,MESTRES M,MARTI M P,et al,Headspace solid-phase microextractionanalysisof 3-alkyl-2-methoxypyrazinesinwines[J].J Chromatogr A,2002,953(1-2):1-6.
[7]张艳红,范文来,徐岩,等.顶空固相微萃取与气相色谱-火焰热离子检测器联用测定白酒中吡嗪类化合物[J].分析实验室,2008,27(6):39-40.
[8]王莉,吴建霞,雷良波.气相色谱-质谱-离子扫描联用法快速检测白酒中4种吡嗪类化合物[J].中国酿造,2009,28(3):148-150.
[9]周庆伍,汤有宏,徐祥浩,等.采用GC×GC-TOFMS结合顶空固相微萃取技术检测枯草芽孢杆菌发酵液中吡嗪类物质[J].食品科学,2016,37(6):157-160.
[10]梅明明,朱婧,李妍,等.气相色谱-质谱法测定白酒中3种吡嗪类化合物[J].现代预防医学,2015,42(14):2597-2599.
[11]周永妍,李亚,余爱农.顶空固相微萃取法萃取Maillard反应体系中吡嗪类化合物的条件优化[J].食品科学,2015,36(6):119-123.
[12]王国明,尹婉嫱,乔阳,等.浓香型“山庄老酒”中吡嗪类物质的分析研究[J].中国酿造,2015,34(4):146-149.
[13]司冠儒,张温清,张显,等.HPLC快速检测芝麻香型白酒中四甲基吡嗪[J].酿酒,2014,41(5):89-91.
[14]肖天鹏,郑晓峰,吕吉鸿,等.顶空-固相微萃取-气相色谱法检测可可麦汁中吡嗪类化合物[J].分析化学,2012,40(10):1589-1592.
[15]HOWARD K L,MIKEJH,RIESENR.Validation of a solid-phase microextraction method for headspace analysis of wine aroma components [J].Am J Enol Viticult,2005,56(1):37-45.
[16]沈海月,范文来,徐岩,等.应用顶空固相微萃取分析四种红葡萄酒挥发性成分[J].酿酒,2008,35(2):71-74.
Detection of pyrazine compounds inBaijiuby HS-SPME-GC
HUANG Jialing,LIAO Yanyan*,SUN Di,ZHANG Qian,LONG Sihong
(China National Quality Supervision and Testing Center for Inebriant and Food,Guizhou Institute of Product Quality Supervision and Inspection,Guiyang 550016,China)
The conditions of sample pretreatment and extraction of pyrazine compounds inBaijiuwere optimized by HS-SPME-GC.The optimum detection conditions were as follows:alcohol content inBaijiusimple was diluted to 10%vol by pure water.NaCl was added into the sample and its content was 0.05 g/ml.The pH of sample was adjusted to 8.TheBaijiusimple was extracted at 70℃for 50 min with 50/30 μm DVB/CAR/PDMS solid phase extraction head,and the head was desorbed under 250℃for 3 min.Methodology results showed that there was a good linear relationship in the range of 0.05-20 mg/L,the correlation coefficientRwas more than 0.99.The limit of detection(S/N=3)of eight kinds of pyrazine compounds was 1.37-6.78 μg/L.The recovery rate was 87.6%-105.4%.The relative standard deviation was 4.61%-6.37%.The pyrazine compounds contents in sample detected by the method were 0-29 mg/L,the pyrazine compounds contents in 1#Baijiusimple was the highest and was up to 25.72 mg/L.
pyrazine compounds;HS-SPME;GC;Baijiu
O657.7
0254-5071(2016)08-0163-06
10.11882/j.issn.0254-5071.2016.08.037
2016-05-25
酱香型白酒中吡嗪类化合物的检测方法研究(2013QK249)
黄家岭(1982-),男,工程师,硕士,研究方向为食品科学与质量安全。
廖妍俨(1982-),女,工程师,硕士,研究方向为食品科学与质量安全。

