内切葡聚糖酶基因cel7b在里氏木霉中的同源表达
顾斌涛,黄国昌,熊大维
(江西省科学院微生物研究所,江西南昌330096)
内切葡聚糖酶基因cel7b在里氏木霉中的同源表达
顾斌涛,黄国昌,熊大维
(江西省科学院微生物研究所,江西南昌330096)
用里氏木霉(Trichoderma reesei)作为宿主同源表达内切葡聚糖酶基因。运用聚合酶链反应(PCR)技术从里氏木霉cDNA中扩增得到内切葡聚糖酶基因cel7b序列,并将其连接到载体p18-m2上构建重组质粒,将重组质粒转化到里氏木霉菌株中,通过筛选获得表达内切葡聚糖酶的重组里氏木霉工程菌。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测显示,发酵液中重组内切葡聚糖酶的分子质量约48 ku。摇瓶发酵结果显示,内切葡聚糖酶在重组里氏木霉中得到分泌表达,发酵液中的内切葡聚糖酶和滤纸酶活分别达到了726 U/mL和28.7 U/mL,分别为出发菌株酶活的2.9倍和1.1倍。玉米芯进行糖化试验结果显示,重组里氏木霉所产酶液糖化玉米芯的酶解得率为81.4%,比出发菌株提高了6.3%。
内切葡聚糖酶;里氏木霉;纤维素酶;同源表达
纤维素酶为一组能水解纤维素β-1,4葡萄糖苷键的复合酶,包括外切葡聚糖酶(又称为纤维二糖水解酶)、内切葡聚糖酶和β-葡萄糖苷酶[1-3]。内切葡聚糖酶作用于纤维素长链分子内部非结晶区,通过水解β-1,4糖苷键将长链的纤维素大分子切成短纤维,由于内切葡聚糖酶能特异性水解纤维素分子,因此在纺织、造纸和洗涤等工业中发挥着重要作用[4-6]。内切葡聚糖酶广泛存在于自然界的细菌、真菌和植物等各类生物体中[7-9]。近几十年来对内切葡聚糖酶基因的克隆和表达研究较为普遍,内切葡聚糖酶基因的常见表达宿主菌有大肠杆菌、酵母和丝状真菌。DHARA H等[10]克隆了类芽孢杆菌属(Paenibacillussp.)的内切葡聚糖酶基因并在大肠杆菌中表达。KARAOURI A C等[11]克隆了嗜热毁丝霉(Myceliophthora thermophila)的内切葡聚糖酶基因并在毕赤酵母中表达。YIN Y R等[12]克隆了耐盐嗜热裂孢菌(Thermobifida halotolerans)的内切葡聚糖酶基因并在大肠杆菌中表达。WANG W等[13]将内切葡聚糖酶和外切葡聚糖酶基因在里氏木霉(Trichoderma reesei)中进行共表达,共表达重组菌株所产酶液比表达单独酶组分具有更高降解纤维素的活性。
里氏木霉(Trichoderma reesei)是目前工业上重要的产纤维素酶的菌种,具有纤维二糖水解酶基因I强启动子,大量同源或异源酶基因已经在里氏木霉中获得表达[14-17]。里氏木霉纤维二糖水解酶活性较高,内切葡聚糖酶和β-葡萄糖苷酶的活性偏低。里氏木霉内切葡聚糖酶基因cel7b表达的酶蛋白CEL7B具有较高的酶比活力,并含有纤维素结合结构域,具有较强的降解羧甲基纤维素的能力。为增强里氏木霉内切葡聚糖酶的活性,本试验以里氏木霉内切葡聚糖酶基因cel7b为目的基因,利用聚合酶链反应(polymerase chain reaction,PCR)从里氏木霉中克隆到cel7b基因,用根瘤农杆菌转化法将其导入到里氏木霉中进行表达,获得高效表达内切葡聚糖酶基因的重组里氏木霉菌,进一步对重组菌进行发酵产酶及利用酶液对玉米芯进行糖化。本研究在构建高产内切葡聚糖酶菌株和利用纤维素资源生产还原糖方面具有意义。
1 材料与方法
1.1材料与试剂
1.1.1菌株和质粒
里氏木霉(Trichoderma reesei)WU3和质粒p18-m2(含纤维二糖水解酶Ⅰ基因启动子及信号肽和潮霉素磷酸转移酶基因)均为实验室保存。
1.1.2试剂
限制性内切酶:加拿大Fermentas公司;T4脱氧核糖核酸(deoxyribose nucleic acid,DNA)连接酶、TaqDNA聚合酶:大连宝生物公司;质粒小量提取和核糖核酸(ribonucleic acid,RNA)抽提试剂盒:上海生工公司;羧甲基纤维素钠(carboxyl methyl cellulose-Na,CMC-Na):美国Sigma公司。其他化学试剂为国产分析纯。
1.1.3培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆200 g/L,葡萄糖20 g/L,琼脂粉18 g/L。200 g去皮的土豆切成小块,加水800 mL煮沸30 min,用纱布过滤,补足水至1 000 mL,加20 g/L葡萄糖。固体培养基加18 g/L琼脂粉。115℃湿热灭菌30 min。
CMC筛选培养基:羧甲基纤维素钠20 g/L,KH2PO48g/L,(NH4)2SO45g/L,MgSO40.6g/L,FeSO4·7H2O0.005g/L,CaCl20.6 g/L,MnSO4·H2O 0.001 6 g/L,ZnSO4·7H2O 0.001 4 g/L,CoC12·6H2O 0.003 7 g/L,琼脂粉18 g/L,121℃湿热灭菌20 min。
1.2仪器与设备
ZWY-2102C恒温摇床:上海智城分析仪器制造有限公司;ZF-288凝胶成像系统:上海嘉鹏科技有限公司;UV-6100紫外可见分光光度计:上海元析仪器有限公司;EPS600电泳仪:上海天能科技有限公司;MG25+PCR仪:杭州郎基科学仪器有限公司;H1650-W离心机:湖南湘仪实验室仪器开发有限公司。
1.3方法
1.3.1内切葡聚糖酶基因的克隆
采用真菌总RNA抽提试剂盒提取里氏木霉WU3菌丝体总RNA,并用互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)合成试剂盒获得cDNA。根据现有内切葡聚糖酶基因序列设计合成引物。上游引物:CTGGATCCTTGTCCCAAAATGGCGCCCT;下游引物:CTTCTAGAGTCTTATATATTAAGCCCAA。PCR扩增反应条件为:95℃预变性5min,94℃、40s→64℃、40s→72℃、100 s,29次循环,72℃延伸8 min。将扩增得到的目的片段进行电泳并进行胶回收,连入pMD18-T simple Vector测序后保存。
1.3.2重组载体的构建
双酶切质粒p18-m2,用T4连接酶将内切葡聚糖酶基因片段连接至纤维二糖水解酶Ⅰ启动子PcbhⅠ和终止子之间,得到重组质粒p18-m2cel。
1.3.3酶基因导入里氏木霉
采用根瘤农杆菌转化法将质粒p18-m2cel导入里氏木霉WU3[7],其中PDA抗性平板潮霉素B质量浓度为100 μg/mL。将PDA平板上培养的转化子菌落转接到CMC筛选培养基平板上培养,选取菌落直径大的木霉转化子保存。
1.3.4转化子产酶试验
以出发菌WU3为对照,在PDA平板上培养转化子5 d,接到种子培养基培养2 d,转接至产酶培养基(摇瓶装液量50 mL/250 mL),在温度30℃和转速180 r/min条件下培养48 h。每株菌种做3个平行实验。
1.3.5十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳样品取发酵液离心后的上清液,采用12%的聚丙烯酰胺,0.1%考马斯亮蓝R-250染色,乙酸∶甲醇∶水1∶2∶7(V/V)脱色。电泳上样量10 μL,电泳凝胶的配方、电泳的参数以及凝胶的染色、脱色等参照标准实验方法进行。
1.3.6酶活力测定
内切葡聚糖酶活(endoglucanase activity,EGA)定义:用柠檬酸缓冲液(0.05 mol/L、pH 4.8)配制的1%羧甲基纤维素钠与稀释500倍的纤维素酶液在50℃水浴反应30 min后,3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定上清液中的还原糖。每小时由底物产生1.0 mg还原糖所需的酶量为一个活力单位,用U/mL表示。
纤维二糖水解酶活(cellobiohydrolase activity,CBHA)定义:微晶纤维素为底物与稀释10倍的纤维素酶液在50℃水浴反应30 min后,DNS法测定上清液中的还原糖。每小时由底物产生1.0 mg还原糖所需的酶量为一个活力单位,用U/mL表示。
β-葡萄糖苷酶活(β-glucosidase activity,BGA)定义:以纤维二糖为底物,用葡萄糖氧化酶法测定。每个单位的β-葡萄糖苷酶活力为每小时水解1.0 mg纤维二糖所需的酶量,用U/mL表示。
滤纸酶活力(filter paper cellulase activity,FPA)定义:取Whatman No.1滤纸与稀释20倍的纤维素酶液在50℃水浴反应30 min后,DNS法测定上清液中的还原糖。一个单位的滤纸酶活力为1 h生成1.0 mg还原糖所需的酶量,用U/mL表示。
1.3.7玉米芯酶解实验
用酸处理(1%硫酸110℃处理60 min)后的玉米芯残渣作为底物,加入纤维素酶在pH 5.0、50℃、100 r/min的水浴摇床进行水解,用酶量为每1 g底物8 mL酶液,DNS法测定酶解液中的还原糖含量。酶解得率计算公式如下:
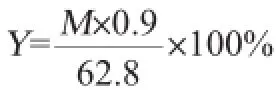
式中:Y为酶解得率,%;M为还原糖总量,g;62.8为每100 g底物中纤维素和半纤维素的质量,g。
2 结果与分析
2.1基因的克隆
通过反转录酶-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法扩增cel7b基因,电泳显示获得长度约为1.4 kbp的DNA片段(图1)。通过测序显示该基因序列全长为1 377 bp,编码459个氨基酸;Blast比对分析显示基因同源率为99%,而蛋白序列的同源率为100%,可以确定该基因为里氏木霉(Trichoderma reesei)cel7b基因。
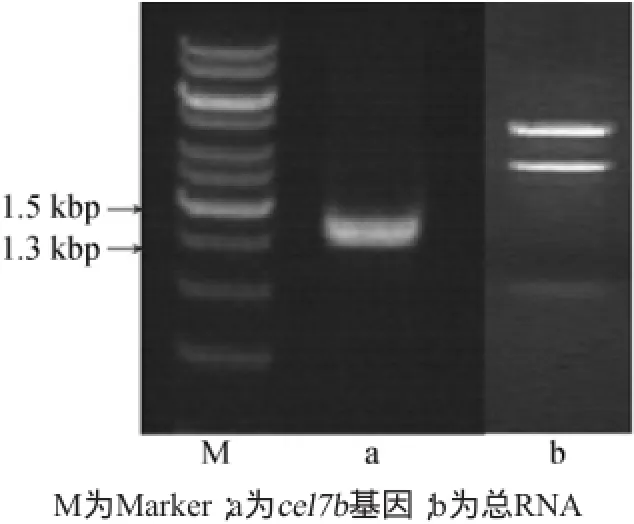
图1 RT-PCR扩增cel7b基因和总RNA的电泳图Fig.1 Electrophoretogram of RT-PCR amplification products of genecel7band total RNA
2.2转化子的产酶
通过农杆菌介导转化法获得156株木霉转化子,进一步在筛选培养基上初筛获得6株菌落直径>4.0 cm的菌株,依次命名为E1~E6。将6株菌株进行发酵产酶,结果见图2。
由图2可知,木霉转化子内切葡聚糖酶活比出发菌株都有较大提高,转化子E4菌株内切葡聚糖酶活为726 U/mL,为出发菌株WU3(248 U/mL)的2.9倍,滤纸酶活为28.7 U/mL,是出发菌株WU3(25.4 U/mL)的1.1倍。进一步分析纤维素酶酶系的组分,结果见表1。由表1可知,菌株E4的β-葡萄糖苷酶活与出发菌株WU3相差不大,纤维二糖水解酶活略低于出发菌株WU3,这说明转化子E4菌株滤纸酶活的提高主要由于其内切葡聚糖酶活较高。丁新丽等[18]将里氏木霉内切葡聚糖酶基因cel7b片断分别插入酵母met10和pgk1启动子和终止子序列之间,构建质粒并通过电转化导入到酿酒酵母菌株中,获得的酵母转化子表达内切葡聚糖酶活力为126.7 U/mL。

图2 重组里氏木霉产酶结果Fig.2 Results of enzyme production by recombinantT.reesei

表1 纤维素酶组分的测定结果Table 1 Determination results of cellulase componentsU/mL
2.3蛋白电泳检测内切葡聚糖酶的表达
用SDS-PAGE检测重组里氏木霉发酵液上清中的酶蛋白表达产物,电泳结果显示在66.2 ku和42.7 ku之间有一条较浓的条带,而对照出发菌株发酵液上清中此位置的条带较浅(见图3)。根据蛋白电泳的分子质量和迁移率的关系,计算出该蛋白的分子质量约为48 ku。

图3 发酵酶液SDS-PAGE分析Fig.3 SDS-PAGE analysis of fermentation liquid
2.4纤维素酶对玉米芯的糖化
用重组里氏木霉E4和出发菌株WU3的酶液分别对10 g酸处理后的玉米芯纤维残渣进行糖化试验,结果见表2。由表2可知,采用菌株E4产纤维素酶进行的酶解糖化试验,酶解得率为81.4%,比出发菌株(酶解得率75.1%)提高了6.3%。

表2 玉米芯纤维酶解结果Table 2 Results of enzymatic hydrolysis of corncob fiber
纤维素酶的3种组分外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶在水解纤维素的过程中需要互相配合,协同降解。对于木质纤维素酶解产可发酵糖来说,需要组分全面的纤维素酶系。传统的纤维素酶系研究中,常通过“鸡尾酒”法,即通过勾兑各纤维素酶系组分的比例对特定的木质纤维素原料进行最优降解。通过基因工程高表达纤维素酶系组分也是纤维素酶系研究的一个重要研究方向。酶蛋白CBHⅠ占里氏木霉总分泌蛋白的50%~60%,其启动子PcbhⅠ为强启动子,可用于表达里氏木霉纤维素酶各组分。WANG B等[19]通过高表达β-葡萄糖苷酶组分使里氏木霉的总纤维素酶活提高了44%。FANGH等[20]利用启动子PcbhⅠ高表达里氏木霉外切葡聚糖酶组分,获得的重组里氏木霉菌株的总纤维素酶活为出发菌株的4.3倍。另外,多拷贝也是基因高效表达的常用技术方法,考虑到用于强启动子表达的各种调控因子不足,对PcbhⅠ启动子中CCAAT盒和Ace2结合位点序列进行多拷贝以增加表达量[21]。
3 结论
本实验从里氏木霉菌株中成功克隆到内切葡聚糖酶基因cel7b,将该基因置于里氏木霉的强启动子及信号肽下用农杆菌转化法导入里氏木霉宿主进行表达,通过筛选得到6株里氏木霉转化子。在摇瓶条件下,重组菌产内切葡聚糖酶、滤纸酶活力分别提高至出发菌株的2.9倍、1.1倍,成功实现了内切葡聚糖酶基因在里氏木霉中的高效同源表达。重组菌所产纤维素酶对玉米芯纤维残渣的酶解得率为81.4%,比出发菌株提高了6.3%。表明重组里氏木霉E4因含有高活力的内切葡聚糖酶,能提高纤维素酶各组分的协同酶解性能,能更加有效地水解木质纤维素,该重组菌株的构建对于高产内切葡聚糖酶菌株的构建和提高纤维素酶的催化活性具有研究意义,在木质纤维素的降解方面有较大应用价值。
[1]LIU K M,DONG Y M,WANG F Z,et al.Regulation of cellulase expression,sporulation,and morphogenesis by velvet family proteins inTrichoderma reesei[J].Appl Microbiol Biotechnol,2016,100(2):769-779.
[2]DASHTBAN M,MAKI M,LEUNG K T,et al.Cellulase activities in biomass conversion:measurement methods and comparison[J].Crit Rev Biotechnol,2010,30(4):302-309.
[3]ATREYA M E,STROBEL K L,CLARK D S.Alleviating product inhibition in cellulase enzyme Cel7A[J].Biotechnol Bioeng,2016,113(2):330-338.
[4]SARAVANAN D,VASANTHI N S,RAMACHANDRAN T.A review on influential behaviour of biopolishing on dyeability and certain physico-mechanical properties of cotton fabrics[J].Carbohyd Polym,2009, 76(1):1-7.
[5]JUTURU V,WU J C.Microbial cellulases:Engineering,production and applications[J].Renew Sust Energ Rev,2014,33(6):188-203.
[6]LIU S L,LI R H,DU K.Greatly enhanced secretion,soluble expression and characterization of an alkaline endoglucanase inEscherichia coli[J]. J Pure Appl Micro,2013,7(1):371-378.
[7]TANG B,PAN H B,ZHANG Q Q,et al.Cloning and expression of cellulase geneEG1 fromRhizopusstolonifervar.reflexusTP-02 inEscherichia coli[J].Bioresour Technol,2009,100(23):6129-6132.
[8]AKBARZADEH A,SIADAT S O R,MOTALLEBI M,et al.Characterization and high level expression of acidic endoglucanase inPichia pastoris[J].Appl biochem biotechnol,2014,172(4):2253-2265.
[9]HUANG X,SHAO Z,HONG Y.Cel8H,a novel endoglucanase from the halophilic BacteriumHalomonassp.S66-4:Molecular cloning,heterogonous expression,and biochemical characterization[J].J Microbiol, 2010,48(3):318-324.
[10]DHARA H,KASANAB R C,GULATI A.Heterologous expression and characterization of detergent stable endoglucanase EG5B fromPaenibacillussp.IHB B 3084[J].J Mol Catal B-Enzym,2015,120:9-15.
[11]KARNAOURI A C,TOPAKAS E,CHRISTAKOPOULOS P.Cloning, expression,and characterization of a thermostable GH7 endoglucanase fromMyceliophthora thermophilacapable of high-consistency enzymatic liquefaction[J].Appl Microbiol Biotechnol,2014,98(1):231-242.
[12]YIN Y R,ZHANG F,HU Q W,et al.Heterologous expression and characterization of a novel halotolerant,thermostable,and alkali-stable GH6 endoglucanase fromThermobifida halotolerans[J].Biotechnol Lett, 2015,37(4):857-862.
[13]WANG W,MENG F,LIU P,et al.Construction of a promoter collection for genes co-expression in filamentous fungusTrichoderma reesei [J].J Ind Microbiol Biotechnol,2014,41(11):1709-1718.
[14]GU B T,XIA L M.High expression of a neutral endo-β-glucanase gene fromHumicola insolensinTrichoderma reesei[J].J Ind Microbiol Biotechnol,2013,40(7):773-779.
[15]ZHANG J,ZHONG Y,ZHAO X,et al.Development of the cellulolytic fungusTrichoderma reeseistrain with enhanced β-glucosidase and filter paper activity using strong artifical cellobiohydrolase 1 promoter[J]. Bioresource Technol,2010,101(24):9815-9818.
[16]王芳,陈介南,张林,等.产纤维素酶里氏木霉的研究进展[J].中国酿造,2014,33(6):1-5.
[17]ZOU G,SHI S,JIANG Y,et al.Construction of a cellulase hyper-expression system inTrichoderma reeseiby promoter and enzyme engineering[J].Microb Cell Fact,2012,11(1):21-32.
[18]丁新丽,黄晶,汪天虹.瑞氏木霉内切葡聚糖酶基因在酿酒酵母中的表达研究[J].食品与发酵工业,2004,30(11):18-22.
[19]WANG B,XIA L.High efficient expression of cellobiase gene fromAspergillus nigerin the cells ofTrichoderma reesei[J].Bioresour Technol,2011,102(6):4568-4572.
[20]FANG H,XIA L.High activity cellulose production by recombinant Trichoderma reeseiZU-02 with the enhanced cellobiohydrolase production[J].Bioresour Technol,2013,144(3):693-697.
[21]LIU T,WANG T,LI X,et al.Improved heterologous gene expression in Trichoderma reeseiby cellobiohydrolase I gene(cbh1)promoter optimization[J].Acta Bioch Bioph Sin,2008,40(2):158-165.
Homologous expression of endoglucanase genecel7binTrichoderma reesei
GU Bintao,HUANG Guochang,XIONG Dawei
(Institute of Microbiology,Jiangxi Academy of Sciences,Nanchang 330096,China)
Using theTrichoderma reeseias host,the endoglucanase gene was homologously expressed.The endoglucanase genecel7bsequence was amplified by polymerase chain reaction(PCR)fromT.reeseicDNA.The amplified products were ligated into the carrier p18-m2 to construct recombinant plasmid.The recombinant plasmid was transformed intoT.reeseistrain,and a recombinationT.reeseiengineering strain of expressing endoglucanase was obtained by screening.The results of sodium dodecyl sulfate polyacrylamide gel electrophoresis showed that the molecular mass of recombination endoglucanase in fermented liquid was about 48 ku.The results of shaking flask fermentation showed that endoglucanase in recombinantT.reeseiwas secreted and expressed.The endoglucanase activity in fermented liquid and filter paper were up to 726 U/ml and 28.7 U/ml,respectively,which were 2.9 times and 1.1 times than that of original strain,respectively.The results of saccharification tests of corncob showed that enzymatic hydrolysis yield of corncob saccharified by enzyme from recombinantT.reeseicellulase was 81.4%,which was 6.3%higher than that of original strain.
endoglucanase;Trichoderma reesei;cellulase;homologous expression
Q566.2
0254-5071(2016)08-0129-04
10.11882/j.issn.0254-5071.2016.08.029
2016-03-29
江西省科研院所基础设施配套项目(20142BBA13030);江西省科学院科研开发专项基金(2014-YYB-01);江西省科学院协同创新专项资金普惠一类项目(2013-XTPH-29)
顾斌涛(1980-),男,助理研究员,博士,研究方向为工业酶制剂。

