神经生长因子预处理对神经损伤大鼠脊髓脱髓鞘反应的影响
赵广翊,丁旭东,黄威,李丹
神经生长因子预处理对神经损伤大鼠脊髓脱髓鞘反应的影响
赵广翊,丁旭东,黄威,李丹
(中国医科大学附属盛京医院麻醉科,沈阳 110004)
目的探讨鞘内注射神经生长因子(NGF)预处理对局麻药所致神经损伤大鼠脊髓脱髓鞘反应的影响。方法雄性SD大鼠24只,体质量250~280 g,采用随机数字表法将其分为4组(n=6):假手术组(S组)、神经损伤组(L组)、生理盐水组(NS组)和NGF预处理组(NGF组)。L组、NS组和NGF组均在鞘内置管后1 d鞘内注射10%利多卡因20 μL,其中NGF组在注射利多卡因前1 h,鞘内注射NGF 30 μg(20 μL)预处理。于鞘内注射利多卡因后1 d、2 d和3 d时测定甩尾潜伏期(TFL)。行为学测试完成后取脊髓组织,采用免疫组化法测定髓鞘碱性蛋白(MBP)的表达,Western blot法测定p38 MAPK磷酸化表达水平。结果与S组比较,L组和NS组鞘内注射利多卡因后1~3 d TFL均延长,脊髓内MBP的含量减少,p38 MAPK磷酸化的表达上调(P<0.05),与L组比较,NGF组于鞘内注射利多卡因后2 d和3 d TFL缩短,脊髓内MBP的含量增加,磷酸化p38 MAPK的表达下调(P<0.05)。结论NGF预处理可减轻局麻药所致神经损伤大鼠脊髓急性脱髓鞘反应,机制与抑制p38 MAPK的磷酸化表达有关。
神经营养因子类;利多卡因;药物毒性;脱髓鞘反应;p38 MAPK
网络出版地址
利多卡因鞘内注射可导致脊髓组织脱髓鞘改变[1]。前期研究[2⁃3]已证实鞘内注射外源性神经生长因子(nerve growth factor,NGF)可减轻利多卡因所诱发的大鼠脊髓神经毒性,并减少神经元的凋亡,但具体机制尚不清楚。髓鞘碱性蛋白(myelin basic protein,MBP)是一种强碱性膜蛋白,为脱髓鞘反应的标记物。主要功能是维持中枢神经系统髓鞘结构和功能的稳定。p38 MAPK主要参与调控细胞的增殖、凋亡和分化。LIRK等[4]研究发现,利多卡因的神经毒性与p38 MAPK的激活密切相关,进一步发现p38 MAPK抑制剂具有潜在的神经保护作用,可抑制利多卡因诱发的神经细胞损伤的轴突退变[5]。然而,给予外源性NGF预处理能否有效控制利多卡因所造成的神经损伤,其机制是否与抑制脱髓鞘损伤和p38 MAPK磷酸化有关鲜有报道。本研究旨在首先明确外源性NGF预处理可否抑制利多卡因造成的急性脱髓鞘损伤,进而确定其是否通过抑制p38 MAPK的过表达实现神经保护。
1 材料与方法
1.1动物选择及分组
清洁级雄性SD大鼠24只,体质量250~280 g,8~10周龄,由中国医科大学附属盛京医院动物实验中心提供,于室温24℃,湿度55%~65%的环境中饲养,自由摄食和饮水。采用随机数字表法将其分为4组(n=6):假手术组(S组)、神经损伤组(L组)、生理盐水组(NS组)和NGF预处理组(NGF组)。S组仅行鞘内置管术。L组、NS组和NGF组均在鞘内置管后第1天,鞘内注射10%盐酸利多卡因20 μL,其中NGF组在鞘内注射利多卡因前1 h,鞘内注射NGF 30 μg(20 μL)预处理,NS组在鞘内注射利多卡因前1 h,鞘内注射0.9%生理盐水20 μL对照。
1.2鞘内置管
参照文献[6]进行鞘内置管。腹腔注射10%水合氯醛350 mg/kg麻醉,俯卧位于脊柱下段两侧可触及一对钝形突起的髂结节,其水平连线为L6水平,剪毛、碘伏消毒,于背部正中线L4~5间隙处做长约2 cm的皮肤纵切口,切开筋膜,钝性分离L4及L5棘突周围肌肉,暴露L4~5棘突间隙,暴露上下关节突间黄韧带并提起下位棘突,用PE⁃10导管尖端穿破黄韧带及硬脊膜,以鼠尾突然出现侧摆或后腿抽动为导管成功到达椎管内的标志。于显微镜下经硬脊膜破口向尾侧插入PE⁃10导管2 cm,导管尖端位于骶1水平,可见导管内充盈清亮的脑脊液,为鞘内置管成功。术毕第1天鞘内注射1%利多卡因20 μL,30 s内出现双下肢瘫痪为利多卡因筛选试验阳性,如钳夹双上肢躲避反应存在,但钳夹双下肢及尾部逃避反应消失,则选入实验。术毕出现四肢瘫痪、活动障碍及利多卡因试验阴性或出现单侧肢体瘫痪者排除出实验。
1.3指标与方法
1.3.1行为学观察:参照文献[7]方法,于术前测定各组大鼠的甩尾潜伏期(tail⁃flick latency,TFL)作为基础值,再分别于鞘内注射利多卡因后1 d、2 d和3 d时测试各组大鼠的TFL。将大鼠放在玻璃板上,安静后,开启BME⁃410C全自动热痛刺激仪(中国医学科学生物医学工程研究所)的卤素灯作为热辐射光源,照射鼠尾中后3、5、7 cm处,记录从热源启动到大鼠甩尾的时间(即TFL),每点测定1次,间隔为5 min,取平均值作为热痛阈。切断时间设定为30 s,以防大鼠尾部皮肤造成损伤。如果在25 s内大鼠无甩尾反应,则TFL记为30 s。
1.3.2脊髓组织病理形态学的测定:于鞘内注射利多卡因后3 d行为学测试完成后,腹腔注射10%水合氯醛300 mg/kg麻醉,开胸后经心脏灌注4%多聚甲醛。分离并取L4~6段脊髓组织,经多聚甲醛后固定24 h,行石蜡包埋组织切片,片厚4 μm。分别行苏木素-伊红(HE)染色,于光学显微镜下观察。HE染色具体做法为切片用自来水洗片刻,蒸馏水洗片刻,苏木精浸染1~2 min,自来水冲洗片刻,1%盐酸乙醇分化3~5 s左右,自来水冲洗数分钟至数小时,1%的氨水分化3~5 s左右,自来水冲洗数分钟至数小时,蒸馏水冲洗片刻,85%的乙醇脱水10 min,95%的乙醇脱水10 min,0.5%的伊红溶液浸染1~2 min,脱水(95%、100%、100%的乙醇各10 min),透明(二甲苯10 min,3次),中性树胶封固,观察。
1.3.3MBP免疫组化检测:SABC法进行免疫组织化学染色。一抗为兔抗大鼠MBP,抗体工作浓度为1∶1 000,4℃冰箱孵育过夜,DAB显色,苏木精复染,脱水,透明,封片。阴性对照用PBS替代第一抗体,胞质出现棕黄色颗粒为阳性。光镜下(×400)每张切片随机拍摄10个不重复的视野,用Image⁃Pro Plus图像分析软件测量MBP免疫反应产物的平均光密度(average optical density,AOD)值。
1.3.4p38 MAPK蛋白磷酸化水平的测定:采用Western blot法,使用细胞裂解液提取蛋白,用Brad⁃for法进行蛋白定量,采用蛋白定量测定试剂盒(上海美季生物技术有限公司)。取蛋白在SDS⁃聚丙酰胺凝胶上电泳,后转移至PVDF膜,5%脱脂奶37℃封闭1 h,加入兔抗大鼠p38 MAPK单克隆抗体(1∶1 000,美国Santa Cruz公司),4℃孵育过夜;加入碱性磷酸酯酶标记山羊抗兔IgG抗体(1∶2 000,美国Santa Cruz公司),常温孵育2 h,曝光成像。用Scion Image软件检测磷酸化p38 MAPK(p⁃p38 MAPK)目的条带和p38 MAPK总蛋白条带的灰度值,其比值作为p38 MAPK磷酸化蛋白的相对表达量。
1.4统计学分析
采用SPSS 17.0统计软件进行分析,计量资料多组间比较采用单因素方差分析,多组间两两比较采用SNK法。P<0.05为差异有统计学意义。
2 结果
2.1NGF预处理对神经损伤大鼠行为学的影响
S组各时点TFL差异无统计学意义(P>0.05);与S组比较,L组和NS组鞘内注射利多卡因后1~3 d TFL均延长(P<0.05),与L组比较,NGF组于鞘内注射利多卡因后2 d和3 d TFL缩短(P<0.05),见表1。
表1 NGF预处理对大鼠不同时点TFL的影响?Tab.1 Effects of NGF postconditioning on the TFL of different time points in rats

表1 NGF预处理对大鼠不同时点TFL的影响?Tab.1 Effects of NGF postconditioning on the TFL of different time points in rats
1)P<0.05 compared with S group;2)P<0.05 compared with L group.
Group n Base value 1 d 2 d 3 d S 6 5.3±1.4 5.9±2.1 6.5±1.7 6.7±1.6 L 6 4.8±2.3 25.1±4.21) 23.1±3.81) 24.7±3.51)NS 6 4.9±2.2 26.2±4.71) 22.4±3.01) 21.9±2.41)NGF 6 6.2±2.1 21.3±2.91) 14.8±2.51),2) 15.3±3.41),2)
2.2NGF预处理对神经损伤大鼠脊髓组织病理形态学的影响
光镜下观察,S组脊髓组织结构清晰,灰质、白质清晰可见,界限分明,无出血灶,无空泡样改变,神经元及神经轴突正常,未见异常现象(图1A);L组和NS组见后角白质广泛水肿、空泡变性、脊膜细胞大量增生,损伤较重(图1B、1C);NGF组见的后角白质神经纤维水肿,脊膜细胞增生,空泡变性不明显(图1D)。
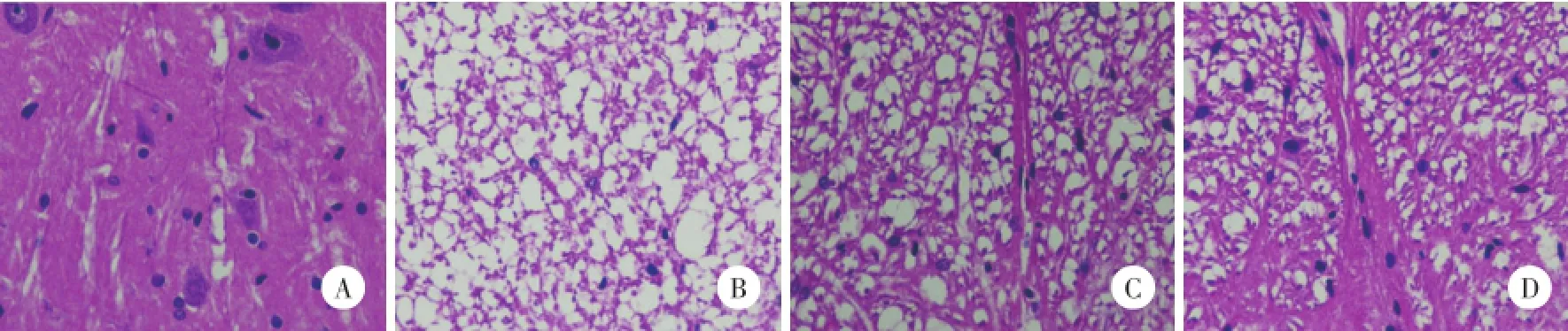
图1 NGF预处理对大鼠脊髓组织病理形态学的影响 HE染色×400Fig.1 Effects of NGF preconditioning on the spinal cord morphology in rats HE×400
2.3NGF预处理对神经损伤大鼠脊髓内MBP及p38 MAPK磷酸化的影响
与S组比较,L组和NS组脊髓内MBP的含量减少,p38 MAPK磷酸化的表达上调(P<0.05);与L组比较,NGF组脊髓内MBP的含量增加,p38 MAPK磷酸化的表达下调(P<0.05),见表2,图2、3。
表2 NGF预处理对大鼠脊髓内MBP和p38 MAPK磷酸化的影响Tab.2 Effects of NGF pconditioning on the MBP and p⁃p38 MAPK in the spinal cord in rats

表2 NGF预处理对大鼠脊髓内MBP和p38 MAPK磷酸化的影响Tab.2 Effects of NGF pconditioning on the MBP and p⁃p38 MAPK in the spinal cord in rats
1)P<0.05 compared with S group;2)P<0.05 compared with L group.
Group n AOD of MBP Relative expression of p⁃p38 MAPK S 6 149.4±10.4 0.52±0.12 L 6 85.6±12.81) 0.83±0.091)NS 6 91.3±11.21) 0.81±0.111)NGF 6 113.6±9.52) 0.49±0.072)
3 讨论
本研究采用鞘内置管注射高浓度利多卡因的方法制备大鼠脊髓神经毒性模型。结果表明,鞘内注射利多卡因后大鼠TFL升高,提示利多卡因诱发大鼠脊髓神经毒性的模型制备成功。此外,本课题组前期研究表明,应用局麻药神经毒性损伤的大鼠模型,于鞘内注射高浓度利多卡因后,鞘内连续7 d每天1次的注射NGF 10 μg,能够减轻局麻药引起的毒性损伤,改善脊髓神经细胞的超微结构,抑制神经细胞凋亡,因此,本研究仍选择外源性NGF的上述给药途经和剂量。

图2 NGF预处理对大鼠脊髓内MBP的影响 免疫组化染色×400Fig.2 Effects of NGF preconditioning on the spinal cord MBP in rats Immunohistochemical staining×400

图3 NGF预处理对大鼠脊髓内p38 MAPK磷酸化的影响 West⁃ern blotFig.3 Effects of NGF preconditioning on the spinal cord the ex⁃pression of p⁃p38 MAPK in rats Western blot
MBP是脊椎动物中枢神经系统少突细胞[8]和周围神经系统雪旺细胞合成的一种强碱性膜蛋白。MBP是组成中枢神经系统髓鞘的主要蛋白质,约占髓鞘蛋白质总量的30%,脊髓损伤会诱导免疫组件对神经系统自体抗原免疫应答的刺激[9],免疫组件对MBP或其他神经成分会做出免疫损害刺激[10]。本研究发现L组大鼠术后1~3 d脊髓中MBP的表达较S、NGF组明显减少,提示利多卡因对髓鞘这种神经成分会做出损害刺激,当脊髓出现实质性损害,特别是出现髓鞘脱失时,构成髓鞘主要蛋白质的MBP也同与其结合的脂质分离,并通过破坏的脊髓血脑屏障入血。因此,在脊髓组织中由于脊髓损伤二相反应使得一部分MBP丢失于血清中,相应脊髓组织中含量会减少。而本研究发现NGF预处理可逆转上述病理生理过程,从而实现对局麻药致脊髓脱髓鞘反应的保护效应。
p38 MAPK磷酸化在中枢神经系统疾病中主要表现为负性损伤作用,可介导炎性反应,导致神经组织水肿和神经细胞死亡[11]。本研究证实L组在术后1 d即开始出现p38 MAPK磷酸化表达增高,提示p38 MAPK磷酸化很可能是后续脊髓脱髓鞘损伤的始动因素。有研究[12]表明持续的p38 MAPK活化在成熟少突胶质细胞的生存中也起到重要作用,长时间抑制p38 MAPK的活性则导致成熟少突胶质细胞的凋亡。但值得注意的是,p38 MAPK可能在少突胶质细胞中具有不同的作用,这可能与少突胶质细胞活性或者p38 MAPK自身的活性动力学有关[13],在病理条件下刺激时p38 MAPK短暂激烈的活化则导致少突胶质细胞凋亡。本研究亦证实NGF预处理可抑制p38 MAPK磷酸化,即阻断了p38 MAPK短暂激烈活化导致少突胶质细胞凋亡这一病理生理过程,从而产生了抑制脊髓急性脱髓鞘损伤的效应。
综上所述,鞘内予外源性NGF预处理可减轻局麻药所致神经损伤大鼠脊髓急性脱髓鞘反应,机制与抑制p38 MAPK磷酸化表达有关。
[1]赵广翊,赵柏松,高林林,等.不同比例利多卡因-布比卡因混合液鞘内注射后大鼠神经行为及脊髓神经结构变化[J].实用临床医药杂志,2014(16):1-6.DOI:10.7619/jcmp.201416001.
[2]ZHAO GY,DING XD,GUO Y,et al.Intrathecal lidocaine neurotox⁃icity:combination with bupivacaine and ropivacaine and effect of nerve growth factor[J].Life Sci,2014,112(1/2):10-21.DOI:10.1016/j.lfs.2014.07.003.Epub 2014 Jul 23.
[3]赵广翊,曹岩岩,李丹,等.鞘内注射外源性神经生长因子对利多卡因致大鼠脊髓损伤的保护作用[J].国际麻醉学与复苏杂志,2014,35(11):1022-1025.DOI:10.3760/cma.j.issn.1673⁃4378.2014. 11.013.
[4]LIRK P,HALLER I,MYERS RR,et al.Mitigation of direct neuro⁃toxic effects of lidocaine and amitriptyline by inhibition of p38 mito⁃gen⁃activated protein kinase in vitro and in vivo[J].Anesthesiolo⁃gy,2006,104(6):1266-1273.
[5]LIRK P,HALLER I,COLVIN HP,et al.In vitro,lidocaine⁃induced axonal injury is prevented by peripheral inhibition of the p38 mito⁃gen⁃activated protein kinase,but not by inhibiting caspase activity[J].Anesth Analg,2007,105(6):1657-1664.DOI:10.1213/01. ane.0000286171.78182.e2.
[6]ZHAO B,PAN Y,WANG Z,et al.Intrathecal administration of tem⁃pol reduces chronic constriction injury⁃induced neuropathic pain in rats by increasing SOD activity and NGF expression[J].Cell MolNeurobiol,2016,36(6):893-906.DOI:10.1007/s10571⁃015⁃0274⁃7.
[7]ZHAO BS,SONG XR,HU PY,et al.Hyperbaric oxygen treatment at various stages following chronic constriction injury produces differ⁃ent antinociceptive effects via regulation of P2X4R expression and apoptosis[J].PLoS One,2015,10(3):e0120122.DOI:10.1371/ journal.pone.0120122.
[8]LAURSEN LS,CHAN CW,FFRENCH⁃CONSTANT C.Translation of myelin basic protein mRNA in oligodendrocytes is regulated by integrin activation and hnRNP⁃K[J].J Cell Biol,2011,192(5):797-811.DOI:10.1083/jcb.201007014.
[9]ZAJARIAS⁃FAINSOD D,CAEEILLO⁃RUIZ J,MESTRE H,et al. Autoreactivity against myelin basic protein in patients with chronic paraplegia[J].Eur Spine,2012,21(5):964-970.DOI:10.1007/ s00586⁃011⁃2060⁃7.
[10]IBARRA A,CORREA D,WILLMS K,et al.Effects of cyclosporin⁃A on immune response,tissue protection and motor function of rats subjected to spinal cord injury[J].Brain Res,2003,979(1/2):165-178.DOI:10.1016/S0006⁃8993(03)02898⁃1.
[11]KI YW,PAIK JH,LEE JE,et a1.JNK and p38 MAPK regulate oxi⁃dative stress and the inflammatory response in chlorpyrifos⁃in⁃duced apoptosis[J].Toxicol Lett,2013,218(3):235-245.DOI:10.1016/j.toxlet.2013.02.003.
[12]HAMANOUE M,SATO K,TAKAMATSU K.Inhibition of p38 mi⁃togen⁃activated protein kinase⁃induced apoptosis in cultured ma⁃ture oligodendrocytes using SB202190 and SB203580[J].Neuro⁃chem Int,2007,51(1):16-24.DOI:10.1016/j.neuint.2007.03. 005.
[13]FRAGOSO G,MARTíNEZ⁃BERMúDEZde AK,LIU HN,et a1.De⁃velopmental differences in HO⁃induced oligodendrocyte cell death:role of glutathione,mitogen⁃activated protein kinases and caspase 3[J].J Neurochem,2004,90(2):392-404.DOI:10.1111/j.1471⁃4159.2004.02488.x.
(编辑于溪)
Effect of Nerve Growth Factor Postconditioning on Demyelination Process of Spinal Cord with Nerve Damage in Rats
ZHAO Guangyi,DING Xudong,HUANG Wei,LI Dan
(Department of Anesthesiology,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveTo explore the effect of postconditioning of intrathecal injection of nerve growth factor(NGF)on demyelination process of spinal cord in rats with local anesthetics⁃induced nerve damage.MethodsA total of 24 SD male rats(250⁃280 g)were randomly divided into 4 groups(n=6 in each group):the sham⁃operation group(group S),nerve damage group(group L),normal saline group(group NS)and NGF pretreatment group(group NGF).While group Lido,NS and NGF were all given 20 μL of 10%lidocaine hydrochloride via intrathecal injection on 1 d after catheterization.Group NGF was given 30 μg(20 μL)NGF via intrathecal injection for pretreatment 1 h before injection of lidocaine. Tail⁃flick latency was measured on 1,2 and 3 d after intrathecal injection of lidocaine.Spinal cord tissues were taken after completion of behavioral test.Immunohistochemical method was used to determine the expressions of MBP and Western blot was used to determine the expressions of phos⁃phorylated p38 MAPK(p⁃p38 MAPK).ResultsCompared with group S,TFLs on 1⁃3 d after intrathecal injection of lidocaine in group L and NS were all prolonged,spinal cord MBP was decreased in group L and group NS,while expressions of p⁃p38 MAPK were up⁃regulated(P<0.05);while compared with group L,TFLs on 2 d and 3 d were both shortened in group NGF,spinal cord MBP was decreased in group NGF and expressions of p⁃p38 MAPK were also down⁃regulated(P<0.05).ConclusionNGF postconditioning via intrathecal approach can reduce acute demyelinating reaction of spinal cord in rats with nerve damage caused by local anesthetics,and the mechanism was related to the inhibition of phosphorylation expression of p⁃p38 MAPK.
nerve growth factors;lidocaine;drug toxicity;demyelinating reaction;p38 MAPK
R744.5
A
0258-4646(2016)09-0783-05
10.12007/j.issn.0258⁃4646.2016.09.004
辽宁省科学技术计划(2011225017)
赵广翊(1976-),男,副教授,博士. E-mail:zhaogy_sy@sina.com
2016-01-21
网络出版时间:

