2,4,6⁃三硝基苯磺酸诱导不同鼠种急性溃疡性结肠炎的比较
郭瑞敏,荀哲,范正松,牛亚玲,李雁春
2,4,6⁃三硝基苯磺酸诱导不同鼠种急性溃疡性结肠炎的比较
郭瑞敏,荀哲,范正松,牛亚玲,李雁春
(中国医科大学代谢病分子机制与药物研究所,沈阳 110122)
目的利用2,4,6⁃三硝基苯磺酸(TNBS)诱导C57BL/6小鼠和昆明小鼠建立溃疡性结肠炎模型,对比2种小鼠的造模效果。方法小鼠经结肠灌注一定剂量的TNBS,评估病情,于72 h后处死小鼠,取出结肠进行组织学切片评分,并用Western blot及RT⁃PCR方法检测炎性因子的表达。结果C57BL/6小鼠和昆明小鼠的急性溃疡性结肠炎模型建立成功,但C57BL/6小鼠肠炎在分子水平和组织水平上均比昆明小鼠更加严重。结论C57BL/6小鼠比昆明小鼠对TNBS更敏感,组织学上更易观察到病理变化。C57BL/6小鼠比昆明小鼠更适合用于溃疡性结肠炎的研究。
溃疡性结肠炎;C57BL/6小鼠;昆明小鼠;2,4,6⁃三硝基苯磺酸
网络出版地址
溃疡性结肠炎是一种病因尚不完全明确的慢性肠道炎症性疾病[1],主要侵及结肠黏膜,破坏黏膜并形成溃疡,常始自左半结肠,可由结肠近端发展至全结肠[2],以连续方式逐渐进展。临床表现主要为腹痛、腹泻、黏液脓血便,且易反复发作,病程长,迁延不愈[3]。
目前已有多种溃疡性结肠炎动物模型,但由2,4,6⁃三硝基苯磺酸(2,4,6⁃trinitrobenzene,TNBS)和乙醇混合试剂诱导建立的急性溃疡性结肠炎动物模型,虽然时间较短、操作简便,基础研究中应用较普遍[4],但重复性差,使得造模效率下降。TNBS混合试剂的致炎机制是乙醇破坏肠黏膜屏障,TNBS渗入结肠黏膜组织作为化学性半抗原与结肠组织蛋白结合形成全抗原[5],直接活化肠黏膜固有层中的巨噬细胞,促使其增生并且释放多种促炎性细胞因子、组胺、白三烯、血小板活化因子、肝素等。促炎性细胞因子肿瘤坏死因子α(tumor necrosis factor⁃α,TNF⁃α)可以通过活化内皮细胞整连素的表达,增加细胞内Ca2+浓度,同时释放血小板活化因子,使淋巴细胞、白细胞、血小板黏附到肠黏膜内皮细胞上,活化一氧化氮合酶,产生大量一氧化氮,引起细胞损伤,形成溃疡;TNF⁃α亦可促使白细胞介素IL⁃1β、IL⁃2、IL⁃8等的释放,进一步损伤肠黏膜屏障[6⁃7]。
诱导模型过程中所使用的试剂、实验动物种类和遗传背景及实验方法都对模型的成功建立产生不同程度的影响。本研究试图通过针对C57BL/6小鼠和昆明小鼠实验结果的对比,对造模过程中遇到的问题做出分析比较,提供可靠的参考资料。
1 材料与方法
1.1材料
1.1.1试剂:TNBS(美国Sigma公司);胶体金便隐血检测试剂盒(艾博生物医药有限公司);HE染色试剂盒(上海碧云天生物公司);蛋白酶抑制剂ULTRA(上海嵘崴达实业有限公司);RIPA裂解液(上海碧云天生物公司);BCA蛋白浓度测定试剂盒(上海碧云天生物公司);羊抗鼠TNF⁃α单克隆抗体(美国Sigma公司);羊抗鼠β⁃actin单克隆抗体以及辣根过氧化物酶标记的兔抗羊IgG(美国Santa Cruz公司);ECL发光液(美国Thermo Fisher公司);Trizol(美国Life Technologies公司);鼠TNF⁃α和鼠GAPDH引物(上海生工生物工程公司);逆转录试剂盒(日本Ta⁃KaRa公司);PCR扩增试剂盒(日本TaKaRa公司)。
1.1.2动物:SPF级昆明小鼠,体质量23~25 g,周龄8~10周,购于辽宁省长生生物技术有限公司,动物合格证书编号SCXK(辽)2015⁃0003;SPF级C57BL/6小鼠,体质量20~23 g,周龄8~10周,购于辽宁省长生生物技术有限公司,动物合格证书编号SCXK(辽)2015⁃0001。
1.1.3器材:RM2235轮转石蜡切片机(美国Leica公司);KD⁃BM生物组织包埋机(浙江省金华市科迪仪器设备有限公司);DMI3000B荧光显微镜(美国Lei⁃ca公司);组织粉碎机(德国IKA公司);微波细胞粉碎机(宁波新芝生物科技股份有限公司);Nano Drop ND⁃1000全波长紫外/可见光扫描分光光度计(美国Gene公司);荧光定量PCR仪(美国Bio⁃Rad公司)。
1.2方法
1.2.1动物分组:将10只同一窝别的C57BL/6雄性小鼠随机分为2组,每组5只,分别为对照组和模型组;将10只同一窝别的昆明雄性小鼠也随机分为2组,每组5只,分别为对照组和模型组。
1.2.2试剂配制:TNBS与无水乙醇以1∶1的比例混合[8]。
1.2.3模型制作:各组小鼠在造模前禁食不禁饮24 h,灌肠前充分排便。根据小鼠体质量和种系的差别,昆明小鼠的麻醉用药量为0.5 mL/100 g,C57BL/6小鼠麻醉用药量为0.25 mL/100 g。将麻醉的小鼠倒置悬挂,用带有灌肠针的注射器以0.5 mL/100 g的剂量灌注TNBS混合试剂。灌肠针轻轻插入约4 cm,缓慢推入试剂,轻轻拔出针管,倒置约5 min,以保证造模液与结肠充分接触和防止造模液外溢,然后放回笼内[9]。造模完成后注意保温,直至自然苏醒。对照组用同样的方法灌入相同剂量的无水乙醇。
1.2.4观察:每天称量并记录小鼠体质量,观察粪便、毛发及活动情况,肉眼不可见的血便采用便隐血检测试剂评分。第3天后,统计小鼠体质量下降的终值,粪便稀软程度及便隐血情况,根据JACK⁃SON等[10]的疾病活性指数(disease activity index,DAI)评分方法绘制表格,见表1。
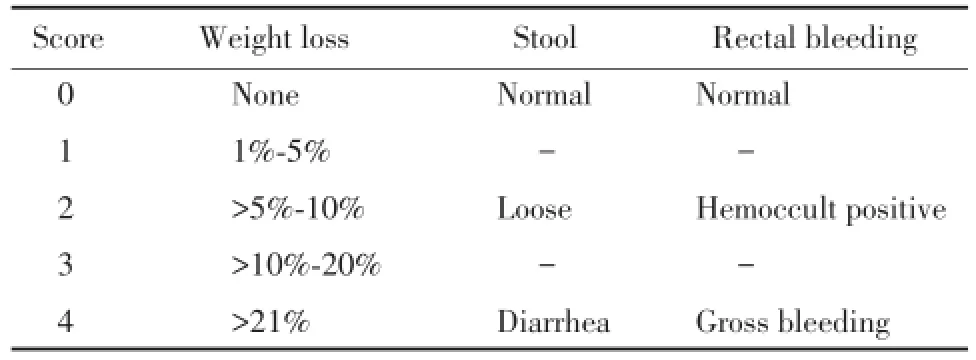
表1 DAI评分标准Tab.1 DAI scoring system
1.2.5取材:造模72 h后将各组小鼠处死,取出结肠,用4℃冷却的PBS液将肠内容物清理干净。用作组织切片的部分放置到4%的多聚甲醛溶液固定24 h;用作Western blot和RT⁃PCR检测的部分放至-80℃的冰箱里冻存备用[11]。
1.2.6组织切片制作及观察:多聚甲醛中固定好的组织用流水冲洗,依次使用70%、80%、90%、95%、100%Ⅰ、Ⅱ的梯度乙醇脱水,再用二甲苯Ⅰ、Ⅱ将组织进行透明处理,常规石蜡包埋,切片,厚度约为4 μm,HE染色,分别于5倍、10倍物镜下观察各组小鼠结肠组织学变化[11],并依据STEFAN等的评分标准[8]对病理切片进行评分。见表2。
1.2.7Western blot分析:使用已加入适量蛋白酶抑制剂ULTRA的RIPA裂解液,分别提取上述模型组及对照组小鼠的结肠黏膜组织总蛋白,加入适量loading buffer,加热变性后,用10%聚丙烯酰胺凝胶电泳(SDS⁃PAGE)分离,分离后的蛋白转移到聚偏氟乙烯膜上。用5%脱脂牛奶封闭聚偏氟乙烯膜1 h,再用TBST稍加漂洗。一抗是浓度1∶1 000的羊抗鼠抗体,于4℃冷柜孵育过夜后,用TBST洗膜3次,每次10 min;然后加入二抗,二抗为辣根过氧化物酶标记的兔抗羊IgG,稀释浓度为1∶2 000;之后于室温孵育1 h,再用TBST洗膜3次,最后将膜与ECL试剂反应一定时间。X光片显影,定影后扫描,使用Im⁃age J对蛋白表达做定量分析。抗β⁃actin为内参照。
1.2.8RT⁃PCR:使用Trizol试剂提取各组小鼠结肠组织的总RNA,测定浓度,取500 ng应用逆转录试剂盒逆转录出cDNA,最后用实时定量PCR仪检测组织中TNF⁃α的表达量[12]。内参采用GAPDH,TNF⁃α寡核苷酸引物序列为上游5′⁃TCAGCCTCTTCTCAT TCCTG⁃3′;下游5′⁃CAGGCTTGTCACTCGAATTT⁃3′,mGAPDH寡核苷酸序列为:上游5′⁃TGTGTCCGTCG TGGATCTG⁃3′;下游5′⁃CCTGCTTCACCACCTTCTTG A⁃3′[13]。反应条件为95℃预变性5 min,95℃60 s,60℃30 s,72℃30 s,共40个循环。结果采用比较阈值法进行定量分析,计算目的基因的拷贝数并比较[14]。
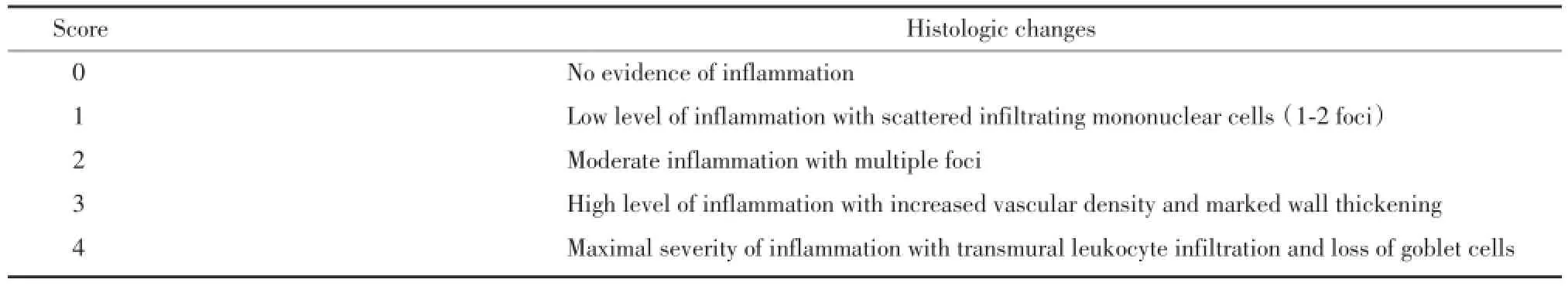
表2 结肠组织炎症相关变化评分标准Tab.2 Scoring system for inflammation⁃associated histological changes in the colon
1.3统计学分析
2 结果
2.1小鼠DAI评分结果
小鼠被处理后的第2天,对照组粪便无异常,TNBS模型组会出现大便稀软的现象;第3天,严重的会出现稀水样便,隐血便或肉眼可见血便。C57BL/6小鼠的平均值约为昆明小鼠的1.5倍,体质量下降程度,大便稀软程度及出现血便的概率均比昆明小鼠大。说明使用C57BL/6小鼠制作模型更容易成功。见表3。

表3 DAI评分结果Tab.3 DAI scores
2.2小鼠体质量变化
各组小鼠体质量变化曲线如图1所示:C57BL/6小鼠和昆明小鼠体质量下降趋势基本一致。造模后第3天,C57BL/6模型组小鼠体质量下降了将近20%(图1A);昆明小鼠体质量下降幅度略小,约为12%(图1B)。说明C57BL/6小鼠对TNBS的敏感性比昆明小鼠高。
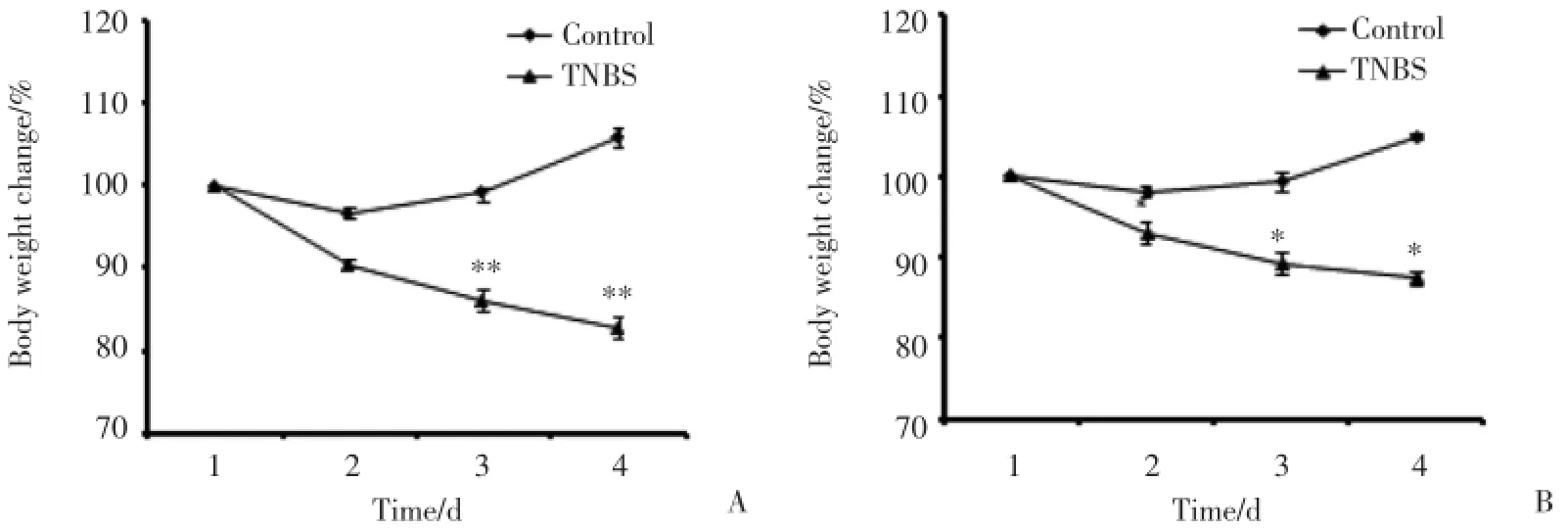
图1 C57BL/6小鼠和昆明小鼠接受TNBS处理后的体质量变化曲线Fig.1 Body weight change curves of C57BL/6 mice and kunming mice after TNBS treatment
2.3结肠组织病理变化
将各组小鼠的病理组织切片进行观察比较后的评分结果如表4所示。C57BL/6小鼠和昆明小鼠的对照组无显著变化,仅在无水乙醇的作用下,前者较后者略微敏感。TNBS模型组均有统计学差异,且C57BL/6小鼠的平均值要大于昆明小鼠,约为昆明小鼠的1.7倍。各组小鼠病理组织切片如图2所示。2种小鼠对照组无明显差异,但C57BL/6模型组的变化比昆明小鼠的变化更加明显。TNBS处理3 d后,结肠黏膜的基本组织结构(包括腺体和杯状细胞)基本全部消失,血管密度增加,白细胞显著增多,肌层变厚;而昆明小鼠炎症最严重的部位仍部分保留肠黏膜的基本结构,部分腺体和杯状细胞未完全消失。说明灌肠相同剂量的TNBS混合液,C57BL/6小鼠肠黏膜组织结构的破坏比昆明小鼠更明显。

表4 结肠组织炎症变化的评分结果Tab.4 Scores for inflammation⁃associated histological changes in the colon
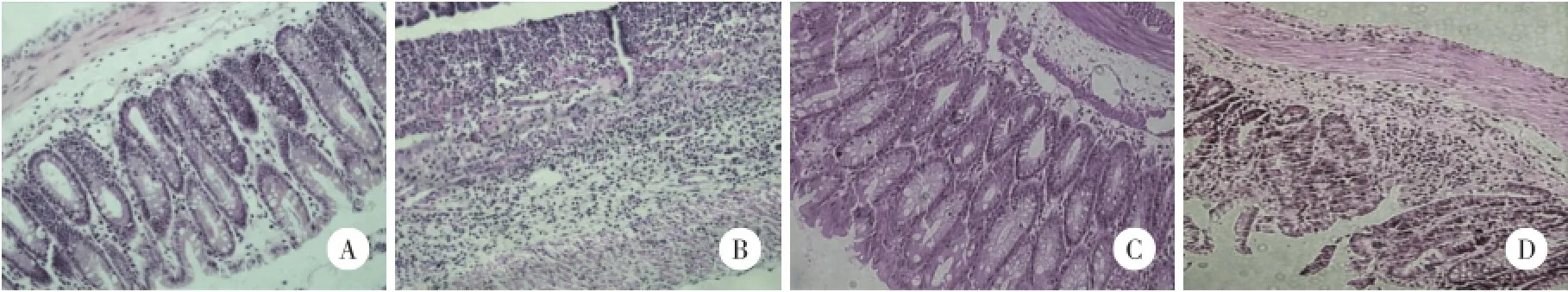
图2 组织切片 HE染色×20Fig.2 Histological section HE×20
2.4肠黏膜上皮细胞TNF⁃αmRNA表达
TNBS处理3 d后C57BL/6小鼠和昆明小鼠的结肠黏膜上皮细胞TNF⁃α在mRNA水平的表达均有增加。与对照组比较,C57BL/6小鼠的TNF⁃αmRNA增加15倍左右(P<0.01),而昆明小鼠的TNF⁃α mRNA表达只增加5倍左右(P<0.05)。 所以C57BL/6小鼠的TNF⁃α在mRNA水平的表达量增加较大,说明炎症更加严重。见图3。
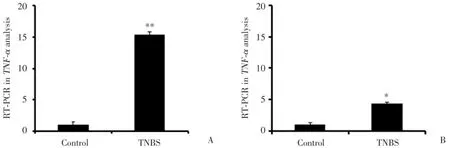
图3 肠黏膜上皮细胞TNF⁃α mRNA的表达Fig.3 Mucosal epithelial cell TNF⁃α mRNA expression
2.4肠黏膜上皮细胞TNF⁃α的蛋白质表达
通过Western blot对2种小鼠肠黏膜上皮细胞中的炎性因子TNF⁃α在蛋白水平表达做进一步检测,发现2种小鼠对照组TNF⁃α表达都很低,而TN⁃ BS刺激后,2种模型的TNF⁃α蛋白水平都有明显的增加。定量结果显示,C57BL/6小鼠和昆明小鼠的肠黏膜上皮细胞TNF⁃α蛋白表达分别增加6.8倍和5倍左右,差异有统计学意义(P<0.01),结果和mRNA变化水平基本一致。这进一步说明在TNBS处理后,C57BL/6小鼠的肠黏膜炎性反应比昆明小鼠严重。见图4。
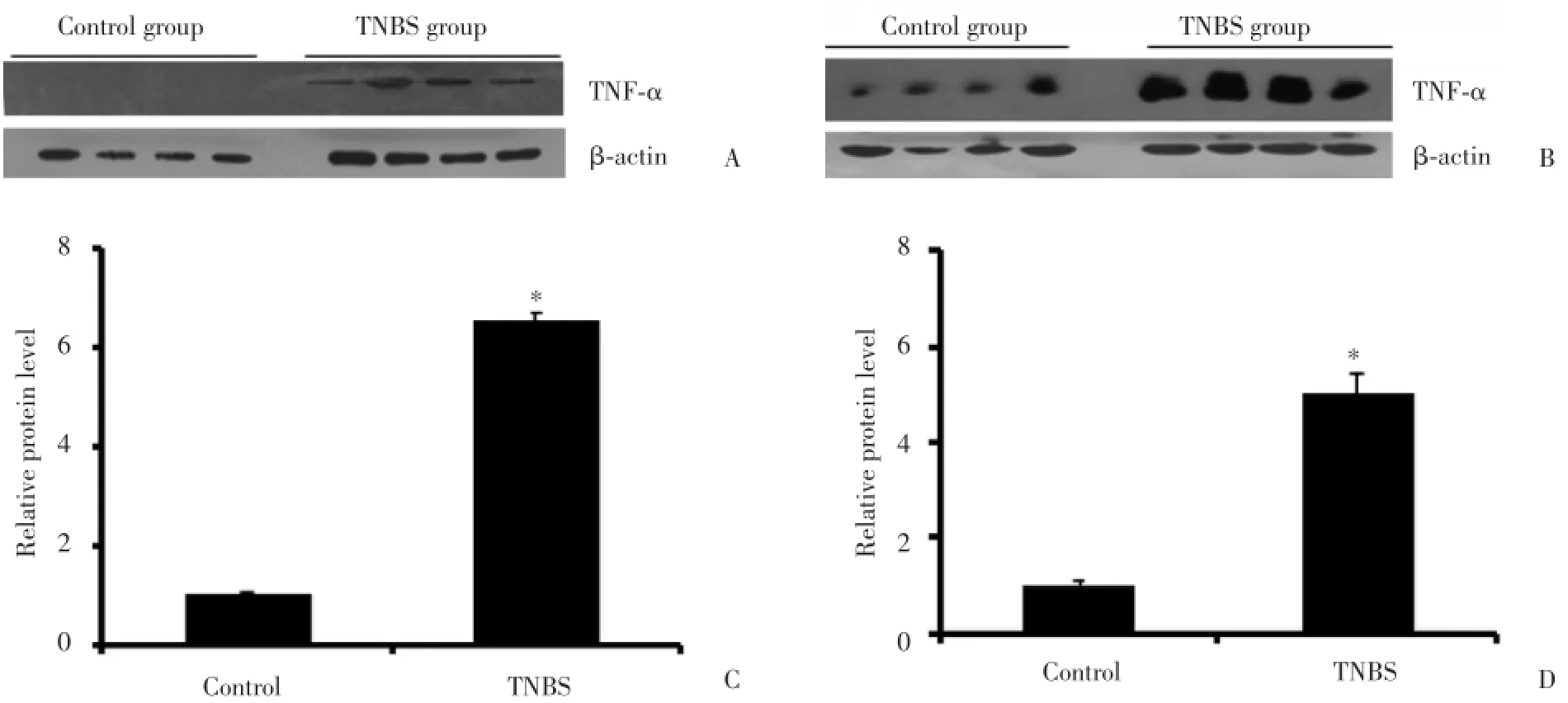
图4 肠黏膜上皮细胞TNF⁃α蛋白的表达和定量分析Fig.4 Mucosal epithelial cell TNF⁃α protein expression and quantitative analysis
3 讨论
C57BL/6小鼠被称作“标准”近交系小鼠,是肿瘤学、免疫学、病理生理学、遗传学及药理学研究中常用的鼠种。昆明小鼠则是一种远交系品种,基因库大,基因杂合率高。与C57BL/6小鼠比较,昆明小鼠抵抗力和适应力均很强,且繁殖率和成活率较高[15]。本研究通过对比由TNBS混合液诱导的2种小鼠溃疡性结肠炎模型发现,在造模的第2天,各组小鼠出现不同程度的厌食、懒动、皮毛粗糙无光泽,腹部扭曲,膨大,粪便呈黏液状或稀水样便甚至隐血便。C57BL/6小鼠和昆明小鼠在接受TNBS混合液处理后,表现出的体质量下降趋势是基本相同的,都在72 h后体质量降到最低值,但C57BL/6小鼠比昆明小鼠下降更多,出现稀软粪便和血便的概率更大,DAI评分约为昆明小鼠的1.5倍。通过病理组织切片可以看到,在灌肠同样剂量TNBS的情况下,C57BL/6小鼠的炎性反应更严重,肠黏膜结构严重破坏,杯状细胞、腺体和绒毛上皮细胞基本消失,血管密度增加,白细胞浸润严重,肌层变厚;而昆明鼠的结肠组织结构变化较小,最严重的情况仍可观察到杯状细胞和腺体的存在,肌层结构变化亦不显著,组织评分结果与小鼠病症变化一致。但通过Western blot和RT⁃PCR对炎性因子TNF⁃α的检测,进一步在分子水平上证实,虽然2种小鼠都有炎症,但C57BL/6小鼠的肠黏膜炎症程度比昆明小鼠更严重。当使用较高剂量的TNBS刺激昆明小鼠并诱导其产生炎症后,在组织水平并未发现明显病变特征,但在mRNA水平和蛋白水平却可以检测到炎性因子的表达,加之该模型的诱导为急性发作,组织可在短期内自我修复,在视觉观察上易误断为造模失败。
综上所述,在选择TNBS诱导小鼠急性溃疡性结肠炎时,由于C57BL/6小鼠对TNBS的高敏感性,结肠炎表现更加显著,且造模成功率较高,降低了实验成本,改善了反复造模的繁琐性。虽然昆明小鼠价格相对便宜,但从实验整体的性价比来说并非理想品种。
[1]KHALILI H,HIGUCHI LM,ANANTHAKRISHNAN AN,et al.Hor⁃mone therapy increases risk of ulcerative colitis but not crohn′s dis⁃ease[J].Gastroenterology,2012,143(5):1199-1206.DOI:10.1053/ 10.1053/j.gastro.2012.07.096.Epub 2012 Jul 27.
[2]LICHTENSTEIN GR.The history of medical therapy of ulcerative colitis[M].Berlin:Springer,2014:45-54.
[3]LICHTENSTEIN GR.The history of medical therapy of ulcerativecolitis[M].Berlin:Springer,2014:31-44.
[4]张冰冰,齐越,贾冬,等.2,4,6⁃三硝基苯磺酸诱导溃疡性结肠炎大鼠模型的建立及评价[J].中华中医药学刊,2015,33(8):1834-1836.DOI:10.13193/j.issn.1673⁃7717.2015.08.011.
[5]徐阳,李伟光,刘海峰,等.三硝基苯磺酸诱导小鼠溃疡性结肠炎模型制备的技术改良[J].世界华人消化杂志,2012,(2):106-112.
[6]LEE J,CLARKE K.Anti⁃TNF agents in patients with inflammatory bowel disease and malignant melanoma—challenges in management[J].Int J Colorectal Dis,2015,30(12):1595-1602.DOI:10.1007/ s00384⁃015⁃2344⁃1.Epub 2015 Sep 8.
[7]FUKUMOTO K,NAITO Y,TAKAGI T,et al.Role of tumor necrosis factor⁃α in the pathogenesis of indomethacin⁃induced small intesti⁃nal injury in mice[J].Int J Mol Med,2011,27(3):353-359.DOI:10.3892/ijmm.2011.602.Epub 2011 Jan 18.
[8]STEFAN W,CLEMENS N,BENNO W,et al.Chemically induced mouse models of intestinal inflammation[J].Nat Protoc,2007,2(3):541-546.DOI:10.1038/nprot.2007.41.
[9]DA FC,LUN GL,KAI ZT,et al.Recovery from TNBS⁃induced coli⁃tis leads to the resistance to recurrent colitis and an increased ratio of FOXP3 to CD3 mRNA[J].J Dig Dis,2013,14(11):587-595. DOI:10.1111/1751⁃2980.12084.
[10]JACKSON LN,ZHOU Y,QIU S,et al.Alternative medicine prod⁃ ucts as a novel treatment strategy for inflammatory bowel disease[J].Am J Chin Med,2007,36(5):953-965.DOI:http://dx.doi. org/10.1142/S0192415X08006375.
[11]LIU W,CHEN Y,GOLAN MA,et al.Intestinal epithelial vitamin D receptor signaling inhibits experimental colitis[J].J Clin In⁃vest,2013,123(9):3983-3996.DOI:10.1172/JCI65842.Epub 2013 Aug 15.
[12]FEI Z,WEI W,XING Y,et al.NF⁃κB target microRNAs and their target genes in TNFα⁃stimulated HeLa cells[J].Biochim Biophys Acta,2014,1839(4):344-354.DOI:10.1016/j.bbagrm.2014.01. 006.Epub 2014 Jan 11.
[13]DU J,CHEN Y,SHI Y,et al.1,25⁃dihydroxyvitamind protects in⁃testinal epithelial barrier by regulating the myosin light chain ki⁃nase signaling pathway[J].Inflamm Bowel Dis,2015,21(11):2495-2506.DOI:10.1097/MIB.0000000000000526.
[14]VANDESOMPELE J,PRETER KD,PATTYN F,et al.Accurate normalization of real⁃time quantitative RT⁃PCR data by geometric averaging of multiple internal control genes[J].Genome Biol,2002,3(7):research0034.
[15]ZHANG X,ZHU Z,HUANG Z,et al.Microsatellite genotyping for four expected inbred mouse strains from KM mice[J].J Genet Ge⁃nomics,2007,34(3):214-222.
(编辑于溪)
Comparison of 2,4,6⁃trinitrobenzene Sulfonic Acid⁃induced Acute Colitis Models in Two Different Mouse Strains
GUO Ruimin,XUN Zhe,FAN Zhengsong,NIU Yaling,LI Yanchun
(Institute of Metabolic Disease Research and Drug Development,China Medical University,Shenyang 110122,China)
ObjectiveAcute colitis was induced with 2,4,6⁃trinitrobenzene sulfonic acid(TNBS)in C57BL/6 and Kunming mice,and effec⁃tiveness of the colitis model in these two mouse strains was compared.MethodsMice were treated with TNBS and sacrificed after 72 h.The co⁃lons were collected for histological observation,and the expression of colonic mucosal pro⁃inflammatory cytokines was assessed by western blot and real time RT⁃PCR.Disease severity and mucosal histological damages were scored.ResultsColitis was successfully induced in both C57BL/6 and Kunming mice,but colonic pathological lesions and inflammation were more severe in C57BL/6 mice than in Kunming mice at both histologi⁃cal and molecular levels.ConclusionC57BL/6 mice were more susceptible to TNBS than Kunming mice in colitis development,and histological damages were more prominent in C57BL/6 mice.Thus,C57BL/6 mice are more suitable for experimental colitis research.
colitis;C57BL/6 mouse;Kunming mouse;2,4,6⁃trinitrobenzene
R326.2
A
0258-4646(2016)09-0787-06
10.12007/j.issn.0258⁃4646.2016.09.005
辽宁省教育厅科学研究一般项目(L2014320)
郭瑞敏(1988-),女,硕士研究生.
李雁春,E-mail:cyan@medicine.bsd.uchicago.edu
2016-01-22
网络出版时间:

