补体旁路激活致小鼠急性肺损伤的炎症病理机制研究
郭 静,李 敏,杨付梅,孙黔云
(1.贵州省中国科学院天然产物化学重点实验室药理与活性筛选中心,贵州 贵阳 550002;2.贵州省人民医院干医科,贵州 贵阳 550002)
补体旁路激活致小鼠急性肺损伤的炎症病理机制研究
郭 静1,李 敏2,杨付梅1,孙黔云1
(1.贵州省中国科学院天然产物化学重点实验室药理与活性筛选中心,贵州 贵阳 550002;2.贵州省人民医院干医科,贵州 贵阳 550002)
目的 研究补体旁路激活所导致的小鼠肺部急性炎症的发生发展及相关指标的变化,为药物筛选及干预研究提供理想的小鼠肺部急性炎症病理模型。方法 SPF级昆明小鼠尾静脉注射眼镜蛇毒因子(CVF)激活血清补体旁路途径,根据注射后取样时间不同,分为15 min、30 min、1 h、2 h、6 h组,同时平行设置PBS对照组。取肺组织测定肺系数、肺含水量,并行病理切片检查,肺组织匀浆测定髓过氧化物酶(MPO)活性;制备支气管肺泡灌洗液(BALF)和血清,测定BALF中的细胞数和蛋白含量,采用ELISA法分别测定BALF和血清中的IL-6、TNF-α、P-selectin和ICAM-1含量。结果 小鼠尾静脉注射CVF后可致肺部炎性细胞明显浸润,MPO活性明显上调,BALF中细胞总数和蛋白浓度明显增加。BALF和血清中的IL-6、TNF-α、P-selectin水平及血清中ICAM-1的含量均明显升高,其中,BALF中P-selectin含量在30 min时间点出现1个小高峰,IL-6和TNF-α在1 h时间点出现1个高峰,在2 h时间点均无进一步上升,但在6 h时间点各指标均又明显升高;血清中IL-6和TNF-α含量在1 h时间点达到峰值,随后浓度降低,P-selectin和ICAM-1水平随着时间的延长持续上升。而肺系数、肺含水量及BALF中ICAM-1的含量与PBS组相比无明显变化。结论 补体旁路激活可导致小鼠肺部急性炎症的发生,以30 min至1 h的炎症反应最为明显,该实验可以为药物筛选及干预研究提供理想的动物肺部急性炎症病理模型。
眼镜蛇毒因子;急性肺损伤;小鼠模型;补体旁路;炎症;黏附分子;炎性介质
补体旁路激活导致的炎症反应在一系列临床急危重症中扮演重要角色[1-2],其中补体旁路激活导致的肺部急性炎症较为典型。补体旁路激活可以诱导大鼠急性肺损伤[3],但是否能引起小鼠发生急性肺损伤尚不清楚。天然产物是新药开发的重要来源,而绝大多数分离纯化获得的天然产物样品无法满足大鼠实验用量的需要。因此,基于大规模筛选贵州民族药资源相关活性成分的需要,我们选用小鼠开展补体旁路激活诱导急性肺损伤的研究,以期为药物筛选及干预研究提供理想的动物肺部急性炎症病理模型。
1 材料
1.1 动物 SPF级昆明小鼠80只,♂♀各半,体质量18 g~20 g,购自中国人民解放军第三军医大学实验动物中心,生产许可证书:SCXK-(军)-2012-0011。所有的操作和实验流程均遵守《实验动物管理条例》。实验环境:恒温(22±2)℃,湿度60%~70%,自由饮水和进食。
1.2 试剂与仪器 眼镜蛇毒因子(cobra venom factor,CVF),为本课题组制备,其分离纯化方法同文献[4];MPO试剂盒(南京建成生物工程研究所,批号:20160407);小鼠IL-6、TNF-α、P-selectin 和ICAM-1 ELISA试剂盒(武汉博士德生物工程有限公司,批号:20160401);BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司,批号:20151124);Revco超低温冰箱(美国Thermo公司);Spectra MAX-190连续波长酶标仪(美国Molecular Devices公司);Elix纯水系统和Milli Q超纯水系统(美国Millipore公司);5810R 冷冻离心机(德国Eppendorf公司);Nikon TS100 倒置显微镜(日本Nikon公司)。
2 方法
2.1 分组及给药 80只昆明小鼠适应性喂养3 d后称重,分为空白对照组(PBS组)、给药组(CVF组)。给药组尾静脉注射25 μg·kg-1的CVF,空白对照组尾静脉注射等体积PBS。每组再按给药后取材时间的不同分为5组,分别为15 min、30 min、1 h、2 h、6 h 组,每组8只。
2.2 取材及标本制备 给药后15 min、30 min、1 h、2 h、6 h各组摘眼球取血,静置3 h,4℃ 3 000 r·min-1离心10 min制备血清;然后处死小鼠,开胸腔轻轻挑起右肺,以动脉夹夹住右肺,暴露气管,行气管插管,左肺用1.2 mL 4℃生理盐水分3次进行支气管肺泡灌洗,每次0.4 mL,反复灌洗3次,得BALF,行细胞计数。计数后BALF 3 000 r·min-1离心10 min,取上清液分装,-80℃冻存备用。取右肺称重后,将右肺上叶置于-80℃冻存。右肺中叶称湿重,然后70℃烘烤48 h至恒重,计算肺水含量。右肺下叶置于10%甲醛溶液中固定,进行病理切片检查。
2.3 指标检测
2.3.1 肺系数、肺含水量及MPO测定 称取右肺重量,根据(右肺重量/小鼠体质量)公式,计算右肺系数。右肺上叶取出后,-80℃冻存用于MPO测定,具体方法按照试剂盒说明书进行。右肺中叶称湿重,然后以70℃烘烤48 h至恒重,根据公式:(湿重-干重)/ 湿重×100%,计算肺含水量。
2.3.2 BALF细胞计数 BALF回收率约62.5%,行细胞计数,计算计数板上5个大格的细胞总数n,按公式:细胞数(个· mL-1)=细胞总数n/80×400×104。
2.3.3 BALF蛋白浓度的测定 取BALF上清液,按照试剂盒说明书,采用BCA法检测,用酶标仪在562 nm测定吸光度值并计算BALF中蛋白浓度。
2.3.4 炎症介质和黏附分子的测定 取BALF上清液和血清,按照试剂盒说明书,采用ELISA法检测,用酶标仪在450 nm测定吸光度值,并计算IL-6、TNF-α、P-selectin和ICAM-1的含量。
2.3.5 肺组织病理学检查 灌洗结束后,取右肺下叶以10%甲醛溶液固定,制作常规石蜡病理切片,HE染色,显微镜下观察。
3 结果
3.1 小鼠肺组织相关指标的检测 与PBS组相比,CVF组小鼠的肺系数和肺含水量基本无明显变化;BALF细胞数量和MPO活性均明显增加(P<0.01)。CVF组间比较BALF细胞数量1 h时间点明显高于15 min时间点,而2 h时间点与1 h相比差异没有显著性,到6 h时间点BALF细胞数量和MPO活性又明显升高。BALF中蛋白含量升高,在30 min、6 h两个时间点差异有显著性(P<0.05,P<0.01)(Tab 1)。
3.2 病理组织学观察 病理切片结果显示,PBS组肺组织结构正常,少见炎性细胞浸润;CVF组肺组织结构无明显改变,肺组织内炎性细胞明显浸润,以1 h最为明显,见Fig 1。
3.3 BALF中炎性介质和黏附分子的变化情况 与PBS组比较,CVF各组BALF中IL-6、TNF-α、P-selectin水平明显升高(P<0.05,P<0.01),其中P-selectin水平在30 min时间点出现1个小高峰,IL-6和TNF-α的水平在1 h时间点呈现1个小高峰,随后各指标水平有所降低,至6 h时间点又明显上调。而不同时间点的ICAM-1含量无明显变化(P>0.05),见Fig 2。
3.4 血清中炎性介质和黏附分子的变化情况 与PBS组比较,CVF各组血清中IL-6、TNF-α、P-selec-tin、ICAM-1水平明显升高(P<0.05,P<0.01),其中IL-6和TNF-α的水平在1 h时间点达到峰值,随后含量降低;血清中P-selectin 和ICAM-1的含量随时间的延长持续上升,见Fig 3。

Tab 1 Related lung items of mice at different time ±s, n=8)
*P<0.05,**P<0.01vsPBS control group;##P<0.01vs15 min CVF group

Fig 1 Histological examination of lung tissue(×100)
A~E: PBS group, 15 min, 30 min, 1 h, 2 h, 6 h respectively; F~J: CVF group, 15 min, 30 min, 1 h, 2 h, 6 h respectively
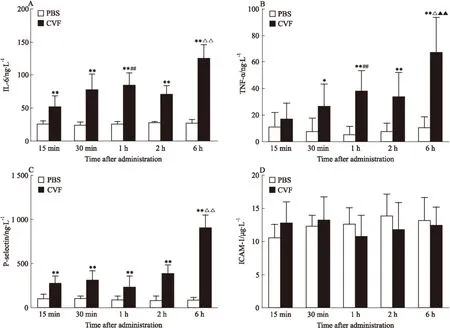
Fig 2 Concentration of inflammatory mediator and adhesion molecule in ±s,n=8)
A:IL-6; B: TNF-α; C: P-selectin; D: ICAM-1. A,B,C,D:*P<0.05,**P<0.01vsPBS control group;##P<0.01vs15 min CVF group;△△P<0.01vs15 min,30 min,1 h and 2 h CVF groups.B:△P<0.05vs1 h and 2 h CVF groups;▲▲P<0.01vs15 min and 30 min CVF groups
4 讨论
CVF是来源于眼镜蛇毒的一种高效补体激活蛋白,CVF在血清中可与B因子形成具有C3/C5转化酶活性的CVFBb,从而激活补体替代途径,产生大量C3a、C5a及攻膜复合物(MAC)[5],导致炎性细胞的聚集和活化以及内皮细胞和血小板的炎性活化,CVF激活补体旁路的方式与体内病理状态下的补体活化高度一致。我们之前的研究表明,通过尾静脉注射给予小鼠CVF,在0.02 U·g-1(即10 μg·kg-1)的剂量下短时间内就可以完全激活血清补体[6]。本研究中我们选用25 μg·kg-1的剂量,这一剂量高于前期采用的激活小鼠血清补体的剂量,因此可确切诱导小鼠血清补体旁路的过度激活。本实验我们利用CVF开展了补体旁路激活致小鼠急性肺损伤的研究,结果表明补体旁路激活可以导致小鼠肺部急性炎症的发生,其中以30 min至1 h的炎症反应最为明显。
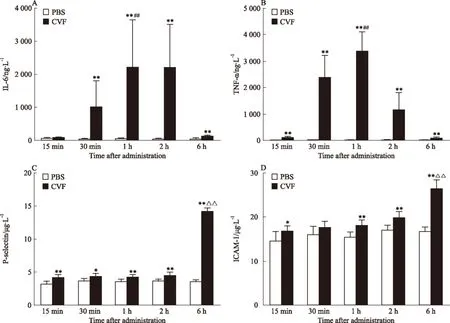
Fig 3 Concentration of inflammatory mediator and adhesion molecule in ±s,n=8)
A:IL-6; B: TNF-α; C: P-selectin; D: ICAM-1.*P<0.05,**P<0.01vsPBS control group;##P<0.01vs15 min CVF group;△△P<0.01vs15 min,30 min,1 h and 2 h CVF groups
研究结果显示,补体旁路激活后引起小鼠肺部的炎症细胞明显聚集和浸润,MPO活性明显上调,BALF中蛋白含量增加,提示微血管通透性增加。但从病理学角度来讲,补体旁路激活可以引起小鼠肺部的急性炎症变化,但损伤症状并不明显。上述结果表明,在我们设置的时间点,补体旁路过度激活可以引起小鼠肺部急性炎症的发生。而在炎症发生的过程中,肺系数和肺含水量无明显变化,这一结果可能与补体旁路激活诱导小鼠肺部急性炎症反应的病变程度有关,也可能与我们实验设置的时间点有关。
P-selectin和ICAM-1是一类在炎症启动和发生、发展中发挥重要作用的黏附分子。CVF进入血液后,通过激活补体活化内皮细胞,活化的内皮细胞表达选择素等黏附分子,在血管内皮上黏附炎症细胞,从而启动炎症和引发后续效应。P-selectin主要分布于内皮细胞和血小板,可以介导粒细胞和单核细胞在内皮细胞表面滚动和最初结合,启动炎症的早期反应[7]。本研究显示,CVF组在给药30 min后,BALF中P-selectin含量即有明显增加,在血清中随时间延长P-selectin水平也持续上升,因此P-selectin的提高间接提示了炎症反应的启动和持续。ICAM-1属于免疫球蛋白超家族中的成员之一,可引起炎症细胞牢固黏附并跨内皮移行至血管外,参与炎症的发生发展[8],ICAM-1通常在炎症反应数小时后才会出现高峰。我们之前的研究结果也显示,补体旁路激活刺激人微血管内皮细胞后的数小时内ICAM-1就会出现表达高峰[9]。在本研究中,未检测到注射CVF后BALF中ICAM-1的表达上调,但在血清中可以看到ICAM-1含量在1 h时间点后开始明显增加,其原因尚待进一步研究。
IL-6和TNF-α是介导急性期炎症反应重要的炎症介质,广泛参与了炎症反应的启动、放大过程,可激活内皮细胞产生其他炎症介质和黏附分子,引起急性期反应,启动炎症的级联反应[10-11]。本研究中,注射CVF后BALF和血清中IL-6和TNF-α的变化模式不同,BALF中IL-6和TNF-α的水平在1 h和6 h时间点呈现双高峰,血清中IL-6和TNF-α的水平在1 h时间点达到峰值,随后表达降低,说明肺部中的炎症反应持续进行,而血液中的炎症效应呈一过性,提示肺部组织是补体旁路激活引发炎症效应的主要效应靶器官之一。在我们测定的指标中,P-selectin、ICAM-1、IL-6和TNF-α虽然在急性肺损伤的发生发展过程中分别扮演着不同的角色,但它们共同参与和推动了这一急性炎症的病理变化过程。
综上所述,补体旁路激活可以在小鼠肺部引起急性炎症,主要表现为肺部组织炎性细胞浸润、黏附分子和炎性因子释放增加,其病理变化以静脉注射后30 min至1 h最为明显,呈现出急性肺损伤的早期炎症病理变化,本研究可以为后续的模型构建和筛选实验提供明确的参考依据。
[1] De Vriese A S,Sethi S,Van Praet J,et al. Kidney disease caused by dysregulation of the complement alternative pathway: an etiologic approach[J].JAmSocNephrol,2015,26(12):2917-29.
[2] Thurman J M,Holers V M. The central role of the alternative complement pathway in human disease[J].JImmunol,2006,176(3):1305-10.
[3] 孙黔云. 眼镜蛇毒因子在生命科学中的应用[J]. 生命科学,2016,28(1):22-6.
[3] Sun Q Y. Application of cobra venom factor in life sciences[J].ChinBullLifeSci,2016,28(1):22-6.
[4] 路青瑜,李 敏,孙黔云. 补体旁路激活致内皮细胞纤溶凝血相关分子表达变化及干预研究[J]. 中国药理学通报,2015,31(8):1142-6.
[4] Lu Q Y,Li M,Sun Q Y. Expression of coagulation-and fibrinolysis-related molecules of endothelial cells induced by activated complement alternative pathway and intervention[J].ChinPharmacolBull,2015,31(8):1142-6.
[5] 孙黔云,李 敏,叶巧玲,李红玲. 补体旁路激活导致内皮细胞活化和损伤[J]. 中国药理学通报,2012,28(7):925-9.
[5] Sun Q Y,Li M,Ye Q L,Li H L. Endothelial cell activation and injury induced by complement alternative pathway[J].ChinPharmacolBull,2012,28(7):925-9.
[6] 孙黔云,叶巧玲,闫银萍. 小鼠血清补体替代途径溶血活性测定的新方法[J].中国药理学通报,2011, 27(11):1619-22.
[6] Sun Q Y,Ye Q L,Yan Y P. A new method for measurement of the alternative pathway activity of mouse serum complement[J].ChinPharmacolBull,2011,27(11):1619-22.
[7] Kral J B,Schrottmaier W C,Salzmann M,Assinger A. Platelet interaction with innate immune cells[J].TransfusMedHemother,2016,43(2):78-88.
[8] Rafiee L,Hajhashemi V,Javanmard S H. Maprotiline inhibits LPS-induced expression of adhesion molecules(ICAM-1 and VCAM-1) in human endothelial cells[J].ResPharmSci,2016,11(2):138-44.
[9] 李朝胜,孙黔云. 三种化学小分子对补体旁路激活致内皮细胞黏附分子表达的干预及机制研究[J]. 中国药理学通报,2015,31(10):1421-6.
[9] Li C S,Sun Q Y. Effect of three chemical molecules on adhesion molecules expression in HEMCs induced by activated complement alternative pathway[J].ChinPharmacolBull,2015,31(10):1421-6.
[10]Zhang L,Zhao S,Yuan L,et al. Knockdown of placental growth factor(PLGF) mitigates hyperoxia-induced acute lung injury in neonatal rats: suppressive effects on NF-κB signaling pathway[J].IntImmunopharmacol,2016,38:167-74.
[11]Huang R,Li M. Protective effect of Astragaloside Ⅳ against sepsis-induced acute lung injury in rats[J].SaudiPharmJ,2016,24(3):341-7.
Inflammatory mechanism of acute lung injury in mice induced by activation of complement alternative pathway
GUO Jing1, LI Min2, YANG Fu-mei1, SUN Qian-yun1
(1.CenterforPharmacologyandDrugScreening,KeyLaboratoryofChemistryforNaturalProducts,GuizhouProvinceandChineseAcademyofSciences,Guiyang550002,China;2.GeneralWard,GuizhouProvincialPeople′sHospital,Guiyang550002,China)
Aim To study the development of acute lung inflammation in mice induced by activation of the complement alternative pathway and the changes of the related indicators, and to provide an ideal pathological model of acute lung inflammation in mice for drug screening and intervention.Methods Cobra venom factor(CVF) was used to activate complement alterna-tive pathway of SPF Kunming mice by intravenous injection. According to different sampling time, the mice were divided into 15 min, 30 min, 1 h, 2 h, 6 h group, and the parallel PBS control groups were set at the same time. Lung coefficient, lung water content, myeloperoxidase(MPO) activity, BALF cell number and protein content were tested. The pathological changes of lung tissue were observed by HE staining. The concentration of IL-6, TNF-α, P-selectin and ICAM-1 in bronchoalveolar lavage fluid(BALF) and serum were determined by ELISA.Results CVF caused pulmonary inflammatory cell infiltration in mice obviously. Compared with PBS groups, MPO activity of lung tissue, BALF cell and the protein concentration were significantly increased. The contents of IL-6, TNF-α, P-selectin in BALF and serum were increased, and the content of ICAM-1 in serum was also increased. The content of P-selectin in BALF reached the first peak at 30 min point, the content of IL-6 and TNF-α in BALF reached the first peak at 1 h point, but the indicators had no further changes at 2 h point, and all the indicators rose again at 6 h point. The levels of IL-6 and TNF-α in serum reached peak at 1 h point,then the content showed lower levels at the subsequent time points. The levels of P-selectin and ICAM-1 in serum increased along the time. Lung coefficient, lung water content and ICAM-1 of the BALF showed no significant alteration.Conclusion The activation of the complement alternative pathway can lead to acute lung inflammation in mice and the inflammatory response is the most obvious at 30 min to 1 h. The study could provide an ideal pathological model of acute lung inflammation in mice for drug screening and intervention.
cobra venom factor(CVF);acute lung injury;mouse model;alternative complement pathway;inflammation; adhesion molecules;inflammatory mediator
2016-07-22,
2016-08-22
国家自然科学基金资助项目(No 30560035);贵州省科技创新人才团队项目[No 黔科合平台人才(2016)5625号];贵州省高层次创新型人才培养项目(百层次)[No黔科合人才(2016)4018号]
郭 静(1988-),女,硕士,研究方向:心血管药理学,E-mail:gjing21@sina.com;
李 敏(1967-),女,主任医师,研究方向:急性肺损伤的发病机制及防治,通讯作者,E-mail:limin_67@hotmail.com;
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.018.html
10.3969/j.issn.1001-1978.2016.11.009
A
1001-1978(2016)11-1521-06
R-332;R322.35;R364.5;R392.11;R392.12; R563.022;R996.3
孙黔云(1968-),男,博士,研究员,硕士生导师,研究方向:心血管药理学与新药发现,通讯作者,E-mail:sunqy@hotmail.com

