胞外酸化对大鼠关节软骨细胞焦亡的影响及可能机制
吴小山,陈飞虎,葛金芳,周仁鹏,祖胜芹,朱传君
(安徽医科大学药学院,安徽 合肥 230032)
胞外酸化对大鼠关节软骨细胞焦亡的影响及可能机制
吴小山,陈飞虎,葛金芳,周仁鹏,祖胜芹,朱传君
(安徽医科大学药学院,安徽 合肥 230032)
目的 观察胞外酸化对大鼠关节软骨细胞焦亡的影响,研究该过程中可能机制。方法 利用酶消化法获得原代大鼠关节软骨细胞。软骨细胞分为不同pH处理组(pH 7.4、pH 7.0、pH 6.5和pH 6.0)以及pH6.0酸化不同时间组(0、6、12、24、48 h),经ROS还原剂NAC预处理的酸化组和正常组,Real-time PCR和Western blot观察各组促炎细胞因子IL-1β、IL-18和炎症小体组成成分ASC、NLRP3、caspase-1基因和蛋白的表达情况,ELISA检测各组细胞培养基中的IL-1β、IL-18含量,AO/ EB染色和LDH细胞毒性检测试剂盒分析细胞的死亡情况,ROS测定试剂盒观察细胞内ROS荧光强弱。结果 与pH 7.4组比较,酸化组的促炎细胞因子IL-1β、IL-18和炎症小体组成成分ASC、NLRP3、caspase-1基因和蛋白的表达明显增加,荧光显微镜观察到ROS荧光明显增强,AO/ EB染色和LDH检测实验发现酸化可以诱导软骨细胞死亡,且pH 6.0酸化处理组效果最明显;ROS还原剂NAC预处理可以明显下调IL-1β、IL-18、ASC、NLRP3、caspase-1基因和蛋白的表达,并且明显减弱软骨细胞内ROS荧光,同时明显下调细胞死亡率。结论 胞外酸化可能通过上调细胞内ROS的含量,促使软骨细胞发生焦亡。
关节炎;关节软骨细胞;细胞焦亡;炎症小体;ROS;NAC
类风湿关节炎(rheumatoid arthritis,RA)是一种难治性多系统的免疫性疾病,累及患者的外周关节,具有较高的致残、致畸性,对人类的健康危害很大[1]。研究表明,关节腔内炎性代谢物聚集导致的关节液pH值下降(可降至6.0及以下)是RA发病的主要原因之一,可导致软骨细胞过度凋亡,最终引起关节软骨及骨质的侵蚀与破坏等病理学改变[2]。同时,研究还发现促炎细胞因子IL-1β、IL-6、IL-18等在RA关节软骨破坏和软骨细胞凋亡过程中起着至关重要的作用[3]。
细胞焦亡(pyroptosis)是在2001年由Cookson等[4]研究发现的一种炎症性程序性细胞死亡方式。其典型特征为密切依赖于caspase-1/11的激活,并伴随着大量促炎细胞因子IL-1β、IL-18的释放[5]。细胞焦亡在细胞的形态学特征以及调控机制上均不同于自噬、凋亡和坏死等细胞死亡方式。坏死的特征包括细胞核破碎、溶解,细胞膜的通透性增加,细胞内成分被释放到细胞外组织中,引起局部强烈炎症反应。凋亡也是一种程序性细胞死亡过程,形态学特征为细胞皱缩、核断裂,继而形成凋亡小体。由于凋亡细胞细胞膜的完整性没有破坏,细胞内成分没有被释放到细胞外,所以很少引起周围组织的炎症反应。研究表明,焦亡细胞在形态上同时具有凋亡和坏死的特征,同时焦亡细胞的细胞膜也遭到破坏,细胞内乳酸脱氢酶(LDH)被释放到细胞外。
炎症小体(inflammasome)是存在于细胞质中的一种具有广泛活性的轮状结构体,它能激活半胱天冬酶1 (caspase-1),后者进一步促进促炎细胞因子IL-1β、IL-18切割和成熟,并且可以促使细胞发生焦亡[6]。炎症小体主要由受体蛋白(receptor protein)、凋亡相关斑点样蛋白(apoptosis associated speck-like protein containing CARD,ASC)和效应分子前半胱天冬酶1(pro-caspase-1)3部分构成。文献表明,细胞焦亡的发生与许多疾病的发生发展密切相关,例如细菌感染[7]、动脉粥样硬化性疾病[8]、神经系统性疾病[9]。最近的研究发现,细胞焦亡与一些自身免疫性疾病,例如RA的发生有关[10-12],提示细胞焦亡可能参与了RA的发生、发展过程。本课题组的前期研究结果表明,AA大鼠存在着关节软骨细胞的凋亡,同时胞外酸化(pH 6.0)可以明显诱导大鼠关节软骨细胞凋亡[13],并且存在着一定的pH依赖性。即在RA发生过程中,存在着关节软骨细胞的死亡过程,并且关节液中含有大量的炎症因子,这一点与细胞焦亡的特征相符,但是在RA发生过程中是否存在关节软骨细胞焦亡,目前尚不清楚。
本研究将用胞外酸化过程模拟RA发生过程中关节软骨细胞所处的微环境,以大鼠膝关节软骨细胞为观察对象,考察胞外酸化过程中是否存在关节软骨细胞的焦亡及其部分机制。进一步阐明胞外酸化是否可以诱导关节软骨细胞焦亡,及其可能机制。
1 材料与方法
1.1 动物 SD大鼠,SPF级,♂,体质量140 g~180 g,安徽省实验动物中心提供,动物合格证号:皖动准字01号。1.2 药品与试剂 N-acetyl-L-cysteine(NAC,C5H9NO3S,分子量163.19,纯度大于99%)、LDH检测试剂盒、ROS检测试剂盒购自碧云天公司;抗caspase-1 p10 抗体、抗ASC抗体购自美国Cell Signaling Technology公司;抗NLRP3抗体、抗β-actin抗体购自美国Biosynthesis公司;DMEM高糖培养基购自美国Hyclone公司;Ⅱ型胶原酶购自美国Sigma 公司;胎血清(FBS)购自美国Gibco公司;大鼠IL-1β、IL-18酶联免疫吸附(ELISA)试剂盒购自Elab Science。
1.3 原代大鼠关节软骨细胞的分离、培养 依照本课题组常规操作方法分离原代大鼠膝关节关节软骨细胞[14]。将原代软骨细胞用培养基重悬,并接种在25 cm2透气细胞培养瓶中,于恒温培养箱(37℃、5% CO2)中培养,48 h后观察贴壁情况并换液。以后每隔2~3 d换1次液,当细胞铺满培养瓶瓶底后进行传代处理,选取3~4代的软骨细胞进行后续实验。
1.4 细胞分组及药物处理 关节软骨细胞按照如下分组:① pH 7.4正常组、pH 7.0酸化组、pH 6.5酸化组和pH 6.0酸化组,各组细胞分别用相应pH值的含1% FBS的培养基培养24 h,收集细胞,观察酸化对细胞焦亡的影响;② pH 7.4正常组、pH 6.0酸化6 h组、酸化12 h组、酸化24 h组和酸化48 h组,处理相应时间后收集细胞,观察酸化对细胞焦亡的影响;③ pH 7.4正常组、pH 6.0酸化组以及pH 6.0+NAC(10 mmol·L-1)处理组,细胞接受相应处理后,再用pH 6.0的培养基处理24 h,收集细胞,观察NAC对胞外酸化诱导的细胞焦亡的影响。
1.5 荧光倒置显微镜观察活性氧自由基(ROS)水平 细胞前处理过程依据“1.4”中分组情况,依据ROS检测试剂盒说明书步骤处理细胞后,于荧光倒置显微镜下观察DCF的荧光强度,并拍照。注:DCF的荧光光谱和FITC的荧光光谱非常相似。
1.6 乳酸脱氢酶(LDH)检测试剂盒检测培养基中LDH水平 细胞前处理过程依据“1.4”中分组情况,96孔板分成阴性对照孔、最大酶活性孔以及药物处理孔,并做好标记。提前1 h在96孔细胞培养板“最大酶活性孔”中加入20 μL LDH释放试剂,然后轻轻吹打,在培养箱中继续培养。1h后,将96孔板用离心机离心(4℃、400×g、5 min)。转移各孔中的上清液120 μL至1块新的96孔板中,用全波长酶标仪在490 nm处检测吸光度。
1.7 ELISA检测细胞培养基中IL-1β、IL-18水平 细胞前处理过程依据“1.4”中分组情况,收集各处理组细胞的培养基,4℃、2 000 r·min-1离心20 min,收集上清液,于-80℃长期保存。按照大鼠IL-1β、IL-18检测试剂盒说明书步骤,测定各组培养基上清中IL-1β、IL-18的浓度。
1.8 软骨细胞焦亡水平检测
1.8.1 AO/EB染色观察软骨细胞焦亡情况 AO/EB染料配制:AO、EB配成100 mg·L-1的储备液,4℃保存,用前等量混合。软骨细胞接种在无菌洁净的盖玻片上,细胞贴壁牢固给予相应处理后,用PBS缓冲液清洗2次,在盖玻片上滴加1滴AO/EB染料工作液染色,15 s后,用荧光倒置显微镜观察细胞焦亡发生情况并拍照。
1.8.2 Real-time PCR检测软骨细胞IL-1β、IL-18、ASC、NLRP3、caspase-1 mRNA表达 细胞前处理过程依据“1.4”中分组情况,用TRIzol裂解细胞并提取细胞内总RNA,使用核酸定量仪对各组细胞总RNA进行定量,以1 000 ng总RNA每体系(体系为10 μL),按照TaKaRa逆转录试剂盒说明书逆转录得到cDNA。Real-time PCR引物序列见Tab 1。反应总体系为10 μL,其中上、下游引物各0.3 μL,2×SYBR Green 5 μL,cDNA 0.5 μL,无酶水3.9 μL。

Tab 1 Primer sequences of several genes for real-time PCR
1.8.3 Western blot法检测软骨细胞ASC、NLRP3、caspase-1蛋白表达 细胞前处理过程依据“1.4”中分组情况,达到预定时间后,弃去原培养基,用RIPA蛋白裂解液提取细胞总蛋白,使用荧光蛋白定量仪对各组细胞总蛋白进行定量。加5×SDS蛋白上样缓冲液混合后,于100℃沸水变性10 min,-20℃冰箱保存。将等量的各组总蛋白电泳分离后,电转膜到PVDF膜上。用相对应的一抗孵育过夜,接着用相应种属的辣根过氧化物酶标记的二抗孵育1 h,然后用化学发光ECL显影试剂盒对PVDF膜进行曝光、显影、拍照。Image软件分析蛋白显影结果。
2 结果
2.1 胞外酸化对大鼠关节软骨细胞焦亡的影响
2.1.1 胞外酸化对大鼠关节软骨细胞ASC、NLRP3、cleaved caspase-1 蛋白表达的影响 由Fig 1 Western blot 结果可知,与pH 7.4的正常组细胞相比,pH 6.5和pH 6.0酸化组关节软骨细胞ASC、NLRP3、cleaved caspase-1蛋白表达升高,且差异具有统计学意义(P<0.05或0.01)。由pH 6.0酸化不同时间的结果可以看出,随着酸化时间的延长,ASC、NLRP3、cleaved caspase-1蛋白的表达上调(P<0.05或0.01),且具有一定的时间依赖性。
2.1.2 胞外酸化对大鼠关节软骨细胞IL-1β、IL-18、ASC、NLRP3、caspase-1 mRNA转录的影响 根据Fig 2 Real-time PCR的结果可知,与pH 7.4的正常组细胞比较,pH 6.5和pH 6.0酸化组关节软骨细胞的ASC、NLRP3、caspase-1、IL-1β、IL-18 mRNA转录升高,且差异具有统计学意义(P<0.05或0.01)。同时,由pH 6.0酸化不同时间的结果可以看出,随着酸化时间的延长,ASC、NLRP3、caspase-1、IL-1β、IL-18 mRNA转录明显上调(P<0.05或0.01)。
2.2 胞外酸化对大鼠关节软骨细胞培养基中IL-1β、IL-18蛋白表达的影响 根据Fig 3的结果可知,与pH 7.4的正常组细胞相比,pH 6.5和pH 6.0酸化明显上调关节软骨细胞的培养基中促炎细胞因子IL-1β、IL-18水平,且差异具有统计学意义(P<0.01)。同时,随着pH 6.0酸化时间的延长,软骨细胞的培养基中促炎细胞因子IL-1β、IL-18水平明显升高(P<0.05或0.01)。
2.3 胞外酸化对大鼠关节软骨细胞LDH释放率的影响 根据Fig 4的结果可知,与pH 7.4的正常组细胞相比,pH 6.5和pH 6.0酸化明显上调关节软骨细胞LDH的释放率,且差异具有统计学意义(P<0.01)。同时,随着pH 6.0酸化时间的延长,软骨细胞的培养基中LDH水平明显升高(P<0.05或0.01)。

Fig 1 Effects of extracellular acidosis on protein expression of ASC, NLRP3, cleaved caspase-1(n=3)

Fig 2 Effects of extracellular acidosis on mRNA expression of ASC, NLRP3, caspase-1, IL-1β,IL-18(n=3)
*P<0.05,**P<0.01vspH 7.4 group

Fig 3 Effects of extracellular acidosis on expression of IL-1β, IL-18 in cultured supernatants(n=3)
*P<0.05,**P<0.01vspH 7.4 group
2.4 胞外酸化对大鼠关节软骨细胞内ROS产生的影响 从Fig 5的荧光倒置显微镜拍照结果以及荧光定量结果可知,与pH 7.4的正常组细胞相比,pH 6.5和pH 6.0酸化组软骨细胞内ROS绿色荧光明显增强,说明酸化组软骨细胞内ROS表达量明显升高。
2.5 NAC对胞外酸化诱导的软骨细胞ROS产生的影响 由Fig 6的荧光倒置显微镜拍照结果以及荧光定量结果可知,与pH 7.4的正常组细胞相比,pH 6.0酸化组软骨细胞内ROS绿色荧光明显增强,用ROS还原剂NAC(10 mmol·L-1)预处理可以明显降低软骨细胞内ROS水平。
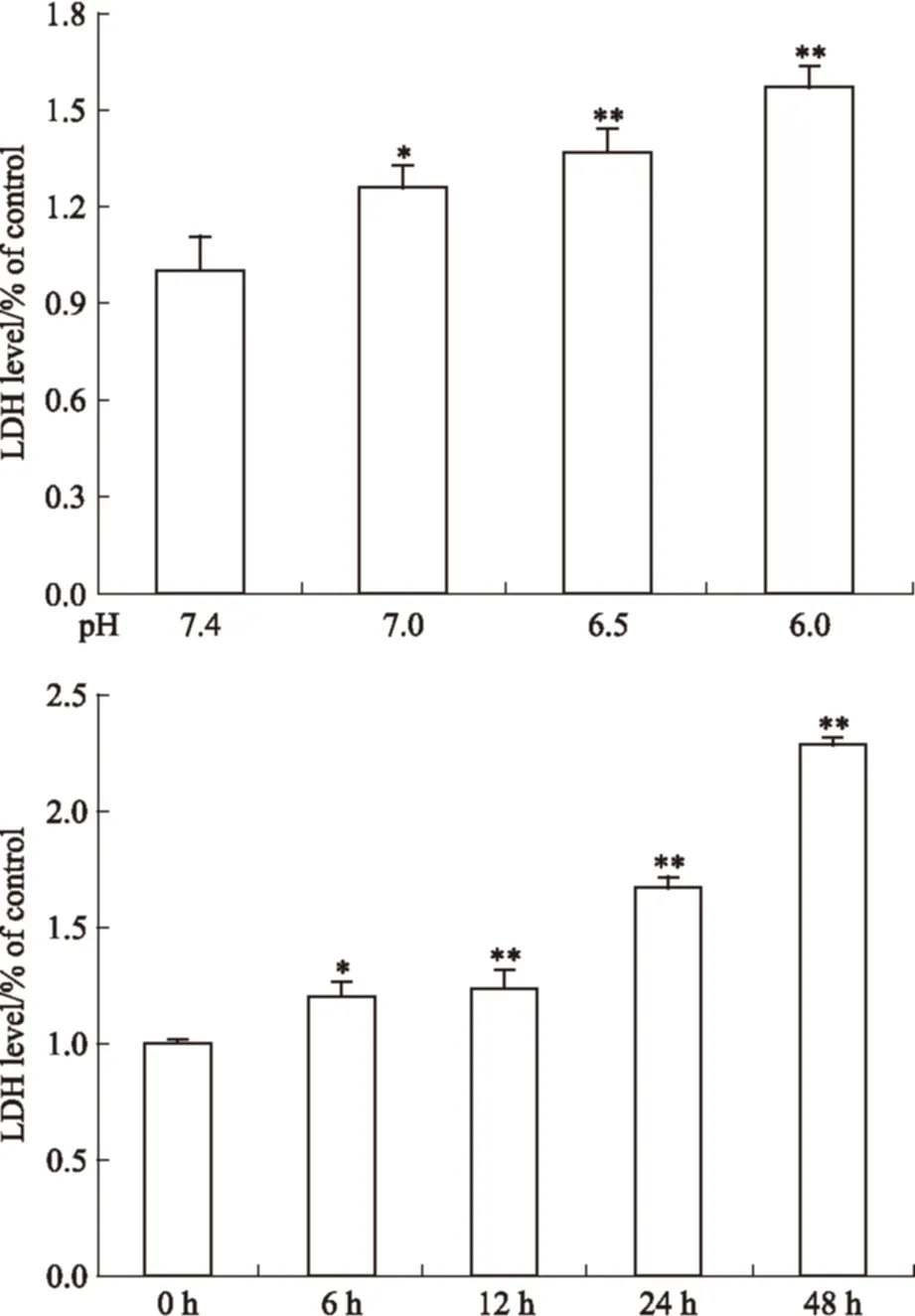
Fig 4 Effects of extracellular acidosis on level of LDH in cultured supernatants(n=3)
*P<0.05,**P<0.01vspH 7.4 group
2.6 NAC对胞外酸化诱导的细胞焦亡的影响
2.6.1 NAC对胞外酸化诱导的软骨细胞ASC、NLRP3、caspase-1、IL-1β、IL-18表达的影响 根据Fig 7的Western blot和Real-time PCR结果可知,与pH 7.4的正常组细胞相比,pH 6.0酸化组关节软骨细胞的ASC、NLRP3、caspase-1、IL-1β、IL-18基因和蛋白表达明显升高(P<0.05或0.01),用ROS还原剂NAC(10 mmol·L-1)预处理可以明显降低软骨细胞ASC、NLRP3、caspase-1、IL-1β、IL-18基因和蛋白表达水平(P<0.05或0.01)。
2.6.2 AO/EB染色观察NAC对胞外酸化诱导的软骨细胞焦亡的影响 由Fig 8的荧光倒置显微镜拍照结果以及荧光定量结果可知,pH 7.4的正常组细胞死亡数较少,pH 6.0酸化组软骨细胞被染成橘黄色,着色细胞比例增加,细胞死亡明显增多,用NAC预处理可以明显抑制软骨细胞死亡。
2.7 NAC对胞外酸化诱导的软骨细胞培养基中IL-1β、IL-18蛋白水平的影响 由Fig 9 ELISA检测结果可知,与pH 7.4的正常组细胞相比,pH 6.0酸化组关节软骨细胞培养基中促炎细胞因子IL-1β、IL-18含量明显上调(P<0.05或0.01),用NAC预处理可以明显降低软骨细胞培养基中促炎细胞因子IL-1β、IL-18水平。

Fig 5 Effects of extracellular acidosis on expression of ROS
A:pH 7.4 group;B:pH 7.0 group;C:pH 6.5 group;D:pH 6.0 group;E:Fluorescent quantitative results.*P<0.05,**P<0.01vspH 7.4 group

Fig 6 Effects of NAC on extracellular acidosis induced expression of ROS
A:pH 7.4 group;B:pH 6.0 group;C:pH 6.0+NAC group;D:Fluorescent quantitative results.**P<0.01vspH 7.4 group;##P<0.01vspH 6.0 group
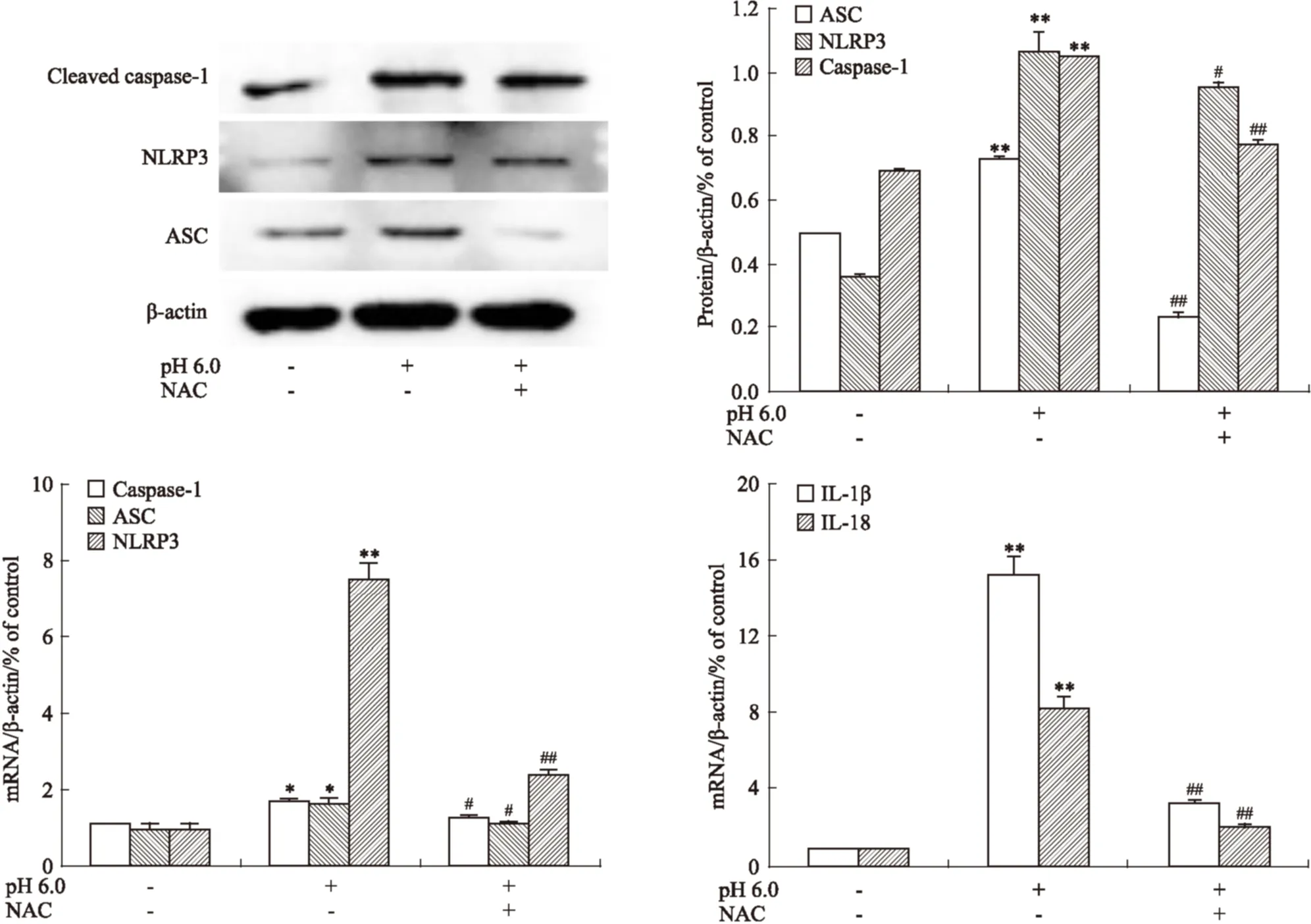
Fig 7 Effects of NAC on extracellular acidosis induced expression of ASC, NLRP3, caspase-1, IL-1β, IL-18(n=3)
*P<0.05,**P<0.01vspH 7.4 group;#P<0.05,##P<0.01vspH 6.0 group

Fig 8 Effects of NAC on extracellular acidosis induced pyroptosis by AO/EB staining
A:pH 7.4 group;B:pH 6.0 group;C:pH 6.0+NAC group;D:Fluorescent quantitative results.**P<0.01vspH 7.4 group;##P<0.01vspH 6.0 group

Fig 9 Effects of NAC on extracellular acidosis induced expression of IL-1β, IL-18 in cultured supernatants(n=3)
*P<0.05,**P<0.01vspH 7.4 group;#P<0.05,##P<0.01vspH 6.0 group
2.8 NAC对胞外酸化诱导的软骨细胞LDH释放率的影响 由Fig 10 LDH细胞毒性检测结果可知,与pH 7.4的正常组细胞相比,pH 6.0酸化组关节软骨细胞培养基中LDH含量明显上调(P<0.01),用NAC预处理可以明显降低软骨细胞培养基中LDH水平,即用NAC预处理可以降低胞外酸化诱导的关节软骨细胞的死亡率。
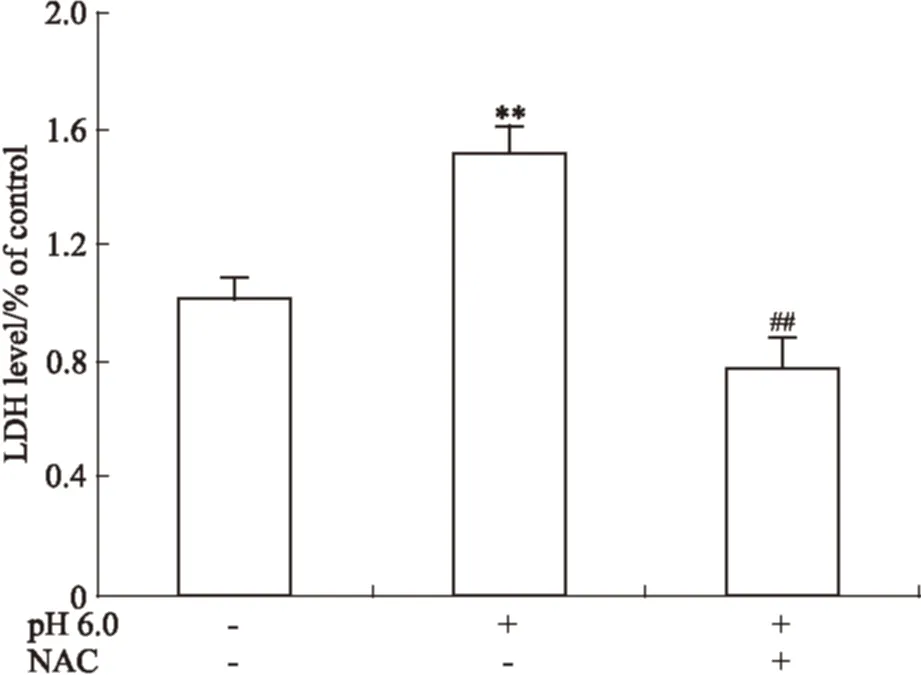
Fig 10 Effects of NAC on extracellular acidosis induced expression of LDH in cultured supernatants(n=3)
**P<0.01vspH 7.4 group;##P<0.01vspH 6.0 group
3 讨论
细胞焦亡是高度依赖于caspase-1/11激活的一种炎症性死亡方式[15],它通过激活细胞内的多种多蛋白复合物炎症小体,广泛参与机体的先天性免疫和获得性免疫系统抵抗微生物入侵的过程[16]。在病理状态下,需要2个关键信号的激活才能促使细胞焦亡发生,以及促炎因子的释放:信号1,外来刺激激活膜上的模式识别受体(PRRs),促进细胞内炎症小体组成成分ASC、NLRP3、caspase-1以及促炎细胞因子IL-1β、IL-18 基因的转录和蛋白的合成;信号 2,外部信号促进炎症小体复合物的聚集和组装,以及促炎细胞因子IL-1β、IL-18的剪切成熟[17-18]。研究表明,自然界的多种物质[19]都可以激活细胞焦亡信号通路,导致细胞焦亡的发生,例如多种细菌毒素、ATP、尿酸结晶、明矾、dsDNA、Ca2+、ROS以及氢离子[20]。
近年来的研究发现,细胞焦亡与RA的发生、发展过程密切相关。Kastbom等[10]研究发现,在瑞典人群的RA患者中存在NLRP3炎症小体基因的多态性,同时Choulaki等[11]的研究也发现,RA患者的外周血细胞中NLRP3炎症小体的表达量明显增加。此外,研究还发现,用药物A20阻断NLRP3炎症小体、抑制其聚集和激活对RA患者的关节有一定的保护作用[12]。综合表明在RA中存在细胞焦亡,但具体机制有待研究证实。在RA中关节部位局部组织的高度酸化是造成RA患者关节软骨侵蚀、骨质破坏的主要因素。Rajamäki等[21]研究发现,胞外酸化通过促进人巨噬细胞NLRP3炎症小体的聚集、组装,从而促进其IL-1β的合成释放。本课题组的前期研究也发现pH6.0酸化处理可以明显诱导大鼠关节软骨细胞凋亡[14]。但是在RA局部组织酸化的微环境中是否存在关节软骨细胞的焦亡,尚不清楚。
本研究以原代大鼠关节软骨细胞为研究对象,利用胞外酸化处理模拟软骨细胞所处微环境,观察大鼠关节软骨细胞在用胞外酸化处理后是否发生焦亡。实验结果表明,酸化处理后,关节软骨细胞炎症小体组成成分ASC、NLRP3、caspase-1、促炎细胞因子IL-1β、IL-18基因和蛋白的表达明显增加,LDH细胞毒性检测发现LDH的释放率均明显增加,说明酸化处理可以诱导关节软骨细胞死亡。此外,细胞内ROS的表达量也明显上调。以上结果提示胞外酸化刺激可以诱导关节软骨细胞发生焦亡。
活性氧自由基(reactive oxygen species,ROS)是细胞内的一种重要的第二信使分子,具有极为重要的生物学活性和功能,例如氧化应激、细胞分化以及细胞凋亡等,在多种疾病的发生、发展过程中发挥着重要的作用[22]。细胞内ROS主要来自于细胞线粒体的氧化磷酸化过程,在哺乳动物细胞中ROS也由一系列酶活性产生,例如NADPH氧化酶。研究表明,ROS参与NLRP3炎症小体的激活过程[23]。研究发现,当单核细胞暴露于NLRP3炎症小体激活因子的情况下,可以促使ROS的生成,从而进一步促进氧化还原依赖的转录因子如NF-κB和AP-1的激活,促进促炎细胞因子的产生。同时,体内研究还发现,IL-1β的合成和caspase-1的激活也依赖于ROS的产生。本实验的研究结果表明,与pH 6.0酸化组比较,使用ROS还原剂NAC预处理可以明显抑制细胞内ROS的表达,下调炎症小体组成成分ASC、NLRP3、caspase-1、促炎细胞因子IL-1β、IL-18基因和蛋白的表达,降低LDH的释放率,AO/EB染色发现NAC同时也可以抑制软骨细胞的死亡。
综上所述,本研究证实胞外酸化的微环境可以诱导关节软骨细胞发生焦亡,促进软骨细胞分泌促炎细胞因子IL-1β、IL-18,加重关节软骨局部组织的侵蚀破坏和炎症反应,并且这种诱导作用与胞外酸化促进软骨细胞内ROS表达有关。提示RA的发生、发展很可能与关节软骨细胞焦亡密切相关,为将来RA的治疗提供了新方向。
[1] Branimir A, Miroslav M. Pathogenesis of rheumatoid arthritis[J].Reumatizam, 2014, 61(2):19-23.
[2] Firestein G S. Evolving concepts of rheumatoid arthritis[J].Nature, 2003, 423(6937):356-61.
[3] Astry B, Harberts E, Moudgil K D. A cytokine-centric view of the pathogenesis and treatment of autoimmune arthritis[J].JInterferonCytokineRes,2011, 31(12):927-40.
[4] Cookson B T, Brennan M A. Pro-inflammatory programmed cell death[J].TrendsMicrobiol, 2001, 9(3):113-4.
[5] Lim Y, Kumar S. A single cut to pyroptosis[J].Oncotarget, 2015, 6(35): 36926-7.
[6] Gross O, Thomas C J, Guarda G, Tschopp J. The inflammasome: an integrated view[J].ImmunolRev, 2011, 243(1):136-51.
[7] Miao E A, Leaf I A, Treuting P M, et al. Caspase-1-induced pyroptosis is an innate immune effector mechanism against intracellular bacteria[J].NatImmunol, 2010, 11(12):1136-42.
[8] Duewell P, Kono H, Rayner K J, et al. NLRP3 inflammasomes are required for atherogenesis and activated by cholesterol crystals[J].Nature, 2010, 464(7293):1357-61.
[9] Suzuki H, Sozen T, Hasegawa Y, et al. Caspase-1 inhibitor prevents neurogenic pulmonary edema after subarachnoid hemorrhage in mice[J].Stroke, 2009, 40(12):3872-5.
[10]Kastbom A, Verma D, Eriksson P, et al. Genetic variation in proteins of the cryopyrin inflammasome influences susceptibility and severity of rheumatoid arthritis(the Swedish tira project)[J].Rheumatology(Oxford), 2008, 47(4):415-7.
[11]Choulaki C, Papadaki G, Repa A, et al. Enhanced activity of NLRP3 inflammasome in peripheral blood cells of patients with active rheumatoid arthritis[J].ArthritisResTher, 2015,17:257.
[12]Vande Walle L, Van Opdenbosch N, Jacques P, et al. Negative regulation of the NLRP3 inflammasome by A20 protects against arthritis[J].Nature, 2014, 512(7512):69-73.
[13]Yuan F L, Chen F H, Lu W G, et al. Acid-sensing ion channel 1a mediates acid-induced increases in intracellular calcium in rat articular chondrocytes[J].MolCellBiochem, 2010, 340(1-2):153-9.
[14]张晨晨,唐 杰,陈飞虎,等.酸敏感离子通道1a 在酸诱导的大鼠关节软骨细胞自噬的作用及其机制研究[J].中国药理学通报,2013,29(8):1092-8.
[14]Zhang C C, Tang J, Chen F H, et al. Effects of acid-sensing ion channel 1a on acid-induced autophagy of articular chondrocytes and its possible mechanisms[J].ChinPharmacolBull, 2013,29(8):1092-8.
[15]Lamkanfi M, Dixit V M. Mechanisms and functions of inflammasomes[J].Cell, 2014, 157(5):1013-22.
[16]Bergsbaken T, Fink S L, Cookson B T. Pyroptosis: host cell death and inflammation[J].NatRevMicrobiol, 2009, 7(2):99-109.
[17]Segovia J, Sabbah A, Mgbemena V, et al. TLR2/Myd88/NF-kappaB pathway, reactive oxygen species, potassium efflux activates NLRP3/ASC inflammasome during respiratory syncytial virus infection[J].PLoSOne, 2012, 7(1):e29695.
[18]Franchi L, Warner N, Viani K, Nunez G. Function of Nod-like receptors in microbial recognition and host defense[J].ImmunolRev, 2009, 227(1): 106-28.
[19]Jamilloux Y, Seve P, Henry T. Inflammasomes in human diseases[J].RevMedInterne, 2014, 35(11):730-41.
[20]Oorni K, Rajamaki K, Nguyen S D,et al. Acidification of the intimal fluid: the perfect storm for atherogenesis[J].JLipidRes, 2015, 56(2):203-14.
[21]Rajamaki K, Nordstrom T, Nurmi K, et al. Extracellular acidosis is a novel danger signal alerting innate immunity via the NLRP3 inflammasome[J].JBiolChem, 2013, 288(19): 13410-9.
[22]Inoue M, Sato E F, Nishikawa M, et al. Mitochondrial generation of reactive oxygen species and its role in aerobic life[J].CurrMedChem, 2003, 10(23):2495-505.
[23]Harijith A, Ebenezer D L, Natarajan V. Reactive oxygen species at the crossroads of inflammasome and inflammation[J].FrontPhysiol, 2014,5:352.
Effects of extracellular acidosis on pyroptosis of rat articular chondrocytes and its possible mechanisms
WU Xiao-shan,CHEN Fei-hu,GE Jin-fang,ZHOU Ren-peng,ZU Sheng-qin,ZHU Chuan-jun
(SchoolofPharmaceuticalSciences,AnhuiMedicalUniversity,Hefei230032,China)
Aim To study the effects of extracellular acidosis on articular chondrocytes pyroptosis and its possible mechanisms.Methods Primary articular chondrocytes were incubated in different pH and NAC. The expression of proinflammatory cytokines IL-1β, IL-18, ASC, NLRP3, caspase-1 were detected by Western blot and real-time PCR. The state of pyroptosis was identified by AO/EB staining and LDH contents. The expression of ROS was observed by DCFH-DA, and ELISA was used to detect the IL-1β,IL-18 in cultured supernatants.Results Compared with the normal cell, extracellular acidosis could increase the expression of IL-1β, IL-18, ASC, NLRP3 and caspase-1, upregulate the fluorescence intensity of intercellular ROS, accompanied with the promoted release of LDH. Moreover, it is observed that extra-cellular acidosis could also induce chondrocytes death by AO/EB staining. NAC,the scavenger of ROS could inhibit these effects of extracellular acidosis on chondrocytes.Conclusion Extracellular acidosis may induce chondrocyte pyroptosis via upregulating the intracellular ROS content.
arthritis; articular chondrocytes; pyroptosis; inflammasome; ROS; NAC
2016-07-13,
2016-08-13
国家自然科学基金资助项目(No 81271949,30873080)
吴小山(1991-),男,硕士生,研究方向:分子药理学,E-mail:wxsahmu@sina.com;
陈飞虎(1962-),男,博士,教授,博士生导师,研究方向:抗炎免疫药理学与分子药理学,通讯作者,E-mail:cfhchina@sohu.com
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.022.html
10.3969/j.issn.1001-1978.2016.11.011
A
1001-1978(2016)11-1531-09
R-332;R322.72;R329.25;R392.12;R593.22

