CYP3A5基因型对中国肾移植术后患者体内他克莫司缓释剂型药动学参数的影响
陈 攀,傅 茜,李晶洁,孙萍萍,邓蓉蓉,李 军,刘晓曼,王洪阳,黄 民,陈 孝,王长希
(中山大学 1.附属第一医院药学部临床药学室、2. 附属第一医院器官移植中心、3. 临床药理研究所,广东 广州 510080;4. 中山大学附属第六医院生殖医学中心,广东 广州 510655)
CYP3A5基因型对中国肾移植术后患者体内他克莫司缓释剂型药动学参数的影响
陈 攀1,傅 茜2,李晶洁4,孙萍萍1,邓蓉蓉1,李 军2,刘晓曼3,王洪阳2,黄 民3,陈 孝1,王长希2
(中山大学 1.附属第一医院药学部临床药学室、2. 附属第一医院器官移植中心、3. 临床药理研究所,广东 广州 510080;4. 中山大学附属第六医院生殖医学中心,广东 广州 510655)
目的 研究CYP3A5基因型对中国肾移植术后患者体内他克莫司缓释剂型药动学参数的影响。方法 采用化学发光免疫法检测20例肾移植术后患者在服用缓释(10例)和普通剂型(10例)他克莫司后的全血浓度;采用聚合酶链反应-限制性片段长度多态法检测服用缓释剂型他克莫司患者的CYP3A5基因型;缓释剂型组检测0~24 h的11个时间点的血药浓度,而普通剂型检测0~12 h内的10个时间点的血药浓度。结果 无剂量校正的缓释剂型组的AUC0~24 h为普通剂型组AUC0~12 h的1.78倍,有剂量校正的缓释剂型组的C0为普通剂型的60%,其余药动学参数差异无显著性;缓释剂型中慢代谢型组的Cmax、AUC0~24 h和C0分别为快代谢型组的1.75、1.96、2.49倍(无剂量校正)以及1.80、2.34和2.64倍(有剂量校正);缓释剂型组的C0与AUC0~24 h的相关性良好。结论 他克莫司普通剂型转换至缓释剂型时应该注意上调给药剂量,同时缓释剂型应结合CYP3A5的基因型检测,确保C0值在治疗窗范围内。
他克莫司;缓释剂型;肾移植;CYP3A5;药代动力学;基因多态性;免疫抑制剂
他克莫司是目前临床上最常用的钙调磷酸酶抑制剂,但该药存在明显的个体间及个体内药动学差异,且治疗窗狭窄[1-2]。现有他克莫司剂型包括普通与缓释2种,给药频次分别为1 d 2次与1 d 1次[3]。影响他克莫司血药浓度的重要因素之一为CYP3A5 6986A>G位点的基因多态性,CYP3A5*1/*1和CYP3A5*1/*3基因型相比CYP3A5*3/*3具有明显的CYP3A5酶活性,能快速代谢他克莫司,导致其体内浓度相对较低[4]。目前,国内尚无CYP3A5基因多态性对他克莫司缓释剂型药动学特征的报道,本实验在肾移植术后肾功能稳定的患者中比较CYP3A5基因多态性与缓释剂型这2个因素对他克莫司药动学特征的影响,为中国肾移植术后患者提供他克莫司用药参考。
1 对象与方法
1.1 受试对象的选择 本研究纳入2013~2014年于中山大学附属第一医院器官移植中心进行肾移植手术的患者,共20例。其中,他克莫司缓释剂型组与普通剂型组各10例。
1.1.1 入选标准 ① 首次肾移植;② 单一器官移植;③ 年龄18~60岁,性别不限;④ 肝功能正常;⑤ 采用他克莫司+霉酚酸酯+糖皮质激素三联免疫抑制治疗方案。
1.1.2 排除标准 ① 难以控制的严重感染(细菌、真菌、病毒感染);② 恶性肿瘤患者、糖尿病患者、人类免疫缺陷病毒携带者;③ 多器官移植;④ 术前群体反应性抗体(PRA)>20%;⑤ 慢性肠炎、慢性腹泻者;⑥ 有严重的心肺功能不全、肝硬化病史;⑦ 处于妊娠期或计划在1年内怀孕者;⑧ 唑类抗真菌类药物(氟康唑、伊曲康唑等)、五酯片、抗结核药物等已知与FK506相互作用的药物。
本研究方案经中山大学附属第一医院医学伦理委员会讨论并批准。所有受试者均在入组前签署知情同意书。
1.2 他克莫司采血时间点选择与浓度检测 缓释剂型的采血时间点为0、0.5、1、1.5、2、3、4、6、9、12、24 h,共11个时间点,而普通剂型的采血时间点为0、0.5、1、1.5、2、3、4、6、9、12 h,共10个时间点。每个时间点采集外周静脉血2 mL,置于肝素化抗凝真空管中,采用化学发光免疫法检测他克莫司全血浓度。为便于比较, 对他克莫司的浓度进行剂量校正,校正浓度=全血浓度·体质量·剂量-1。
1.3 CYP3A5基因型检测 于给药前1 d,取患者外周静脉血2 mL,参照Loparev等[5]的碘化钠-氯仿法提取基因组DNA。CYP3A5*3(6986 A>G)的基因型沿用本实验室采用的聚合酶链反应-限制性片段长度多态(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP) 法检测[6]。
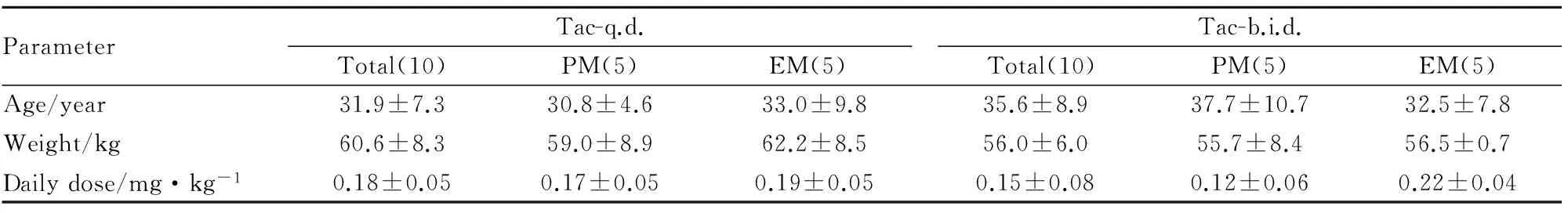
Tab 1 Demographics of enrolled patients and daily dose of tacrolimus

2 结果
2.1 受试患者一般信息与给药剂量 如Tab 1所示,此次纳入实验的受试者共20例,其中缓释剂型和普通剂型各10例,均根据CYP3A5 6986A>G的多态性分为快代谢型和慢代谢型组,各5例。各组别之间在年龄、体质量差异均无显著性。普通剂型组中,快代谢型组的给药剂量是慢代谢型组的1.8倍(P<0.05)。
2.2 他克莫司缓释剂型与普通剂型在肾移植术后患者中的药代动力学参数 Fig 1为肾移植术后患者中分别服用他克莫司缓释剂型和普通剂型的剂量校正血药浓度-时间曲线。从Tab 2可以得出,在血药浓度无剂量校正情况下,缓释剂型与普通剂型组的Tmax、Cmax和C0差异均没有显著性,而缓释剂型组的AUC0~24 h为普通剂型组AUC0~12 h的1.78倍。在剂量校正情况下,相比缓释剂型,普通剂型的Tmax与AUC有下降趋势,但差异无显著性,同时缓释剂型的C0为普通剂型的60%。
2.3 他克莫司缓释剂型在不同CYP3A5基因型肾移植术后患者中的药代动力学参数 Fig 2为不同CYP3A5基因型的肾移植术后患者服用他克莫司缓释剂型后的剂量校正血药浓度-时间曲线。从Tab 3可以看出,在血药浓度无剂量校正情况下,缓释剂型的慢代谢型组和快代谢组的Tmax差异无显著性,而慢代谢组的Cmax、AUC0~24 h和C0相比快代谢型组,分别上调了1.75、1.96和2.49倍。在有剂量校正的情况下,两组的Tmax差异无显著性,但慢代谢组的Cmax、AUC0~24 h和C0相比快代谢型组,分别上调了1.80、2.34和2.64倍。
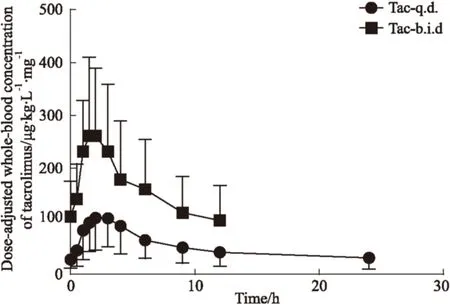
Fig 1 Dose-adjusted ±s whole-blood concentration-time

ParameterTac-q.d.Tac-b.i.d.Non-dose-adjustedTmax/h2.5±0.91.9±0.7Cmax/μg·L-120.3±8.318.4±4.4AUC0-t/μg·h·L-1207.7±107.5*116.8±44.3C0/μg·L-15.1±3.36.0±2.8Dose-adjustedTmax/h2.5±0.91.9±0.7Cmax/μg·L-1121.1±56.1126.7±56.9AUC0-t/μg·h·L-11238±702.5806.5±461.1C0/μg·L-130.6±21.0*50.7±33.1
*P<0.05vsTac-b.i.d
2.4 不同CYP3A5基因型的肾移植术后患者口服他克莫司缓释或普通剂型后的AUC0-t与C0的相关性 由Tab 4可以得出,在血药浓度无剂量校正情况下,缓释剂型组的AUC0-t和C0的相关性好于普通剂型组,相关系数分别为0.94和0.78,其中缓释慢代谢组与快代谢的相关系数差异无显著性(0.89与0.91)。在剂量校正情况下,普通与缓释剂型组的AUC0-t和C0均呈现良好的相关性。
3 讨论
他克莫司的药动学个体差异性大,且治疗窗相对窄,使得该药成为临床上最为常见的需要开展个体化用药的药物之一[1,7]。影响他克莫司药动学的因素较多,包括基因多态性、肝功能、胃肠道功能、饮食、联合用药、用药依从性等[8]。其中,他克莫司缓释剂型开发的主要目的就是提高患者的用药依从性,从1 d 2次的给药频次改进到1 d 1次,但在相同日剂量情况下,患者服用缓释与普通剂型后体内的AUC与C0是否一致存在争论[3]。生产厂家推荐剂型转换时的剂量比为1 ∶1,而且提出该种剂型转换对他克莫司的体内暴露水平无影响[9-11]。但近年的一些国外临床试验发现相同剂量下,缓释剂型的C0与AUC下降至普通剂型的25%,因此建议在转换剂型时应该相应上调缓释剂型的给药剂量[12-14]。在本实验中,我们发现在中国肾移植术后患者中,缓释剂型的剂量校正C0值相比普通剂型下降占比为0.4,同时分析发现C0与AUC0-t的相关性良好。因此,建议患者将普通剂型转换为缓释剂型服用的时候,应该注意相应上调给药剂量,并在转换期间密切监测C0浓度。
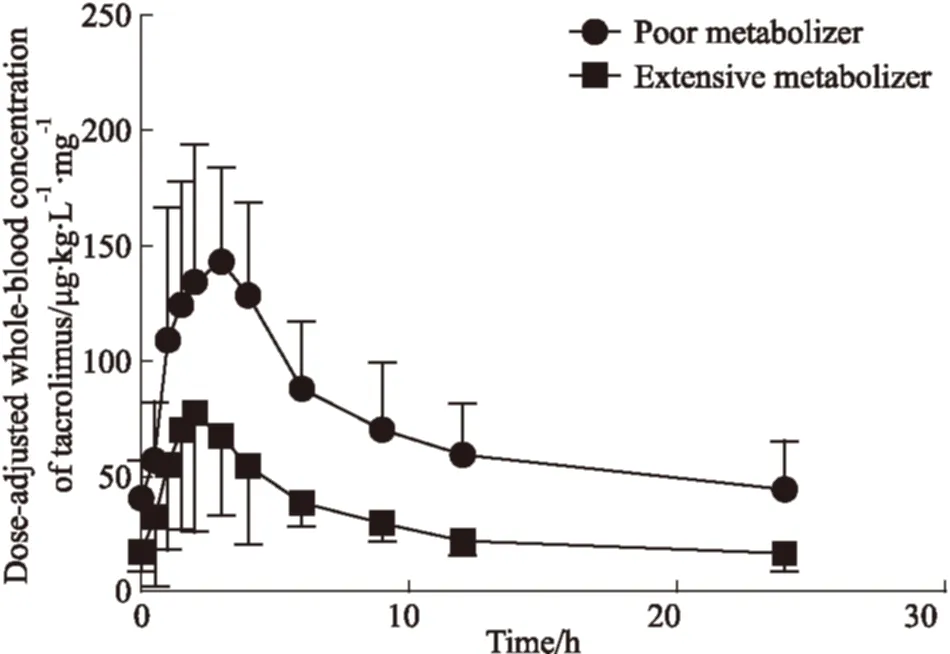
Fig 2 Dose-adjusted ±s whole-blood concentration-time curves

ParameterTac-q.d.PMEMNon-dose-adjustedTmax/h2.5±1.02.5±1.0Cmax/μg·L-125.8±7.6*14.8±4.5AUC0-t/μg·h·L-1285.7±101.4*129.8±22.7C0/μg·L-17.3±3.4*2.92±1.1Dose-adjustedTmax/h2.5±1.02.5±1.0Cmax/μg·L-1155.8±46.6*86.4±43.7AUC0-t/μg·h·L-11735.0±641.1*741.2±286.0C0/μg·L-144.4±21.2*16.8±8.2
*P<0.05vsEM

Tab 4 Linear relationship between AUC0-t
CYP3A5 6986A>G位点的多态性在很大程度上影响了他克莫司给药剂量的制定,在免疫抑制剂的个体化给药过程中,患者通常需要在移植术前采血检测其CYP3A5的基因型来确定初始给药剂量。目前,国内尚无CYP3A5的基因型对缓释型他克莫司药动学行为的影响研究。本实验发现无论剂量有无校正,其药动学特征的相对趋势没有改变,均体现为慢代谢型组的Cmax、AUC0-t和C0值高于快代谢组。此外,有研究提出相比普通剂型,缓释剂型他克莫司主要延缓肠道的吸收程度,因此,缓释剂型更大程度上会受到肠道CYP3A5的影响[3,15],这提示患者在应用缓释剂型他克莫司时,更需要根据CYP3A5的基因型制定给药剂量。
鉴于本实验的样本量相对较少,虽然有看到一些药动学参数的改变趋势,但统计分析差异并无显著性,因此,仍需在后续研究中扩大样本量。同时,除CYP3A5外,ABCB1的基因多态性也为报道较多的能够影响他克莫司的因素[4],因此,后续研究也应该纳入ABCB1的基因型分析,从而更好制定缓释剂型他克莫司的个体化给药剂量。
综上所述,本实验表明缓释剂型他克莫司相比普通剂型,更适合采用C0作为治疗药物的监测指标。此外,在将普通剂型转换至缓释剂型的时候,应该注意上调他克莫司给药剂量,同时结合CYP3A5的基因型检测,确保C0在治疗窗范围内。
(致谢:本研究在中山大学附属第一医院器官移植二区完成血样及临床数据收集,在中山大学附属第一医院药学部及中山大学临床药理研究所实验室完成血药浓度及基因型检测工作,数据统计分析得到来自中山大学附属第六医院的李晶洁帮助,感谢上述人员对本研究给予支持和帮助。)
[1] Schiff J, Cole E, Cantarovich M.Therapeutic monitoring of calcineurin inhibitors for the nephrologist[J].ClinJAmSocNephrol, 2007, 2(2): 374-84.
[2] 陈长仁, 何发忠, 周宏灏, 等.精准医学的基础研究与临床转化[J].中国药理学通报, 2015,31(12):1629-32.
[2] Chen C R, He F Z, Zhou H H, et al, Basic research and clinical translation of precision medicine[J].ChinPharmacolBull, 2015,31(12): 1629-32.
[3] Barraclough K A, Isbel N M, Johnson D W,et al.Once-versus twice-daily tacrolimus: are the formulations truly equivalent?[J].Drugs, 2011, 71(12):1561-77.
[4] Macphee I A, Fredericks S, Tai T,et al.Tacrolimus pharmacogenetics: polymorphisms associated with expression of cytochrome p450 3A5 and P-glycoprotein correlate with dose requirement[J].Transplantation, 2002, 74(11): 1486-9.
[5] Loparev V N, Cartas M A, Monken C E,et al.An efficient and simple method of DNA extraction from whole blood and cell lines to identify infectious agents[J].JVirolMethods, 1991, 34(1): 105-12.
[6] Wang Y, Wang C, Li J,et al.Effect of genetic polymorphisms of CYP3A5 and MDR1 on cyclosporine concentration during the early stage after renal transplantation in Chinese patients co-treated with diltiazem[J].EurJClinPharmacol, 2009, 65(3):239-47.
[7] 陈 冰, 蔡卫民.群体药动学在免疫抑制剂合理用药中的应用[J].中国药理学通报, 2010,26(2): 159-63.
[7] Chen B, Cai W M. Application of population pharmacokinetics in the rational usage of immunosuppressive drugs[J].ChinPharmacolBull, 2010,26(2): 159-63.
[8] Staatz C E, Tett S E.Clinical pharmacokinetics and pharmacodynamics of tacrolimus in solid organ transplantation[J].ClinPharmacokinet, 2004, 43(10): 623-53.
[9] Alloway R, Steinberg S, Khalil K,et al.Conversion of stable kidney transplant recipients from a twice daily prograf-based regimen to a once daily modified release tacrolimus-based regimen[J].TransplantProc, 2005, 37(2): 867-70.
[10]Alloway R, Steinberg S, Khalil K,et al.Two years postconversion from a prograf-based regimen to a once-daily tacrolimus extended-release formulation in stable kidney transplant recipients[J].Transplantation, 2007,83(12): 1648-51.
[11]Florman S, Alloway R, Kalayoglu M,et al.Conversion of stable liver transplant recipients from a twice-daily prograf-based regimen to a once-daily modified release tacrolimus-based regimen[J].TransplantProc, 2005, 37(2): 1211-3.
[12]Wlodarczyk Z, Squifflet J P,Ostrowski M,et al.Pharmacokinetics for once- versus twice-daily tacrolimus formulations in de novo kidney transplantation: a randomized, open-label trial[J].AmJTransplant, 2009, 9(11): 2505-13.
[13]de Jonge H, Kuypers D R, Verbeke K,et al.Reduced C0concentrations and increased dose requirements in renal allograft recipients converted to the novel once-daily tacrolimus formulation[J].Transplantation, 2010, 90(5): 523-9.
[14]Satoh S, Niioka T, Kagaya H,et al.Pharmacokinetic and CYP3A5 pharmacogenetic differences between once- and twice-daily tacrolimus from the first dosing day to 1 year after renal transplantation[J].Pharmacogenomics, 2014, 15(11): 1495-506.
[15]Niioka T, Satoh S, Kagaya H,et al.Comparison of pharmacokinetics and pharmacogenetics of once- and twice-daily tacrolimus in the early stage after renal transplantation[J].Transplantation, 2012, 94(10): 1013-9.
Impact of CYP3A5 genetic polymorphism on modified releasing tacrolimus pharmacokinetics in Chinese renal transplant recipients
CHEN Pan1, FU Qian2, LI Jing-jie4, SUN Ping-ping1, DENG Rong-rong1,LI Jun2, LIU Xiao-man3, WANG Hong-yang2, HUANG Min3, CHEN Xiao1, WANG Chang-xi2
(1.DeptofPharmacy,theFirstAffiliatedHospitalofSunYat-senUniversity,2.OrganTransplantCenter,theFirstAffiliatedHospitalofSunYat-senUniversity,3.InstituteofClinicalPharmacology,SunYat-senUniversity,Guangzhou510080,China;4.ReproductiveCenter,theSixthAffiliatedHospitalofSunYat-senUniversity,Guangzhou510655,China)
Aim To investigate the impact of CYP3A5 genetic polymorphism on modified releasing tacrolimus pharmacokinetics in Chinese stable renal transplant recipients.Methods Pharmacokinetics of once daily-tacrolimus(tac-q.d.) and twice daily-tacrolimus(tac-b.i.d.) were determined by CLIA, CYP3A5 genotype was measured by PCR-RFLP. Each 10 patients receiving tac-q.d. and tac-b.i.d. respectively were enrolled, and each 5 patients receiving tac-q.d. were matched to poor metabolizer (PM) and extensive metabolizer (EM) group respectively according to CYP3A5 genotypes.Results AUC0~24 hfor tac-q.d. was 1.78 folds higher than AUC0~12 hfor tac-b.i.d., and dose-adjustedC0was 40% lower for tac-q.d. than for tac-b.i.d. There were no significant differences for other parameters between the two groups;Cmax, AUC0~24 handC0were 1.75, 1.96 and 2.49 folds higher for PM than for EM, and dose-adjustedCmax,AUC0~24 handC0were 1.80, 2.34 and 2.64 folds higher for PM than for EM. There were good correlations between AUC0~24 handC0for tac-q.d.Conclusion Conversion from tac-b.i.d. to tac-q.d. results in requirement of increased tacrolimus dose and detection of CYP3A5 genotype, which is necessary for ensuringC0in the range of therapeutic window.
tacrolimus; modified release; renal transplantation; CYP3A5; pharmacokinetics;genetic polymorphism; immunosuppressant
2016-07-12,
2016-08-05
国家自然科学基金资助项目(No 81503156);广东省自然科学基金博士启动项目(No 2014A030310096);广东省公益基金项目(No 2016A020218006)
陈 攀(1985-),男,博士,主管药师,研究方向:临床药学,E-mail:cepa1@163.com;
王长希(1963-),男,博士,主任医师,教授,研究方向:器官移植,通讯作者,E-mail:13600450862@163.com
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.042.html
10.3969/j.issn.1001-1978.2016.11.021
A
1001-1978(2016)11-1592-04
R345.99;R392.2;R394.2;R699.2;R969.1;R944.9;R979.5

