何首乌中大黄素对L02肝细胞CYP亚酶表达及细胞毒性的影响
汪美汐,王宇光,徐焕华1,,张照研,马增春,肖成荣,谭洪玲,汤响林,高 月
(1. 广东药科大学研究生学院, 广东 广州 510006;2. 军事医学科学院放射医学研究所药理毒理研究室,北京 100850)
何首乌中大黄素对L02肝细胞CYP亚酶表达及细胞毒性的影响
汪美汐1,2,王宇光2,徐焕华1,2,张照研2,马增春2,肖成荣2,谭洪玲2,汤响林2,高 月1,2
(1. 广东药科大学研究生学院, 广东 广州 510006;2. 军事医学科学院放射医学研究所药理毒理研究室,北京 100850)
目的 研究何首乌中大黄素(emodin)对L02肝细胞CYP450酶主要亚型表达的影响,探讨其对L02肝细胞的细胞毒性机制。方法 不同浓度的Emodin处理L02细胞,通过MTS法检测细胞的存活率,测定LDH释放率评价细胞损伤程度,Real time PCR法检测Emodin各给药组CYP450酶亚型mRNA表达的变化。结果 MTS结果显示,随着Emodin浓度的增加,呈现明显的细胞损伤效应,细胞的存活率逐渐降低并呈现浓度和时间依赖性;同时,LDH释放率在给药48 h时相比于空白组均明显增高。在基因水平上,与空白组相比,Emodin能明显提高CYP450各亚型mRNA表达,并可剂量依赖性诱导CYP1A1、CYP1B1的表达。结论 何首乌中大黄素对人正常肝细胞具有明显损伤作用,并能诱导CYP450酶mRNA表达。
何首乌;大黄素;CYP450;肝损伤;L02肝细胞;ABT;mRNA表达
何首乌为蓼科植物何首乌(PolygonummultiflorumThunb.)的干燥块根,被广泛应用于临床上治疗脱发、高血压、高血脂等多种疾病[1]。大黄素(emodin)作为何首乌中的主要蒽醌类成分,具有广泛的药理学作用,包括抗癌、抗菌消炎作用,对肝癌、肺癌、鼻咽癌、乳腺癌等的治疗作用都有相关研究报道。但是,随着对何首乌的临床应用和对中药安全性的认识日益深入,国内外相继出现了关于何首乌致肝损伤的相关临床病例报道,其安全性问题引起了国内外学者的高度关注。目前,普遍认为何首乌的肝损伤作用主要与其所含蒽醌类成分有关[2],如大黄素、大黄酸。细胞色素P450作为重要的药物代谢酶,主要分布于肝、肾等组织器官中,参与90%以上临床药物的代谢,当其活性受到抑制或诱导时,易发生不良反应[3],如四氯化碳或醋氨酚(扑热息痛)可被细胞色素 P450 酶系代谢成有毒代谢物从而损伤细胞。因此,探讨药物对CYP 的作用,对阐述中药的毒性作用具有重要意义。基于此,为了进一步研究何首乌致肝损伤机制,本研究将从药物代谢酶角度,探讨何首乌中大黄素对L02肝细胞CYP450酶主要亚型表达的影响及其对L02肝细胞的毒性作用。
1 材料与方法
1.1 试剂与药品 Emodin购自上海一飞生物科技有限公司(批号:E054323);1-氨基苯并三唑(1-aminobenzotriazole,ABT)购自美国Sigma-Aldrich公司(批号:95M4156V);RPMI 1640培养基(Gibco)和血清(FBS)(Hyclone);胰酶(Sigma);MTS 试剂盒(Promega);LDH试剂盒(普利莱基因技术有限公司);TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix和TransStart®Green qPCR SuperMix(北京全式金生物技术有限公司)。
1.2 仪器 细胞培养箱(美国Thermo);超净工作台(北京长城空气净化设备公司,SW-CJ-1F型);倒置显微镜(日本Nikon 120 型);酶标仪(美国Perkin Elmer,PE Victor X5型);PCR仪(Gene Amp 2400);精密电子天平(德国Sartorius,BS110S);StepOne PlusTMReal Time PCR(美国Applied Biosystems,StepOne PlusTM272006169) 。
1.3 细胞培养 L02细胞为人正常肝细胞,来源于人肝脏上皮细胞(购自上海中乔新舟),在 37℃、5% CO2的条件下,培养于含有10%胎牛血清的RPMI 1640培养基中,待细胞密度长至80%~90% 时,按1 ∶2的比例进行传代,平均2~3 d传一代,取对数生长期细胞进行实验。
1.4 Emodin母液配制 精确称取Emodin 10.80 mg,溶解于DMSO中,使其终浓度为100 mmol·L-1,用枪头缓慢吹打混匀;分装至200 μL EP管中,标记清楚并用封口膜密封,-20℃冰箱保存备用。
1.5 MTS法检测L02细胞活力 取对数生长期的L02细胞以2×104个/孔密度接种于96 孔培养板(空白孔不种细胞) ,每孔200 μL,37℃、5% CO2培养24 h。实验分为空白组、给药组(浓度依次为0.5、5、10、25、50、100、200、300 μmol·L-1)和阴性对照组,分别培养24、48 h后,弃去培养基,向每孔加100 μL空培养基及20 μL MTS溶液,置于培养箱中继续孵育1 h。用酶标仪测定在490 nm处的吸光度值(OD),按以下公式计算细胞存活率。
细胞存活率(IC)/%=(实验组OD值-空白组OD值)/(阴性对照组OD值-空白组OD值)×100%
1.6 乳酸脱氢酶(LDH)比色法检测L02细胞损伤 取对数生长期的L02细胞,以2×104个/孔密度接种于96 孔培养板(空白孔不种细胞),每孔200 μL,37℃、5% CO2培养24 h。实验分为空白组、给药组(浓度依次为3.125、6.25、12.5、25、50、100、200 μmol·L-1)和阴性对照组,分别培养24、48 h后,按照LDH试剂盒操作说明进行实验,LDH释放率计算如下:细胞LDH释放率/%=细胞培养基中测定的酶活力单位/(细胞裂解液测定的酶活力单位+细胞培养基测定的酶活力单位)×100%
1.7 ABT对细胞活力的影响 对于细胞CYP450抑制性实验,取对数生长期的L02细胞,以2×104个/孔密度接种于96 孔培养板(空白孔不种细胞) ,培养24 h后,去培养基,加入CYP450非特异性抑制剂ABT(1 mmol·L-1),孵育1 h后给药(浓度依次为1.5625、3.125、6.25、12.5、25、50、100、200 μmol·L-1),培养24、48 h后,采用MTS法检测L02细胞活力,具体操作方法同“1.5”。
1.8 Real time PCR测定L02细胞CYP450 mRNA表达水平 根据MTS实验结果,将实验分为空白对照组、给药组(浓度依次为2.5、5、10、20 μmol·L-1),分别接种于6孔板中,37℃、5% CO2培养16 h后,取各处理组L02细胞,采用TRIzol 试剂提取细胞总RNA,紫外分光光度计测定RNA样本纯度(A260/A280)在1.8~2.0之间,表示总RNA片段完整未降解可用。按照TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix操作说明进行逆转录反应合成cDNA ,42℃ 15 min,85℃ 5 s。 ABI StepOne PlusTMReal Time PCR测定CYP450各亚型mRNA基因表达水平,采用2-(△△Ct)方法进行分析[4-5]。特异性引物序列见Tab 1。
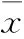

Tab 1 Sequences of primers used for real-time reverse transcription(RT-PCR) analysis
2 结果
2.1 Emodin对L02细胞活力的影响 以不同浓度Emodin处理L02细胞24、48 h以后,MTS法测定各给药组细胞存活率,结果显示,随着Emodin给药浓度的增加,细胞的存活率逐渐下降。低浓度条件下对细胞的存活率没有影响。测定结果采用GraphPad Prism 5软件拟合计算IC50值(Fig 1) 。
2.2 LDH比色法检测L02细胞损伤 对各给药组细胞的LDH进行测定,结果显示,不同浓度Emodin处理L02细胞24 h时,LDH释放率无明显变化,而给药处理48 h后,随着给药浓度的升高,LDH的释放率呈增大趋势(Fig 2),再一次验证了Emodin致细胞毒性具有一定的时间和剂量依赖性,与MTS结果相一致。
2.3 ABT对细胞活力的影响 ABT(1 mmol·L-1)为CYP450酶非特异性抑制剂,ABT处理细胞可有效降低细胞内药物代谢酶活性。结果显示,ABT处理以后能明显增加Emodin对L02细胞的毒性,使其IC50值由12.62 μmol·L-1降低至11.64 μmol·L-1(Fig 3)。结果提示CYP酶的活性变化与Emodin细胞毒性密切相关,诱导I相药物代谢酶代谢可以一定程度上降低Emodin的细胞毒性作用。

Fig 1 Effect of emodin on cell viability of L02 ±s)

Fig 2 Effect of emodin on LDH release rate of L02 ±s)
2.4 Emodin对L02细胞P450酶mRNA表达的影响 Emodin对L02细胞CYP450酶各亚型 mRNA 表达的影响如Fig 4所示,与空白组相比,Emodin对CYP450酶各亚型mRNA总体上均表现出不同程度的上调作用,且在低浓度处理条件下,对CYP2E1、2B6、1A2、2D6、7A1表现出较强的诱导作用,其强弱依次为CYP2E1>2B6>7A1>1A2>2D6,而对CYP2C9、3A4表现出一定的抑制作用。同时,结果显示Emodin对CYP1A1、CYP1B1呈现剂量依赖性诱导作用。
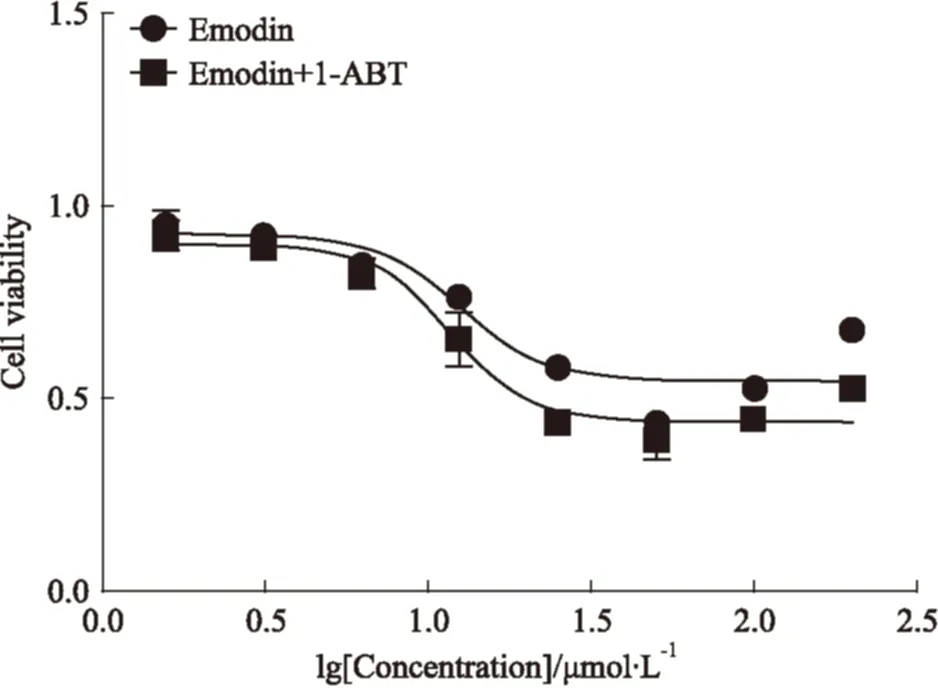
Fig 3 Effect of nonspecific CYPs inhibitors ABT on cytotoxicity of ±s)
3 讨论
随着中医药研究的发展,中药在临床上的应用越来越广泛。何首乌作为常用补益中药,来源于蓼科植物何首乌的干燥块根,具有解毒消痈、润肠通便的作用,临床主要用于补肝肾、益精血、乌须发、强筋骨[2]。自古以来,何首乌更是被认为是延年益寿、治疗须发早白的良药,并常年服用,但因此导致的药物性肝损伤常被忽视。人们通常认为西药会导致较大的副作用,而中药十分安全,不存在副作用。实际上,与西药比较,中草药较温和,用药时往往不太注意剂量和用法。随着近年来何首乌及其制剂的广泛应用,国内外关于何首乌引起肝损伤的不良反应报道时有出现,因此如何正确使用何首乌,了解其肝损伤机制,避免不良反应的发生,是医药工作者亟待解决的问题。目前,人们普遍认为中药引起肝损伤涉及很多损伤机制,主要包括细胞色素P450、细胞凋亡、氧化应激及免疫功能异常等,然而具体机制尚不明确。因此,加强其发病机制的研究显得非常重要。
药物性肝损伤(drug-induced liver injury,DILI)是指药物在使用过程中,因药物本身或其代谢物或由于特殊体质对药物的超敏感性或耐受性降低所导致的肝脏损伤[6]。作为急性或慢性肝脏疾病的重要诱因之一,DILI引发肝脏损伤的主要方式有两种,一种是由药物及其中间产物对肝脏的直接毒性作用;另外一种是机体对药物的特异质肝毒性。越来越多的的研究表明,何首乌中的大黄素虽然具有潜在的广泛药用价值,如抗菌消炎、抗肿瘤、免疫抑制等,但需要关注的是,何首乌中的大黄素是一把双刃剑,对机体具有双重作用。现代药理研究报道,大黄素作为何首乌中主要的蒽醌类化合物[7],是造成 DILI 的主要原因之一。所以,从大黄素入手探讨其DILI的机制显得非常必要。研究发现[8-10],大黄素能引起F344/N大鼠和B6C3F1小鼠肾小管损伤及肝细胞病变,低浓度大黄素短时间作用于细胞时,对细胞生长有促进作用,而随着浓度的增加其对细胞的损伤增大,抑制率增加,细胞可见典型凋亡形态,G1期细胞所占比例明显减小,S期、G2期比例增加,凋亡率达19.8%;而在大剂量大黄素给药时,可以造成大鼠肝损伤,其损伤可能与机体氧化应激有关。此外,何首乌中的大黄素还能刺激肠道,引起肠道充血炎症,导致恶心、呕吐、腹痛、腹泻,服用过量可促进神经兴奋,增加肌肉时值,使肌肉麻痹,导致神经紧张、烦躁不安、心动过快、呼吸困难、痉挛抽搐、循环衰竭、呼吸麻痹等症状。同时,美国“国家毒理学规划(NTP)”也研究发现,长期服用大黄素可致大鼠肾小管透明小滴生成,诱发肾病和肾小管色素沉积等。 细胞色素P450混合功能氧化酶系[11](cytochrome P450,CYP450),是由血红素-巯基盐蛋白所组成的超家族,主要存在于生物体的内质网内,既可以代谢内源性物质,如甾体激素、维生素及类花生四烯酸类化合物等,又可以代谢外源性物质,在药物代谢中起主要作用的为CYP1、CYP2及CYP3家族。由CYP450酶系作用的生物转化是生物体代谢的重要环节,多种内、外源性化学物对CYP450有诱导或抑制作用,导致酶的数量和活性改变,并引起自身或其他药动学的改变,使药物活性代谢成分积累导致毒性增强,或降低其血药浓度和治疗效果。因此,从药物代谢酶的角度研究何首乌中大黄素活性单体,有利于从分子水平探讨其肝损伤机制。大量体内研究表明[12],大黄素能够引起大鼠肝脏微粒体总CYP450明显升高,可轻度诱导CYP3A、CYP1A、CYP2E1和CYP2B酶。本研究从细胞水平上,考察大黄素对L02肝细胞CYP450酶主要亚型表达的影响,探讨其对肝损伤的作用机制。

Fig 4 Effect of emodin on CYP450 gene expression of L02 ±s,n=3)
实验结果显示,大黄素对肝脏多种CYP450 酶具有诱导作用。不同给药剂量下,大黄素均能够诱导L02肝细胞CYP450酶亚型2E1、2B6、1A2、3A4、2C9、2D6、7A1 mRNA表达,其强弱依次为CYP2E1>2B6>7A1>1A2>2D6>3A4>2C9。同时,qPCR结果显示,大黄素对CYP1A1、CYP1B1表现出较好的剂量依赖性诱导作用。CYP1A1作为CYP1A家族的主要成员,参与氧化应激过程中还原型辅酶II 依赖的电子转移通路,参与氧化一系列结构无关的化合物,如类固醇、脂肪酸和外源化合物[13],因此被视为致癌物代谢酶。以往研究发现大黄素的肾毒性与其对CYP1A1的诱导有关,为大黄素致肝肾毒性提供了进一步研究的线索。本研究在mRNA水平上初步探究了大黄素致肝损伤的发生机制,发现其能明显诱导CYP1A1 mRNA的表达,从而推测其肝损伤机制可能是通过诱导酶活性,将许多底物活化,进一步诱导氧化应激和肝脏毒性。同时,临床上何首乌致肝损伤多表现为肝细胞损伤和胆汁淤积性肝损伤,这也提示我们大黄素能明显诱导CYP7A1 mRNA的表达可能与胆汁酸分泌增加有关,进而导致产生胆汁淤积型肝损伤。
综上所述,本文在药物代谢酶水平上对何首乌中大黄素致肝损伤机制进行了初步探究,发现了大黄素对CYP1A1、CYP1B1具有明显诱导作用,对于临床用药,避免药物相互作用具有指导意义。同时,本文从CYP450酶角度发现了酶的变化可以影响其细胞毒性,为进一步深入研究提供了线索,需要从多个角度如吸收、分布及排泄等各个环节入手,综合探讨何首乌致肝损伤作用机制,从而为其临床合理、科学使用提供可靠的依据。
(致谢:本实验在军事医学科学院放射与辐射医学研究所药理毒理研究室完成,感谢各位老师对本实验的帮助与指导。)
[1] Bounda G A,Feng Y U. Review of clinical studies ofPolygonummultiflorumThunb. and its isolated bioactive compounds[J].PharmacognosyRes,2015,7(3):225-36.
[2] Lin L, Ni B, Lin H, et al.Traditional usages, botany, phytochemistry, pharmacology and toxicology ofPolygonummultiorumThunb.: a review[J].JEthnopharmacol,2015,159:158-83.
[3] 廖乃顺,陈文列.细胞色素氧化酶 P450 家族在中药毒性研究中的应用进展[J].中国药理学与毒理学杂志,2012,26(3):402-5.
[3] Liao N S,Chen W L.Progress in cytochrome P450 enzyme in toxicity of traditional Chinese medicines[J].ChinJPharmToxicol,2012,26(3):402-5.
[4] 胡东华,王宇光,陈志武,等.三七总皂苷对H9c2细胞P450酶mRNA表达的影响[J].中国药理学通报,2013,29(11) : 1563-7.
[4] Hu D H,Wang Y G,Chen Z W,et al.Effect of Panax notoginseng saponin on cytochrome P450 mRNA expression in H9c2 cell[J].ChinPharmacolBull,2013,29(11):1563-7.
[5] 马增春,肖 勇,赵佳伟,等.人参皂苷Re对H9c2心肌细胞CYP450酶的影响[J].中国药理学通报,2016,32(4): 494-8.
[5] Ma Z C, Xiao Y, Zhao J W,et al. Effect of ginsenoside Re on cytochrome P450 in H9c2 cells[J].ChinPharmacolBull,2016,32(4):494-8.
[6] 呼 丹,刘 悦,樊 星,等. 药物性肝损伤研究概述[J].国际药学研究杂志,2014,41(2):164-8.
[6] Hu D, Liu Y, Fan X, et al.Drug-induced liver injury: a brief overview[J].JIntPharmRes,2014,41(2):164-8.
[7] Li C L,Ma J, Zheng L, et al.Determination of emodin in L-02 cells and cell culture media with liquid chromatography-mass spectrometry: application to a cellular toxicokinetic study[J].JPharmBiomedAnal,2012,71:71-8.
[8] 张 斌,丁慎华,钱雪梅,朱薇珊. 大剂量大黄素致大鼠肝损伤及其机制的初步研究[J].中国现代医学杂志,2015,25(35):18-21.
[8] Zhang B, Ding S H, Qian X M, Zhu W S.Mechanism of liver injury induced by high-dose emodin in rats[J].ChinaJModMed,2015,25(35):18-21.
[8] 卫培峰,胡锡琴,严爱娟.何首乌所致不良反应概况[J].陕西中医,2004,25(2):170-1.
[9] Wei P F, Hu X Q, Yan A J.Research on adverse reaction induced byPolygonummultiflorum[J].ShanxiJTraditChinMed,2004,25(2):170-1.
[10]关翠雯,金 晶,朱少华,等.大黄素诱导人肾上皮HK-2 细胞凋亡及内质网应激的介导作用[J].中草药,2013,44(12):1621-7.
[10]Guan C W, Jin J, Zhu S H,et al. Induction of apoptosis in human renal tubular epithelial HK-2 cells by emodin and mediation of endoplasmic reticulum stress[J].ChinTraditHerbalDrugs,2013,44(12):1621-7.
[11]谢瑞芳,周 昕.中药对细胞色素P450代谢影响的研究进展[J].中国临床药理学与治疗学,2009,14(6): 697-701.
[11]Xie R F, Zhou X.Research progress on traditional Chinese medicine affecting the metabolism of cytochrome P450[J].ChinJClinPharmacolTher,2009,14(6): 697-701.
[12]王青秀, 雷荣辉, 徐志宏, 等.大黄素对大鼠肝脏CYP450 酶的诱导研究[J].药物评价研究, 2015, 38(2): 147-50.
[12]Wang Q X, Lei R H, Xu Z H,et al.Induction of cytochrome P450 enzymes by emodin in liver tissue of rats[J].DrugEvalRes, 2015, 38(2):147-50.
[13]Go R E, Hwang K A, Choi K C. Cytochrome P450 1 family and cancers[J].JSteroidBiochemMolBiol,2015,147:24-30.
Effects of emodin inPolygonummultiflorumon liver cytotoxicity and CYP450 isoenzymes expression in L02 cells
WANG Mei-xi1,2,WANG Yu-guang2,XU Huan-hua1,2,ZHANG Zhao-yan2,MA Zeng-chun2,XIAO Cheng-rong2,TAN Hong-ling2,TANG Xiang-lin2,GAO Yue1,2
(1.GraduateSchoolofGuangdongPharmaceuticalUniversity,Guangzhou510006,China;2.BeijingInstituteofRadiationMedicine,AcademyofMilitaryMedicalSciences,Beijing100850,China)
Aim To study the effect of emodin inPolygonummultiflorumon the expression of CYP450 isoenzymes in L02 hepatocytes and explore its mechanism of cytotoxicity.Methods L02 cells were treated with different concentrations of emodin. Cell viability was examined by MTS assay kit, and cell membrane injury was examined by detecting the release rate of lactate dehydrogenase(LDH). The expression of cytochrome P450 mRNA was detected by real time PCR.Results The result of MTS assay showed that L02 cells viability was significantly reduced following exposure to emodin in a concentration and time dependent manner. The LDH release rate of L02 cells significantly increased after exposure to emodin for 48 h compared with the control group. On the mRNA level,compared with the control group,emodin had inductive effects on mRNA of each CYP450 enzyme,while had significant inductive effects on mRNA of CYP1A1 and CYP1B1 in a concentration and time dependent manner.Conclusion Emodin inPolygonummultiflorummay generate significant liver injury in L02 cells and has inductive effects on CYP450 enzyme activity.
PolygonummultiflorumThunb.;emodin;CYP450;liver injury;L02 cells;ABT;mRNA expression
2016-07-04,
2016-08-08
北京市自然科学基金资助项目(No 7164291);国家科技重大专项(No 2015ZX09501004-003-003);国家重点基础研究发展计划(973计划)资助项目(No 2011CB505300, 2011CB505304)
汪美汐(1993-),女,硕士生,研究方向:新药发现与中药药理学,E-mail:wangmx93@163.com;
高 月(1963-),女,博士,研究员,研究方向:中药药理学,通讯作者,E-mail:gaoyue@nic.bmi.ac.cn;
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.026.html
10.3969/j.issn.1001-1978.2016.11.013
A
1001-1978(2016)11-1543-06
R322.47 ;R284.1;R345.99;R575.02.2 ;R977.3
王宇光(1979-),男,博士,副研究员,研究方向:中药药理学,通讯作者,E-mail:wyg79@139.com

