回顾性分析氯吡格雷弱代谢患者的抗血小板治疗现状
刘 娜,张抗怀*,董 新,王海涛
(1.西安交通大学第二附属医院药学部,西安 710004;2. 西安交通大学第二附属医院心内科,西安 710004)
回顾性分析氯吡格雷弱代谢患者的抗血小板治疗现状
刘 娜1,张抗怀1*,董 新2,王海涛1
(1.西安交通大学第二附属医院药学部,西安 710004;2. 西安交通大学第二附属医院心内科,西安 710004)
目的 筛查氯吡格雷弱代谢型急性冠脉综合征患者,回顾性分析其抗血小板治疗现状。方法 选取医院收治的285例陕西汉族急性冠脉综合征患者,通过焦磷酸测序技术检测CYP2C19*2和CYP2C19*3基因多态性筛查氯吡格雷弱代谢患者,分析其抗血小板治疗现状。结果 在285例患者中,快代谢型占38.6%,中间代谢型占49.1%,慢代谢型占12.3%,后两者为弱代谢型(61.4%)。中间代谢型患者,53.6%应用氯吡格雷75 mg·d-1;46.4%调整治疗方案,如氯吡格雷剂量加倍至150 mg·d-1,更换替格瑞洛或三联疗法(加用西洛他唑)。慢代谢型患者,54.3%应用氯吡格雷75 mg·d-1,45.7%调整为上述治疗方案,其中28.5%更换替格瑞洛。结论 在陕西汉族急性冠脉综合征患者中,氯吡格雷弱代谢型发生率高,目前个体化抗血小板治疗方案并无统一规范。
氯吡格雷;弱代谢型;急性冠脉综合征;抗血小板治疗
A.stract:Objective To identify the clopidogrel poor metabolizers with acute coronary syndrome (ACS) and to retrospectively analyze the antiplatelet therapy status. Methods 285 Shaanxi Han Chinese with (ACS) in the hospital were enrolled in this study. The pyrophosphate sequencing technology was used to detect CYP2C19*2 and CYP2C19*3 gene polymorphism. Antiplatelet therapy status of clopidogrel poor metabolizers with ACS was analyzed. Results The rapid,intermediate and slow metabolizers were respectively 38.6%, 49.1% and 12.3%. The intermediate and slow metabolizers were regarded as clopidogrel poor metabolizers(61.4%). About 53.6% clopidogrel intermediate metabolizers were given conventional dose of clopidogrel (75 mg·d-1) ,46.4% cases were applied the adjusted treatment plans including doubling dosage of clopidogrel (150 mg·d-1),replacement drugs (such as ticagrelor) or triple antiplatelet therapy (adding cilostazol). For clopidogrel slow metabolizers,54.3% cases were still given conventional dose of clopidogrel (75 mg·d-1),45.7% patients were administered the adjusted treatment plans as mentioned above,28.8% of patients with replacement of ticagrelor.Conclusion The incidence of clopidogrel poor metabolizers is high in Shaanxi Han Chinese population with ACS. There is no uniform standard that individualized antiplatelet treatment of clopidogrel poor metabolizers.
氯吡格雷是急性冠脉综合征患者抗血小板治疗的基础用药[1],给予常规剂量氯吡格雷治疗患者依从性良好,但部分患者血小板活性不能达到有效抑制或发生不良心血管事件,即氯吡格雷抵抗现象。临床研究证实,氯吡格雷疗效存在明显个体差异,CYP2C19基因多态性是影响氯吡格雷疗效的重要内因[2-3]。CYP2C19功能缺失可能引起氯吡格雷活性代谢物生成减少、抗血小板作用减弱、心血管缺血事件发生风险增加[4]。2010年美国FDA警告:提醒医生通过CYP2C19基因检测判断CYP2C19功能;对氯吡格雷代谢不良者,建议增加氯吡格雷剂量或应用其他抗血小板药物。本研究拟根据CYP2C19基因型判断急性冠脉综合征患者的氯吡格雷代谢能力,回顾性分析氯吡格雷弱代谢患者的抗血小板治疗现状。
1 仪器与材料
1.1 仪器 HFsafe1200生物安全柜(上海力申科学仪器有限公司);TC-96/G/H(b)A PCR扩增仪(杭州博日科技有限公司);PyroMark Q24焦磷酸测序仪(德国凯杰QIAGEN生物公司)。
1.2 材料 全血基因组DNA提取试剂盒(HiPure Blood DNA Mini Kit,Lot EE040100)和PCR反应体系试剂[包括PCR Buffer(Lot AB7201A)和dNTP Mixture(Lot BK1201A)]及焦磷酸测序SNP通用试剂盒 (PyroMark Gold Q96 Reagents,Lot 154012213)均购于广州美基生物科技有限公司。抗生物素蛋白链菌素磁珠(Streptavidin Sepharose Beads,Lot 10235656),购自德国凯捷生物科技有限公司。
2 资料与方法
2.1 研究对象 选取2013年10月~2014年10月收住于医院心内科的285例急性冠脉综合征患者,在医院药学部基因检测室开展CYP2C19*2和CYP2C19*3的基因多态性检测[5]。
入选标准: 陕西汉族,年龄大于18岁,冠脉造影诊断为急性冠脉综合征,具有使用阿司匹林和氯吡格雷进行抗血小板治疗的指征,无其他心血管疾病的患者。入选患者均签署书面知情同意书。试验方案经医院伦理委员会批准。
排除标准:抗血小板治疗禁忌证患者;对阿司匹林及氯吡格雷过敏或不耐受者; 严重肝肾疾患者;凝血功能障碍者;半年内有卒中或出血性疾病患者;近期拟行外科手术者以及其他介入治疗禁忌证者。
2.2 研究方案 采用焦磷酸测序技术结合系统回顾法,对氯吡格雷弱代谢型急性冠脉综合征患者的抗血小板治疗方案进行分析与评价。编制调查表,内容包括性别、年龄、CYP2C19基因型、氯吡格雷代谢型、抗血小板治疗方案、吸烟、血小板计数和肝肾功能等。
2.3 焦磷酸测序法 检测CYP2C19*2(G681A)和CYP2C19*3(G636A)基因型。
2.3.1 人血标本DNA提取 采集患者外周静脉血2 mL(EDTA-2Na抗凝管),采用全血基因组DNA提取试剂盒提取DNA,提取结束后加入预热65 ℃洗出液150 μL溶解DNA,放置过夜,待用。
2.3.2 聚合酶链反应 设计并合成CYP2C19*2和CYP2C19*3扩增和测序的引物,按照如下条件进行PCR扩增:PCR体系50 μL。10×PCR反应缓冲液5 μL,三磷酸脱氧核糖核酸(dNTP)4 μL (各10 mmol·L-1),蒸馏水37.5 μL,正向引物和负向引物各0.5 μL (100 μmol·L-1),rTaq DNA多聚酶0.5 μL (5 u·μL-1),基因组 DNA 2.0 μL (20~30 μg·L-1)。PCR条件为94 ℃预变性10 min,变性、退火和延伸分别为 94 ℃ 30 s、55 ℃ 30 s和72 ℃ 45 s,共50个循环,最后72 ℃延伸7 min,在4 ℃保温。取扩增产物5 μL和缓冲液1 μL混匀,在20 g·L-1琼脂糖电泳,可获得清晰的扩增产物。
2.3.3 焦磷酸测序 ①测序引物退火缓冲液的配制:将10 μmol·L-1测序引物工作液1 μL加入24 μL退火缓冲液中,得到0.4 μmol·L-1测序引物退火缓冲液。测序板上每个孔加入测序引物退火缓冲液25 μL。②配制单链DNA分离液:2 μL磁珠和40 μL结合缓冲液,加高纯水18 μL配制成60 μL的单链DNA分离液。③PCR产物固定:每个PCR样本20 μL加入60 μL单链DNA分离液,在常温下剧烈振荡10 min,使得亲和素包被的磁珠与生物素标记的单链充分结合。④单链DNA模板的制备:在真空工作站中,1号位加入体积分数为70%的乙醇50 mL,2号位加入变性缓冲液40 mL,3号位加入洗液50 mL,4号位加入高纯水50 mL,5号位加入高纯水70 mL。将真空工具在6号位清洗15 s,移动到PCR板吸附磁珠15 s,依次在1,2和3号位清洗5,5 和10 s。⑤引物杂交:将真空工具真空阀关闭,放入含有测序引物的板中,充分摇动释放磁珠,在80 ℃杂交2 min,室温静置5 min冷却。⑥测序:使用焦磷酸测序仪和测序通用试剂盒,按照仪器和试剂说明书进行PCR产物的SNP位点的焦磷酸测序。

3 研究结果
3.1 CYP2C19*2和CYP2C19*3基因多态性检测结果 CYP2C19*2和CYP2C19*3 2个功能缺失突变位点具有重要意义,几乎能解释全部东亚人群氯吡格雷弱代谢型。研究检测结果见图1。测序结果:CYP2C19*2(GG,野生型)、CYP2C19*2(GA,突变杂合子型)、CYP2C19*2(AA,突变纯合子型)、CYP2C19*3(GG,野生型)、CYP2C19*3(GA,突变杂合子型)。
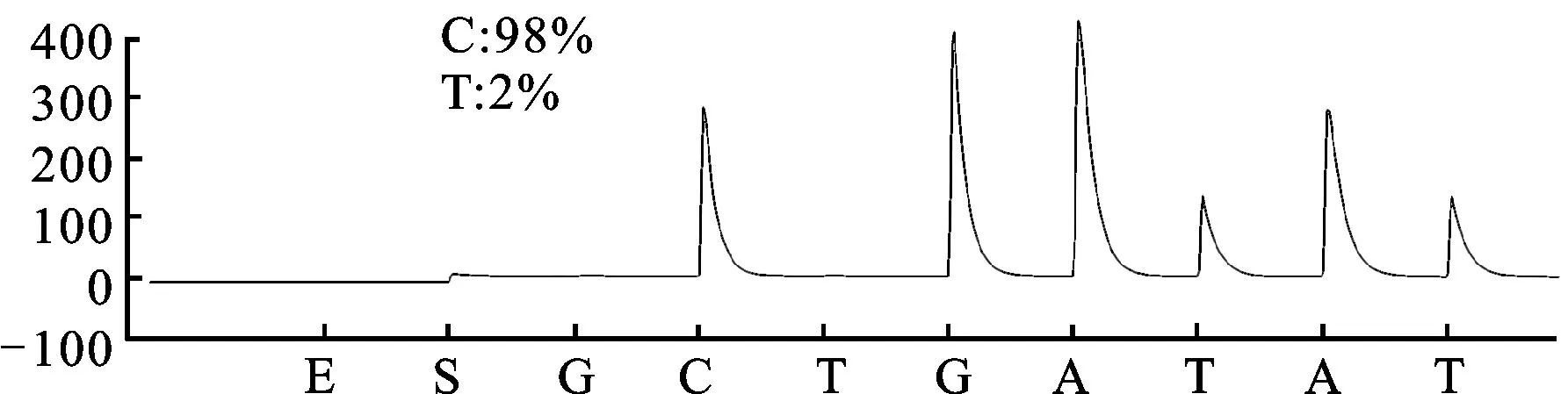
图1A.CYP2C19*2,G681A (测序结果:GG野生型)
Sequence of standard wild type target:TTCCCGGGAAC
Sequence of mutant type:TTCCCAGGAAC
Sequence of detection result:TTCCCGG
C2:CC/TGGGAAATAATCAATGA
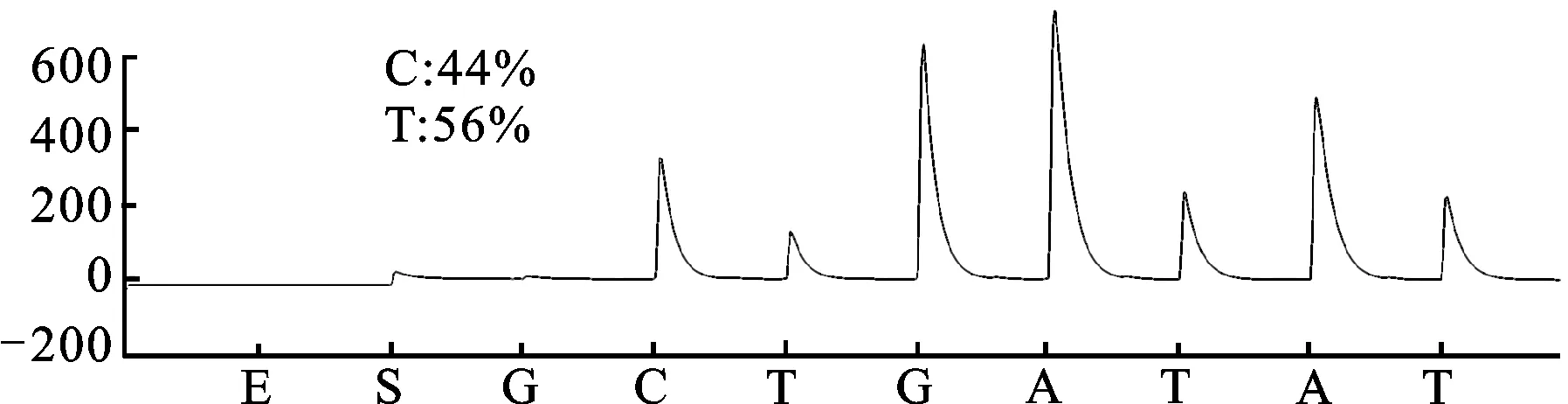
图1B.CYP2C19*2,G681A (测序结果:GA突变杂合子型)
Sequence of standard wild type target:TTCCCGGGAAC
Sequence of mutant type:TTCCCAGGAAC
Sequence of detection result: TTCCCG/AG
C1:CC/TGGGAAATAATCAATGA
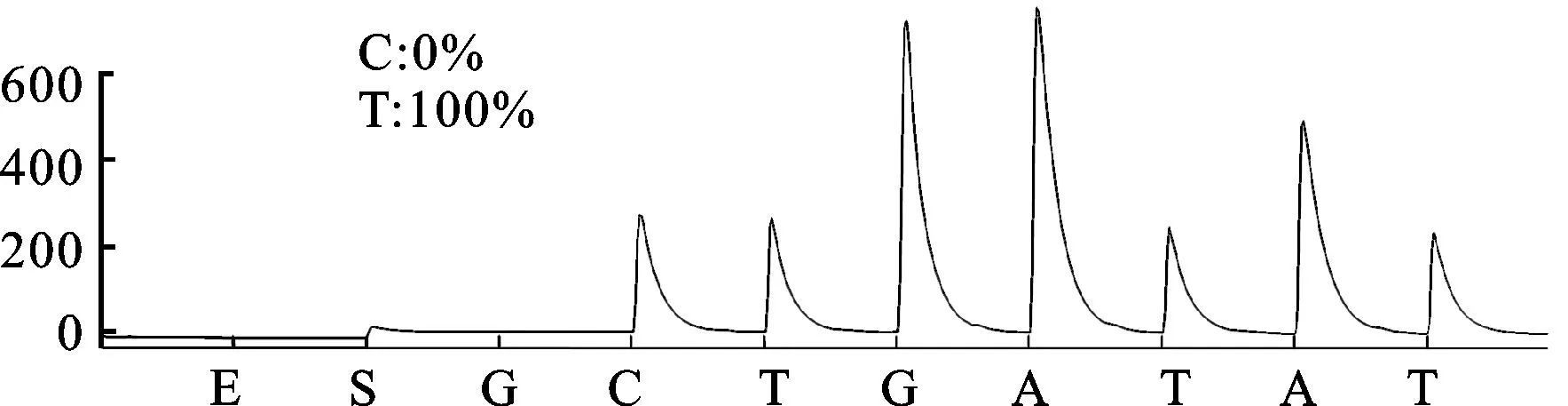
图1C.CYP2C19*2,G681A (测序结果:AA突变纯合子型)
Sequence of standard wild type target:TTCCCGGGAAC
Sequence of mutant type:TTCCCAGGAAC
Sequence of detection result: TTCCCAG
B2:CC/TGGGAAATAATCAATGA
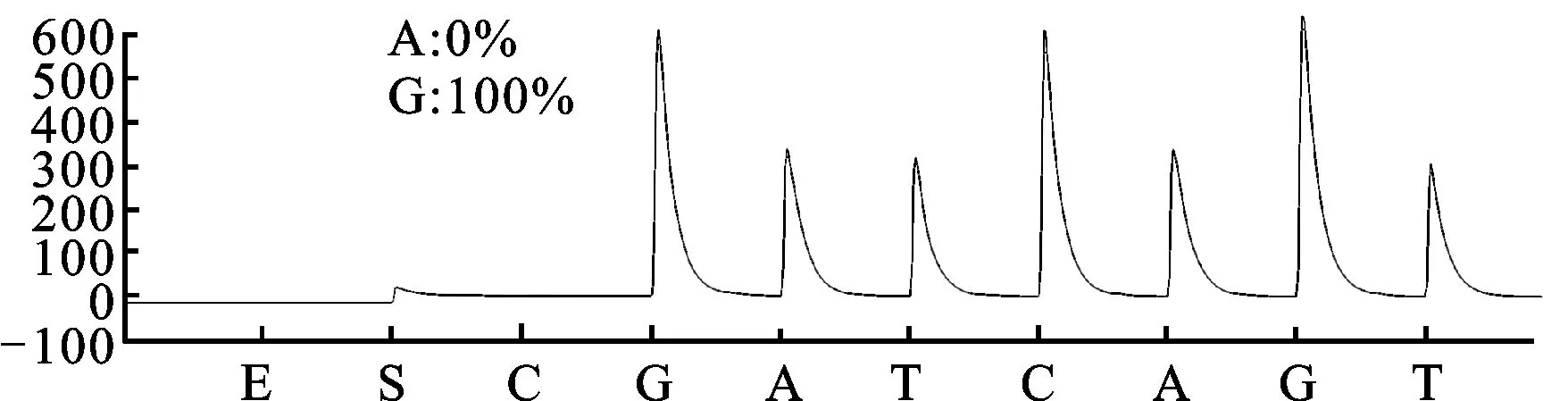
图1D.CYP2C19*3,G636A (测序结果:GG野生型)
Sequence of standard wild type target:CCCTGGATCCA
Sequence of mutant type:CCCTGAATCCA
Sequence of detection result:GGATCCA
C5: GG/AATCCAGGTAA
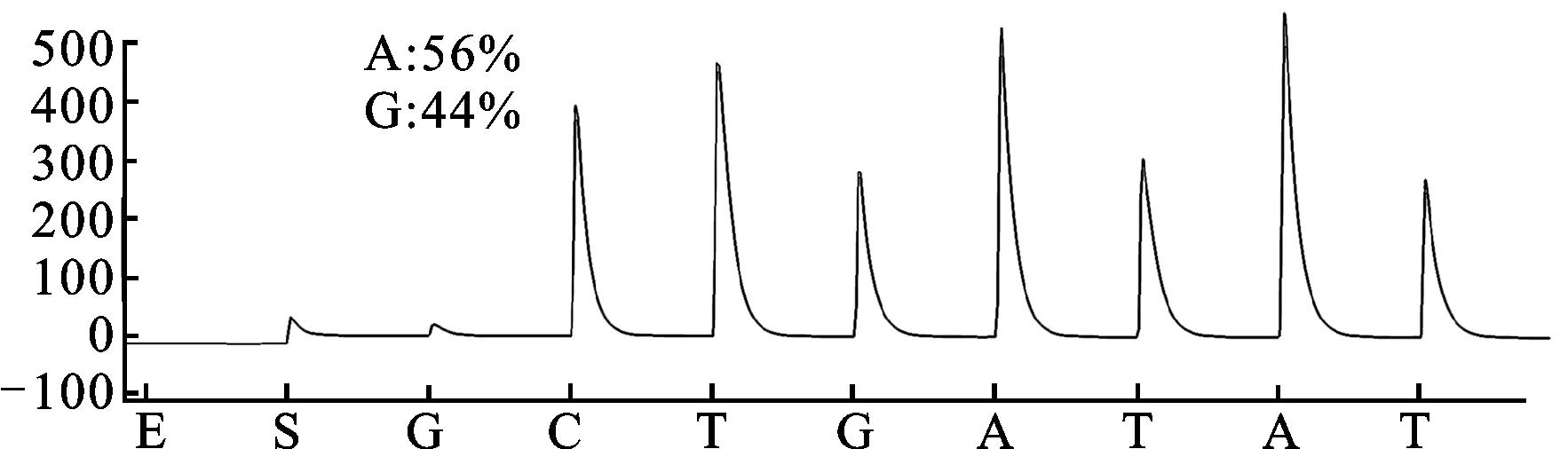
图1E.CYP2C19*3,G636A (测序结果:GA突变杂合子型)
Sequence of standard wild type target:CCCTGGATCCA
Sequence of mutant type:CCCTGAATCCA
Sequence of detection result:GG/AATCCA
A7:GG/AATCCAGGTAA
图1 CYP2C19*2和CYP2C19*3基因多态性检测结果
Fig.1 The detection results of CYP2C19*2 and CYP2C19*3 gene polymorphism
3.2 CYP2C19基因型及代谢型分布情况 CYP2C19基因型及代谢型之间存在对应关系,即野生型CYP2C19*1/CYP2C19*1(快代谢型)、突变杂合子CYP2C19*1/CYP2C19*2或CYP2C19*1/CYP2C19*3(中间代谢型)和突变纯合子CYP2C19*2/CYP2C19*2,CYP2C19*3/CYP2C19*3,CYP2C19*2/CYP2C19*3(慢代谢型)。CYP2C19基因多态性分布如图2A所示,CYP2C19*2突变最为常见,为51.2%,CYP2C19*3突变率为10.2%。如图2B所示,氯吡格雷弱代谢型(包括中间代谢型和慢代谢型)所占比例高达61.4%。3.3 氯吡格雷不同代谢型患者基线特征 在285例急性冠脉综合征患者中,男225例,女60例;最高年龄95岁,最低年龄33岁,平均年龄63岁。各组之间ALT、ALT、尿素氮、肌酐及血小板计数差异均无统计学意义,见表1。
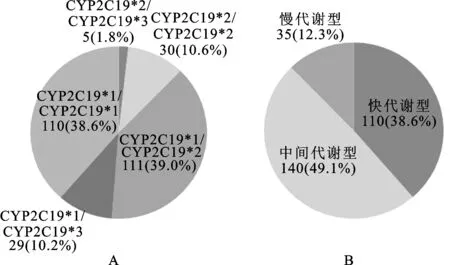
图2 CYP2C19基因多态性(A)及氯吡格雷代谢型(B)的分布特点
Fig.2 Distribution characteristics of CYP2C19 gene polymorphism (A) and clopidogrel metabolism (B)
表1 氯吡格雷不同代谢型患者的基线特征比较
Tab.1 Comparison of baseline characteristics in the different clopidogrel metabolism
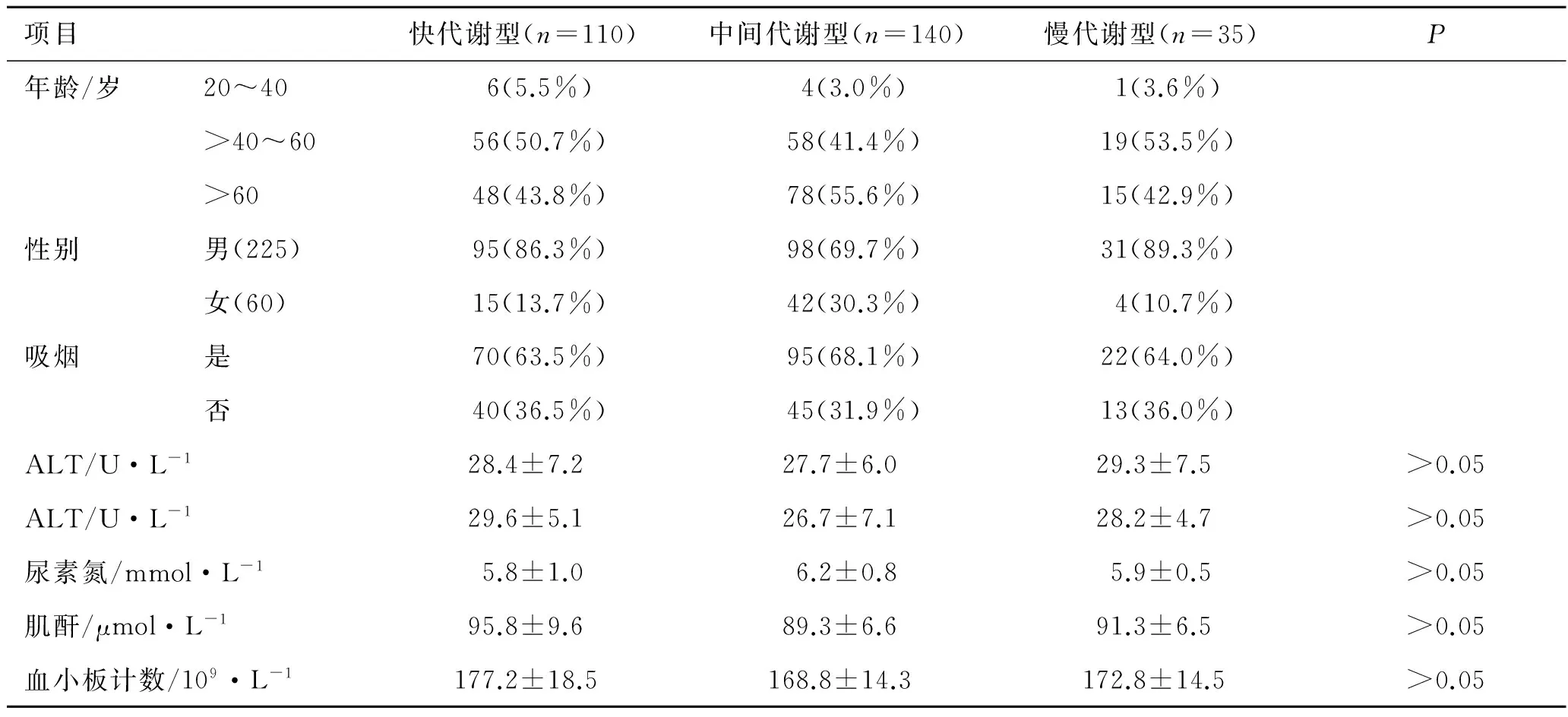
项目快代谢型(n=110)中间代谢型(n=140)慢代谢型(n=35)P年龄/岁20~406(5.5%)4(3.0%)1(3.6%)>40~6056(50.7%)58(41.4%)19(53.5%)>6048(43.8%)78(55.6%)15(42.9%)性别男(225)95(86.3%)98(69.7%)31(89.3%)女(60)15(13.7%)42(30.3%)4(10.7%)吸烟是70(63.5%)95(68.1%)22(64.0%)否40(36.5%)45(31.9%)13(36.0%)ALT/U·L-128.4±7.227.7±6.029.3±7.5>0.05ALT/U·L-129.6±5.126.7±7.128.2±4.7>0.05尿素氮/mmol·L-15.8±1.06.2±0.85.9±0.5>0.05肌酐/μmol·L-195.8±9.689.3±6.691.3±6.5>0.05血小板计数/109·L-1177.2±18.5168.8±14.3172.8±14.5>0.05
3.4 氯吡格雷弱代谢型患者抗血小板治疗方案分析 见图3,在140例中间代谢型患者中,约53.6% (75例)的患者未调整方案,可能存在抗血小板效果不理想或潜在心血管风险; 46.4%的患者采取氯吡格雷剂量加倍(23.6%)、更换替格瑞洛(12.8%)或三联疗法(10.0%)的调整方案。针对中间代谢型患者究竟采取哪种治疗方案治疗效果更优仍需进一步探讨。
由图3可知,在35例慢代谢型患者中,约54.3%(19例)仍采取常规治疗方案,预期心血管栓塞风险较高;约45.7%调整治疗方案包括氯吡格雷剂量加倍(8.6%)、更换替格瑞洛(28.5%)或三联疗法(8.6%)。目前认为更换替格瑞洛是慢代谢型患者的理想治疗方案,但仅有28.5%慢代谢型患者采取此方案。
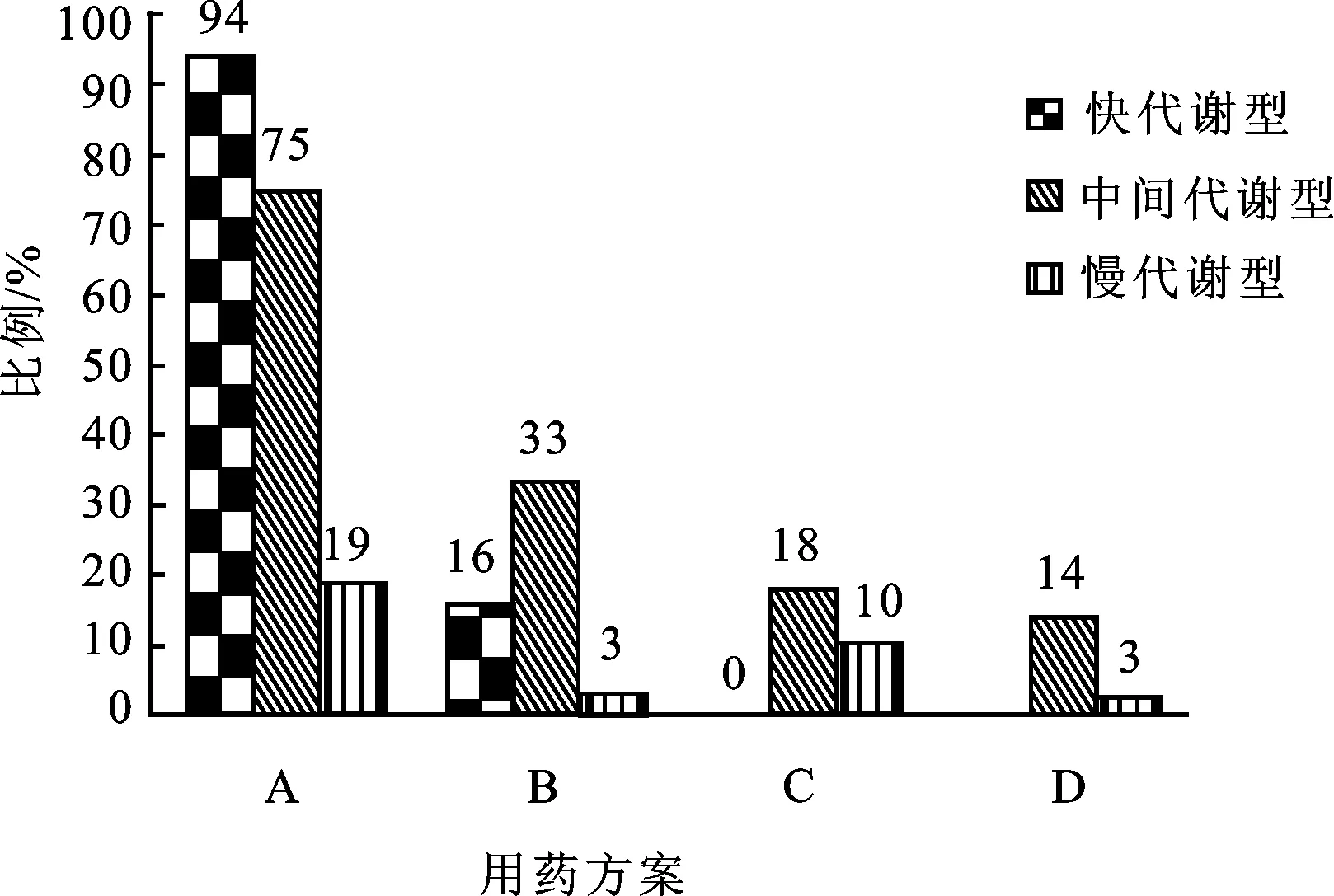
图3 氯吡格雷不同代谢型患者的抗血小板治疗现状
Fig.3 The present antiplatelet treatment situation of three different clopidogrel metabolism
A.阿司匹林+氯吡格雷(75 mg·d-1);B.阿司匹林+氯吡格雷(150 mg·d-1);C.阿司匹林+替格瑞洛(90 mg,bid);D.阿司匹林+氯吡格雷(75 mg·d-1)+西洛他唑(100 mg,bid)
4 讨论
CYP2C19基因型检测有助于筛查氯吡格雷弱代谢患者,并据此制定个体化抗血小板治疗方案。2010年ACCF/AHA专家共识提出氯吡格雷弱代谢型的应对策略[6]:可以考虑氯吡格雷剂量加倍,或换用普拉格雷、替格瑞洛等,或联合其他机制抗血小板药物如西洛他唑,并密切监测血小板抑制率。2011年一项针对心肌梗死和PCI术后1~4月患者研究表明[7],氯吡格雷加量3倍(225 mg)可有效提高CYP2C19*2杂合子患者的血小板抑制率,提示150 mg维持剂量是不够的。对于CYP2C19*2纯合子,即使氯吡格雷加量4倍(300 mg)也不能达到理想的血小板抑制水平,故在权衡出血风险后考虑换用新药普拉格雷、替格瑞洛等。普拉格雷是前体药物,需在肝脏代谢转变为活性产物发挥抗血小板效应,起效快,抗血小板作用强,但其出血风险高于氯吡格雷[8]。对于年龄大于75 岁、体质量小于60 kg、发生过中风、短暂性脑出血等患者,普拉格雷是相对或绝对禁忌的[9]。
与氯吡格雷和普拉格雷相比,替格瑞洛具有显著优势,如无需代谢激活,起效迅速,不受P450代谢酶影响,与P2Y12受体呈可逆性结合,停药后血小板功能恢复较快。替格瑞洛抗血小板疗效强于氯吡格雷,但出血风险略有升高,其他不良反应如呼吸困难、室性心律失常等[10]。从药物经济学考虑,氯吡格雷150 mg·d-1(约每日38元),氯吡格雷225 mg·d-1(约每日59元),普拉格雷10 mg·d-1(约每日20元),替格瑞洛90 mg/次,bid(约每日26元),可见普拉格雷和替格瑞洛更优。
加入西洛他唑的三联疗法是解决氯吡格雷弱代谢型的另一方法。研究表明,对于携带至少1个CYP2C19*2或CYP2C19*3功能缺失等位基因的患者,与双联疗法比较,采用三联疗法可降低治疗后血小板的高反应性;而对于没有功能缺失等位基因的患者,不能降低治疗后血小板的高反应性[11]。
本研究将氯吡格雷弱代谢型应对策略作为抗血小板治疗合理性的评价标准。结果显示,仅有少数氯吡格雷弱代谢患者采取氯吡格雷剂量加倍、更换替格瑞洛或三联疗法的方案,其余仍给予常规剂量氯吡格雷。这将可能造成氯吡格雷弱代谢患者抗血小板治疗效果不佳。
①本研究中有16例快代谢型患者采用氯吡格雷剂量加倍(150 mg·d-1)进行短期治疗,是考虑急性冠脉综合征急性期或冠脉支架术后初期血小板处于激活状态[12],发生氯吡格雷抵抗的可能性更大。
②约23.6%的中间代谢型患者采用氯吡格雷150 mg·d-1的剂量是不够的[7],与普拉格雷和替格瑞洛比较,此方案虽无经济学优势,却是研究中间代谢型患者采用的主流方案。原因是医生担忧氯吡格雷225 mg或更换新药会增加出血风险,特别是对于高危出血风险的患者。我们今后拟进一步探讨中间代谢型患者选择氯吡格雷150 mg·d-1、氯吡格雷225 mg·d-1或替格瑞洛90 mg/次,bid,哪种方案临床获益更佳。
③目前认为更换新型P2Y12受体拮抗剂是慢代谢型患者的理想方案,氯吡格雷加量或三联疗法不能有效解决慢代谢型患者的治疗问题。本研究约28.5%慢代谢型患者采取更换替格瑞洛的方案。多数医院尚未购进新药普拉格雷和替格瑞洛(该医院仅购进替格瑞洛),也是临床医生选择其他方案的原因之一。
④三联疗法中的西洛他唑尚未获得推荐用于治疗冠心病,临床应用存在争议。
⑤医生和患者对基因检测技术的接受及重视,也是影响氯吡格雷抵抗实现个体化抗血小板治疗的重要因素。
综上所述,陕西汉族人群氯吡格雷弱代谢型发生率较高,氯吡格雷弱代谢型急性冠脉综合征患者的个体化抗血小板治疗方案并无统一规范。基因检测技术可作为早期筛查氯吡格雷弱代谢型的有效手段,为临床制定个体化抗血小板治疗方案提供依据。
[1] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.2013抗血小板治疗中国专家共识[J].中华心血管病杂志,2013,41(3):183-194.
[2] Nguyen T A,Diodati J G,Pharand C. Resistance to clopidogrel:a review of the evidence [J]. J Am Coll Cardiol,2005,45(8):1157-1164.
[3] 邸晓辉,边佳明,徐娟,等. 我国北方汉族冠心病人群氯吡格雷抵抗相关影响因素的回顾研究[J]. 中国药房,2014,25(20):1872-1874.
[4] Mega J L, Close S L, Wiviott S D, et al. Cytochrome p-450 polymorphisms and response to clopidogrel [J]. N Engl J Med, 2009,360(4):354-362.
[5] 张抗怀,王娜,蔡艳,等.我院开展药物相关基因检测的实践与体会[J].西北药学杂志,2014,29(6):653-654.
[6] Holmes D R Jr, Dehmer G J, Kaul S, et al. ACCF/AHA clopidogrel clinical alert: approaches to the FDA “boxed warning”: a report of the American College of Cardiology Foundation Task Force on clinical expert consensus documents and the American Heart Association endorsed by the Society for Cardiovascular Angiography and Interventions and the Society of Thoracic Surgeons [J]. J Am Coll Cardiol, 2010, 56(4):321-341.
[7] Mega J L, Hochholzer W, Frelinger A L 3rd, et al. Dosing clopidogrel based on CYP2C19 genotype and the effect on platelet reactivity in patients with stable cardiovascular disease [J].JAMA, 2011, 306(20):2221-2228.
[8] Wiviott S D,Braunwald E,McCabe C H,et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes [J].N Engl J Med, 2007, 357(20):2001-2015.
[9] Wiviott S D,Deasi N,Murphy S A,et al. Efficacy and safety of intensive antiplatelet therapy with prasugrel from TRITON-TIMI 38 in a core clinical cohort defined by worldwide regulatory agencies [J].Am J Cardiol, 2011, 108(7): 905-911.
[10]Husted S, Emanuelsson H, Heptinstall S, et al. Pharmacodynamics, pharmacokinetics, and safety of the oral reversible P2Y12 antagonist AZD6140 with aspirin in patients with atherosclerosis: a double-blind comparison to clopidogrel with aspirin [J]. Eur Heart J, 2006, 27(9):1038-1047.
[11]Park K W,Park J J,Lee S P,et al. Cilostazol attenuates on-treatment platelet reactivity in patients with CYP2C19 loss of function alleles reciving dual antiplatelet therapy: a genetic substudy of the CILON-T randomised controlled trial [J]. Heart,2011,97:641-647.
[12]陈磊.冠心病患者的氯吡格雷应用剂量研究[J].西北药学杂志,2015,30(4):418-419.
Retrospective analysis on antiplatelet therapy status in patients with clopidogrel poor metabolizers
LIU Na1,ZHANG Kanghuai1*,DONG Xin2,WANG Haitao1
(1.Department of Pharmacy, the Second Affiliated Hospital of Xi′an Jiaotong University,Xi′an 710004,China;2.Department of Cardiology,the Second Affiliated Hospital of Xi′an Jiaotong University,Xi′an 710004,China)
clopidogrel;poor metabolism;acute coronary syndrome;antiplatelet therapy
西安交通大学第二附属医院新技术新疗法项目(编号:201519);西安交通大学第二附属医院2016年重大医疗技术项目(编号:201605)
刘娜,女,博士,主管药师
*通信作者:张抗怀,男,博士,主任药师
10.3969/j.issn.1004-2407.2016.06.021
R972
A
1004-2407(2016)06-0622-06
2016-07-12)

