HPLC法考察肌苷等4种对照品溶液的稳定性及不确定度分析
朱清丽,谭艳萍,柯红梅,孙全明,李 宁
(安康市食品药品检验检测中心,安康 725000)
HPLC法考察肌苷等4种对照品溶液的稳定性及不确定度分析
朱清丽,谭艳萍,柯红梅,孙全明,李 宁
(安康市食品药品检验检测中心,安康 725000)
目的 考察被测对照品溶液的稳定性。方法 用高效液相色谱法对肌苷、吡拉西坦、甲硝唑及曲安奈德4种对照品溶液进行稳定性考察,并采用不确定度对检测结果的准确性进行验证。结果 肌苷对照品溶液使用期限为15d;吡拉西坦对照品溶液稳定性最好,使用期限为60d;甲硝唑对照品溶液较为稳定,使用期限为21d;曲安奈德对照品溶液稳定性较差,使用期限为7d。结论 根据稳定性考察结果,为建立有效的质量控制方法提供参考。
HPLC;对照品溶液;稳定性;不确定度
《中国药典》[1]中没有规定对照品溶液的有效期限,为了节约工作成本、提高工作效率,本文根据《药品GMP指南》[2]相关技术规范标准[3],并参考有关文献[5-9],结合日常检验工作的使用率,挑选肌苷、吡拉西坦、甲硝唑及曲安奈德4种对照品溶液,按照《中国药典》方法,通过所测的含量来考察对照品溶液的稳定性[5]以及采用不确定度对检测结果的准确性进行验证,为建立有效的质量控制方法提供参考,从而规定内部使用的有效期限、规范对照品溶液的管理。
1 仪器与试药
1.1 仪器Agilent1200型高效液相色谱仪,G1314B检测器,Agilent1200 色谱工作站(美国安捷伦公司);Nexpower1000纯水超纯水器(北京普析通用仪器公司);TG332A分析天平,KQ-250DE超声波清洗器(湘仪天平仪器厂);TCLBCD-165KF3型冰箱(TCL集团有限公司)。
1.2 试药 甲硝唑对照品(批号100191-200606,99.9%,中国食品药品检定研究院);肌苷对照品(批号140669-201104,99.1%,中国食品药品检定研究院);吡拉西坦对照品(批号100386-200702,中国食品药品检定研究院);曲安奈德对照品(批号:100055-201103,中国食品药品检定研究院);水为超纯水(自制);甲醇为色谱纯(Sigma-Aldrich公司)。
2 方法与结果
2.1 色谱条件 色谱柱:AgilentC18(250mm×4.6mm,5μm);流动相:甲醇-水;柱温:30 ℃;流速:1.0mL·min-1。见表1[1]。
2.2 溶液的制备
2.2.1 供试品溶液的制备 肌苷:取肌苷对照品10mg,精密称定,置于50mL量瓶中,用水溶解并稀释至刻度,摇匀;精密量取溶液5mL,置于50mL量瓶中,用水稀释至刻度,摇匀,即得[1]。
表1 色谱条件
Tab.1Chromatographicconditions

品名甲醇-水检测波长/nm进样量/μL肌苷10∶9024820吡拉西坦10∶9021010甲硝唑20∶8032010曲安奈德53∶4724020
吡拉西坦:取吡拉西坦对照品10mg,精密称定,置于100mL量瓶中,用流动相溶解并稀释至刻度,摇匀,即得。
甲硝唑:取甲硝唑对照品12.5mg,精密称定,置于50mL量瓶中,用流动相溶解并稀释至刻度,摇匀,即得。
曲安奈德:取曲安奈德对照品7.5mg,精密称定,置于25mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,精密量取溶液5mL,置于50mL量瓶中,用甲醇稀释至刻度,摇匀,即得。
将配制的供试品溶液置于棕色量瓶中存放,贮存在2~8 ℃冰箱内(量瓶一定要密塞且溶液取用后立即放入冰箱中保存[6])。检测前取出部分装入液相小瓶,放至室温。
2.2.2 对照品溶液的制备 同2.2.1项下各供试品溶液的制备。
2.3 测定 按照各品种项下要求进行系统适用性实验,满足实验要求后进行测定。结果见图1。

图1HPLC图
A.肌苷;B.吡拉西坦;C.甲硝唑;D.曲安奈德
Fig.1HPLCchromatograms
A.inosine;B.derbyoflevetiracetam;C.metronidazole;D.triamcinoloneacetonide
2.4 计算 按照外标法计算其测定含量,代入量瓶及移液管的校正值,所有计算结果均保留小数点后2位。
2.5 各供试品溶液的测定结果 见表2~5。
表2 肌苷供试品溶液的测定结果
Tab.2Thedeterminationresultsofinosinetestsolution

时间点/d供试品溶液Ⅰ/%供试品溶液Ⅱ/%平均值/%RSD/%与0点的绝对值差0100.00100.00100.00100.00100.000.000.00798.7598.8299.0199.3898.990.281.011598.4298.2998.1698.2798.280.111.722197.9497.7797.9498.0497.920.112.083094.3794.2594.0194.0794.180.185.82
表3 吡拉西坦供试品溶液的测定结果
Tab.3Thedeterminationresultsofthepiracetamsamplesolution

时间点/d供试品溶液Ⅰ/%供试品溶液Ⅱ/%平均值/%RSD/%与0点的绝对值差0100.00100.00100.00100.00100.000.000.007100.82100.75100.98100.97100.880.110.8815101.14101.18101.03100.86101.050.141.0521100.83100.76100.79100.78100.790.030.7930100.42100.34100.46100.22100.360.110.3645100.12100.08100.10100.06100.090.030.096099.8299.87100.02100.1999.980.170.02
表4 甲硝唑供试品溶液的测定结果
Tab.4Thedeterminationresultsofthemetronidazoletestsolution
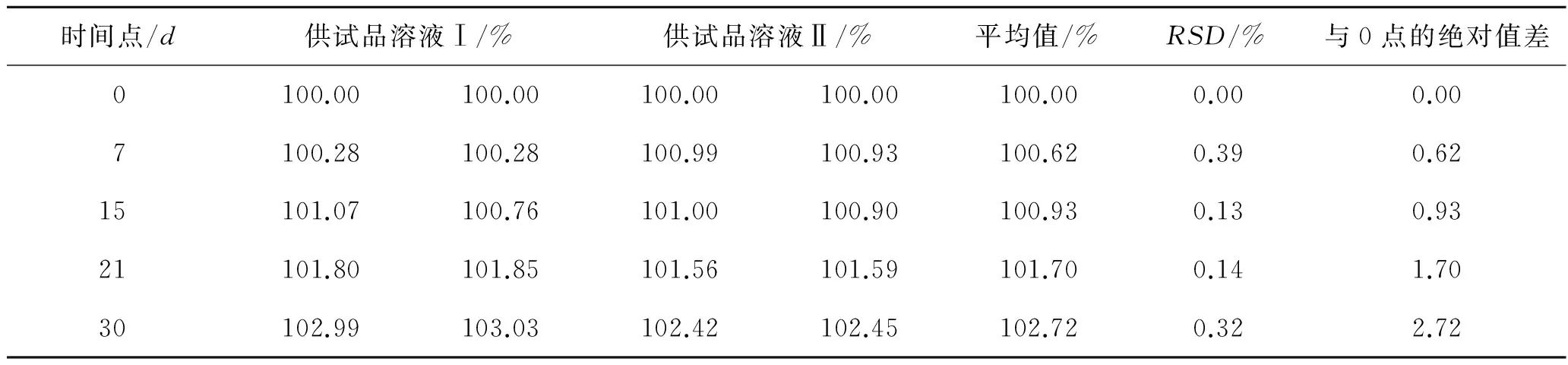
时间点/d供试品溶液Ⅰ/%供试品溶液Ⅱ/%平均值/%RSD/%与0点的绝对值差0100.00100.00100.00100.00100.000.000.007100.28100.28100.99100.93100.620.390.6215101.07100.76101.00100.90100.930.130.9321101.80101.85101.56101.59101.700.141.7030102.99103.03102.42102.45102.720.322.72
表5 曲安奈德供试品溶液的测定结果
Tab.5Thedeterminationresultsofthetriamcinoloneacetonidetestsolution
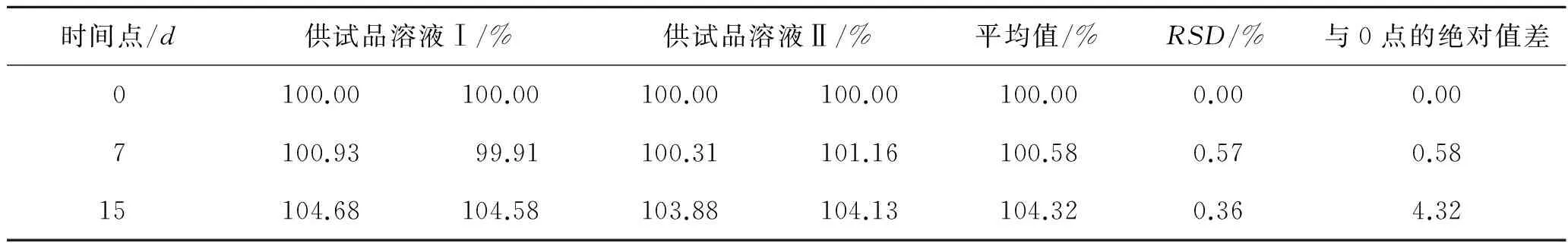
时间点/d供试品溶液Ⅰ/%供试品溶液Ⅱ/%平均值/%RSD/%与0点的绝对值差0100.00100.00100.00100.00100.000.000.007100.9399.91100.31101.16100.580.570.5815104.68104.58103.88104.13104.320.364.32
根据GMP[2]中要求,在0时间点,每份对照品溶液互相复核的结果不得超过2.0;在每个分析测试点,对照品溶液活性成分的含量与0点的差异不得超过2.0。
3 不确定度的评定及对测量结果的评价
对测量结果进行不确定的评定,从而进一步验证测定结果的有效性。
用趋势分析法和方差分析法来评估不稳定性引入的不确定度分量,用趋势分析法判断对照品是否稳定,用方差分析法计算不稳定性引入的不确定度。
3.1 数学模型
式中,W为供试品溶液的质量分数(%);As为供试品溶液的峰面积;ms为供试品溶液的称样量(g);Vs为供试品溶液的稀释体积(mL);mt为对照品溶液的称样量(mg);At为对照品溶液平行进样5次的峰面积平均值;Vt为对照品溶液的稀释体积(mL);P为对照品质量分数。
3.2 不确定度的主要来源分析 见图2[6]。图2中各种随机效应引入的不确定度分量,采用测量重复性进行评定。

图2 按照属性分类的不确定来源
Fig.2Thesourceofuncertaintyintheclassificationofattributes
3.3 不确定度分量计算
3.3.1 测量重复性的相对标准不确定度 对重复性条件下同一批次的多个对照品溶液进行测量,得到的校正因子数值见表6。
测量的重复性以标准偏差表示,按照贝赛尔公式计算:
表6 4种对照品溶液的校正因子数值
Tab.6Correctionfactorvaluesofthe4controlsolutions

对照品序号肌苷(×10-5)吡拉西坦(×10-5)甲硝唑(×10-5)曲安奈德(×10-5)11.92248.71703.27092.320021.92478.68803.24542.311331.93928.72673.28082.340441.91188.72103.29772.322251.96978.73503.29612.327261.94068.44423.34262.330771.94188.69823.3082—81.96698.77753.3294—91.97038.78193.3329—101.93478.84253.3273—11—8.8301——12—8.7638——平均值1.94128.73553.30312.3353
注:—表示未进行测定计算。
通常测量校正因子2次,取平均值进行计算,测量重复性引入的相对标准不确定度为:
结果见表7。
表7 4种对照品溶液测量重复性引入的相对标准不确定度结果
Tab.7Therelativestandarduncertaintyofthemeasurementrepeatabilityofthefourreferencesolutions

项目肌苷吡拉西坦甲硝唑曲安奈德 s(f)1.7012×10-7 7.7458×10-7 3.1079×10-7 9.945×10-8 urel(frep)6.20×10-3 6.27×10-3 6.65×10-3 3.02×10-3

当称样量为10.00mg时,urel(mt)=urel(mt)=0.0173/10=1.73×10-3。
3.3.3 稀释体积引入的相对标准不确定度urel(Vs)和urel(Vt)

校准温度为20 ℃,实验室温度在20±5 ℃之间变动,水体积膨胀系数为2.1×10-4·℃-1,按照均匀分布,则

=8.39×10-4
(2)5mL单标线移液管带入的不确定度
同50mL量瓶的评定,则
urel(V5)=1.84×10-3
(3)25mL量瓶带入的不确定度
同50mL量瓶的评定,则
urel(V25)=9.21×10-4
(4)100mL量瓶带入的不确定度
同50mL量瓶的评定,则
urel(V100)=5.47×10-4
3.3.4 对照品质量分数引入的相对标准不确定度
对照品质量分数带来的不确定度,现无法得知其不确定度的参考数值及相关信息,故此项忽略[7]。
3.3.5 不确定度分量汇总 见表8。
表8 各种不确定度分量汇总
Tab.8Thetotaluncertaintysummary

分量肌苷吡拉西坦甲硝唑曲安奈德重复性6.20×10-36.27×10-36.65×10-33.02×10-3ms1.76×10-31.71×10-31.39×10-32.47×10-3mt1.76×10-31.71×10-31.39×10-32.47×10-3Vs2.19×10-35.47×10-48.39×10-49.21×10-4Vt2.19×10-35.47×10-48.39×10-49.21×10-4
3.3.6 合成不确定度及扩展不确定度计算 根据表7相对不确定分量合成计算:

uc(W)=W×urel(W)
扩展不确定度的计算:
取包含因子为k=2,置信水平为95%, U=2×uc(w),结果见表9。
表9 合成不确定度及扩展不确定度
Tab.9Theuncertaintysummary

品名合成不确定度扩展不确定度(k=2)/%肌苷7.32×10-31.45吡拉西坦6.76×10-31.35甲硝唑7.03×10-31.41曲安奈德5.11×10-31.02
3.4 用不确定度评价测量结果的可接受性 由于使用相同的方法测量同一被测物品,2次测量结果的扩展不确定度相同。所以,当测量结果的差值满足下式的要求则可认为2次测量结果无显著性差异[8]。

x1为第1次测量结果;x2为第2次测量结果;U1为第1次测量结果x1的扩展不确定度,置信概率为95%;U2为第2次测量结果x1的扩展不确定度,置信概率为95%。
取测试结果中含量差异未超过2.0的最大值或最小值计算En,结果:肌苷En=0.83;吡拉西坦En=0.55;甲硝唑En=0.85;曲安奈德En=0.40。
4 结论
实验结果显示,对肌苷、吡拉西坦、甲硝唑及曲安奈德4种对照品溶液的稳定性考察研究结论:肌苷对照品溶液使用期限为15d;吡拉西坦对照品溶液稳定性最好,使用期限为60d;甲硝唑对照品溶液较为稳定,使用期限为21d;曲安奈德对照品溶液稳定性较差,使用期限为7d。
以上结论为实验室对照品溶液管理提供数据参考,为完善实验室质量控制提供科学保障。
[1] 国家药典委员会.中国药典2010年版[S].二部.北京:中国医药科技出版社,2010:899.
[2] 国家食品药品监督管理局药品认证管理中心.药品GMP指南-质量控制实验室与物料系统[S].北京:中国医药科技出版社,2011:8.
[3]JJF1059.1-2012,测量不确定度评定与表示[S].全国法制计量管理计量技术委员会,2012.
[4] 何悦,张红飞.含0.1%苯甲酸钠的17氨基酸对照品水溶液的稳定性考察[J].中国药品标准,2008,9(6):447-450.
[5] 段萍,谈大川,孙蓉,等.对中国药典“复方磺胺甲噁唑片”含量测定所用对照品溶液稳定性的研究 [J].河北职工医学院学报,2001,18(4):1-2.
[6] 朱清丽,柯红梅,谭艳萍,等.HPLC测定维生素B6片含量的不确定度分析[J].西北药学杂志,2014,29(5):466-469.[7] 柯红梅,肖娟,曾晓黎,等.HPLC测定阿莫西林胶囊含量的不确定度分析[J].西北药学杂志,2009,24(5):347-349.
[8]CNAS-CL01:2006,检测和校准实验室能力认可准则[S].中国合格评定国家认可委员会,2006.
Study on the stability of control solutions of inosine, piracetam, metronidazole and triamcinolone acetonide by HPLC
ZHUQingli,TANYanping,KEHongmei,SUNQuanming,LINing
(AnkangInstituteforFoodandDrugControl,Ankang725000,China)
ObjectiveToinvestigatethestabilityof4kindsofcontrolsolutions.MethodsHighperformanceliquidchromatographywasusedtostudythestabilityandtheaccuracyuncertaintyofinosine,derbyoflevetiracetam,metronidazoleandtriamcinoloneacetonidecontrolsolutions,weinvestigatedthestability.ResultsInosinecontrolsolutioncouldbeusedforaperiodof15days;piracetamforaperiodof60days;metronidazolereferencesolutionwasstable,andcouldbeusedforaperiodof21days;triamcinoloneacetonidereferencesolutionstabilitywaspoor,couldbeusedforaperiodof7days.ConclusionTheresultsofthestabilitystudysuppliedareferenceforeffectivequalitycontrol.
HPLC;referencesolution;stability;uncertaintydegree
10.3969/j.issn.1004-2407.2016.06.013
R
A
2016-01-21)

