高效液相色谱法同时测定丹参中6种化学成分的含量
程茜菲
(陕西国际商贸学院,咸阳 712046)
·中药及天然药物·
高效液相色谱法同时测定丹参中6种化学成分的含量
程茜菲
(陕西国际商贸学院,咸阳 712046)
目的 建立高效液相色谱法(HPLC)同时测定丹参中迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA含量的方法。方法 采用Thermo C18柱(250 mm×4.6 mm,5 μm)色谱柱;以甲酸水和乙腈进行梯度洗脱;柱温30 ℃;流速1 mL·min-1;检测波长为270 nm。结果 迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA的线性范围分别为:0.336~3.36 μg(r=0.999 9),4.772~47.72 μg(r=0.999 8),0.019 3~0.192 8 μg(r=0.999 8),0.072~0.72 μg(r=0.999 7),0.077 2~0.772(r=0.999 8)和0.174 4~1.744 μg(r=0.999 9);平均加样回收率分别为:100.2%,100.4%,98.6%,100.0%,99.3%和99.1%,RSD值分别为1.58%,1.25%,1.09%,1.21%,1.10%和1.06%。结论 该法同时测定了丹参中迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ及丹参酮ⅡA6种化学成分的含量,结果准确可靠。
丹参;迷迭香酸;丹酚酸B;二氢丹参酮Ⅰ;隐丹参酮;丹参酮Ⅰ;丹参酮ⅡA;高效液相色谱法
A.stract:Objective To establish a method for the simultaneous determination of rosmarinic acid,salvianolic acid B,dihydrotanshinone Ⅰ,clyptotanshinon,tanshinoneⅠand tanshinone ⅡA in RadixSalviaemiltiorrhiza. Methods The chromatograhic separation was performed on Thermo C18column (250 mm×4.6 mm,5 μm); the column temperature was maintained at 30 ℃;the separation was achieved by a linear gradient elution;the moblie phase was a mixture of solvent A(acetonitrile) and solvent B(formic acid aqueous).The flow rate was 1 mL·min-1;the UV detection wavelength was 270 nm. Result Rosmarinic acid,salvianolic acid B,dihydro-tanshinone Ⅰ,clyptotanshinon,tanshinoneⅠand tanshinone ⅡA showed good linearity in the ranges of 0.336-3.36 μg(r=0.999 9),and 4.772-47.72 μg(r=0.999 8),0.019 3-0.192 8 μg(r=0.999 8),0.072-0.72 μg(r=0.999 7),0.077 2-0.772 μg(r=0.999 8),and 0.174 4-1.744 μg(r=0.999 9),respectively.The average recoveries were 100.2%(1.58%),100.4%(1.25%),98.6%(1.09%),100.0%(1.21%),99.3%(1.10%),and 99.1%(1.06%),respectively.Conclusion The present method is simple and has satisfactory efficacy;it could be used for simultaneously determing rosmarinic acid,salvianolic acid B,dihydrotanshinoneⅠ,clyptotanshinon,tanshinoneⅠand tanshinone ⅡA components inSalviamiltiorrhiza.
丹参为唇形科植物丹参(SalviamiltiorrhizaBunge)的干燥根及根茎,具有祛瘀止痛、活血通经、清心除烦之功效[1]。丹参中主要含有水溶性的酚酸类和脂溶性的二萜醌类化学成分。现代药理学研究表明,丹参中的酚酸类和二萜醌类成分均具有显著的生理活性[2-4]。本文中水溶性成分迷迭香酸[5]、丹酚酸B[6]和脂溶性成分隐丹参酮[7]、二氢丹参酮Ⅰ[8]、丹参酮Ⅰ[9]、丹参酮ⅡA[10-11]经药理学研究发现药理活性较好,由于《中国药典》(2010年版)中以丹酚酸B和丹参酮ⅡA2个指标评价丹参质量的优劣,有一定的片面性,因此以多个指标评价丹参质量优劣更有说服力。本实验采用梯度洗脱法,建立了同时测定丹参中迷迭香酸、丹酚酸B、隐丹参酮、二氢丹参酮Ⅰ、丹参酮Ⅰ和丹参酮ⅡA等6种化学成分的方法,该方法简便、准确、重复性好,可为丹参药材的质量评价提供理论依据。
1 仪器与试药
1.1 仪器 Waters 2695-2996高效液相色谱仪(美国沃特斯公司);Empower色谱工作站;FA1104B电子天平(上海越平科学仪器有限公司);KQ-500DB超声波清洗机(上海越众仪器设备有限公司)。
1.2 试药 迷迭香酸(中国食品药品检定研究院,批号111871-201404);丹酚酸B(中国食品药品检定研究院,批号111562-201514);二氢丹参酮Ⅰ(宝鸡市辰光生物科技有限公司,批号20121209);隐丹参酮(中国食品药品检定研究院,批号110852-200806);丹参酮Ⅰ(宝鸡市辰光生物科技有限公司,批号20121007);丹参酮ⅡA(中国食品药品检定研究院,批号110766-201520)。丹参药材分别产自四川(DS1,购自四川)和河南(DS2,购自郑州;DS3,购自西安),经本实验室鉴定为唇形科植物丹参(SalviamiltiorrhizaBunge)的干燥根及根茎。乙腈为色谱纯(Fisher公司);水为娃哈哈纯净水;甲酸(西安鑫宝佳业化工有限公司,分析纯);其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件 Thermo C18色谱柱(250 mm×4.6 mm,5 μm)。流动相A为乙腈,流动相B为甲酸水(0.4 mL·L-1),梯度洗脱:0~15 min:10%~25%A;15~25 min:25%~26%A;25~40 min:26%~43%A;40~60 min:43%~74%A;60~65 min:74%~84%A;65~70 min:84%~85%。流速为1.0 mL·min-1;柱温为30 ℃;检测波长为270 nm;进样量为10 μL;供试品溶液和混合对照品溶液色谱图见图1。
图1 HPLC图
A.供试品溶液;B.混合对照品;1.迷迭香酸;2.丹酚酸B;3.二氢丹参酮Ⅰ;4.隐丹参酮;5.丹参酮Ⅰ;6.丹参酮ⅡA
Fig.1 HPLC chromatograms
A.sample;B.control;1.rosmarinic acid;2.salvianolic acid B;3.dihydro tanshinone Ⅰ;4.cryptotanshinone;5.tanshinone Ⅰ;6.tanshinone ⅡA
2.2 混合对照品溶液的制备 取对照品迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA适量,精密称定,加入体积分数为80%的乙醇,使其完全溶解,分别制得对照品溶液。分别精密吸取各溶液适量,加体积分数为80%的乙醇,稀释至1 mL含迷迭香酸168 μg、丹酚酸B 2 386 μg、二氢丹参酮Ⅰ9.64 μg、隐丹参酮36 μg、丹参酮Ⅰ38.6 μg、丹参酮ⅡA 87.2 μg的混合对照品溶液。
2.3 供试品溶液的制备 取样品粉末0.5 g,精密称定,置于25 mL具塞锥形瓶中,精密加入10 mL体积分数为80%的乙醇,称定质量,超声提取45 min,放至室温,再称定质量,用体积分数为80%的乙醇补足减失的质量。摇匀,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.4 线性范围考察 将混合对照品溶液分别精密吸取2,4,8,10,15和20 μL,按照2.1项下色谱条件进行测定。横坐标(X)为进样量,纵坐标(Y)为峰面积,进行线性回归,得回归方程。迷迭香酸:Y=1 000 000X+1 003.3,r=0.999 9,在0.336~3.36 μg范围内与峰面积呈良好的线性关系;丹酚酸B:Y=787 522X-10 672,r=0.999 8,在4.772~47.72 g范围内与峰面积呈良好的线性关系;二氢丹参酮 Ⅰ:Y=3 000 000X-1 278.8,r=0.999 8,在0.019 3~0.192 8 μg范围内与峰面积呈良好的线性关系;隐丹参酮:Y=5 000 000X-4 700.8,r=0.999 7,在0.072~0.72 μg范围内与峰面积呈良好的线性关系;丹参酮 Ⅰ:Y=2 000 000X-11 182,r=0.999 8,在0.077 2~0.772范围内与峰面积呈良好的线性关系;丹参酮ⅡA:Y=5 000 000X+591.44,r=0.999 9,在0.174 4~1.744 μg范围内,与峰面积呈良好的线性关系。
2.5 精密度实验 吸取混合对照品溶液适量,按照2.1项下色谱条件连续进样6次,测得迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA6个对照品峰面积的RSD值分别为0.96%,0.39%,0.85%,0.50%,0.43%和0.30%,结果表明,该系统精密度良好。
2.6 稳定性实验 取样品溶液(四川产丹参),在0,2,4,8,12和24 h,按照2.1项下方法进行测定,测得6个对照品峰面积的RSD值分别为1.01%(迷迭香酸),1.55%(丹酚酸B),0.76%(二氢丹参酮Ⅰ),1.22%(隐丹参酮),0.69%(丹参酮Ⅰ)和0.41%(丹参酮ⅡA),结果表明,该溶液24 h内较稳定。
2.7 重复性实验 称取样品粉末(四川产丹参)0.5 g,精密称定6份,按照2.3项下方法进行制备,按照2.1项下色谱条件进样,测得样品中6种化学成分含量的RSD值分别为1.26%(迷迭香酸),1.36%(丹酚酸B),0.80%(二氢丹参酮Ⅰ),0.73%(隐丹参酮),0.53%(丹参酮Ⅰ)和0.67%(丹参酮ⅡA),结果表明,该方法重复性较好。
2.8 加样回收实验 取样品粉末(DS1,已知含量)0.5 g,精密称定6份,分别置于50 mL具塞锥形瓶中,再分别加入适量迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA对照品,精密加入20 mL体积分数为80%的乙醇,按照2.3项下方法制备溶液,按照2.1项下色谱条件进样,结果测得迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA回收率分别为100.2%(RSD值为1.58%),100.4%(RSD值为1.25%),98.6%(RSD值为1.09%),100.0%(RSD值为1.21%),99.3%(RSD值为1.10%)和99.1%(RSD值为1.06%),结果见表1。
表1 加样回收率结果
Tab.1 Results of recovery test
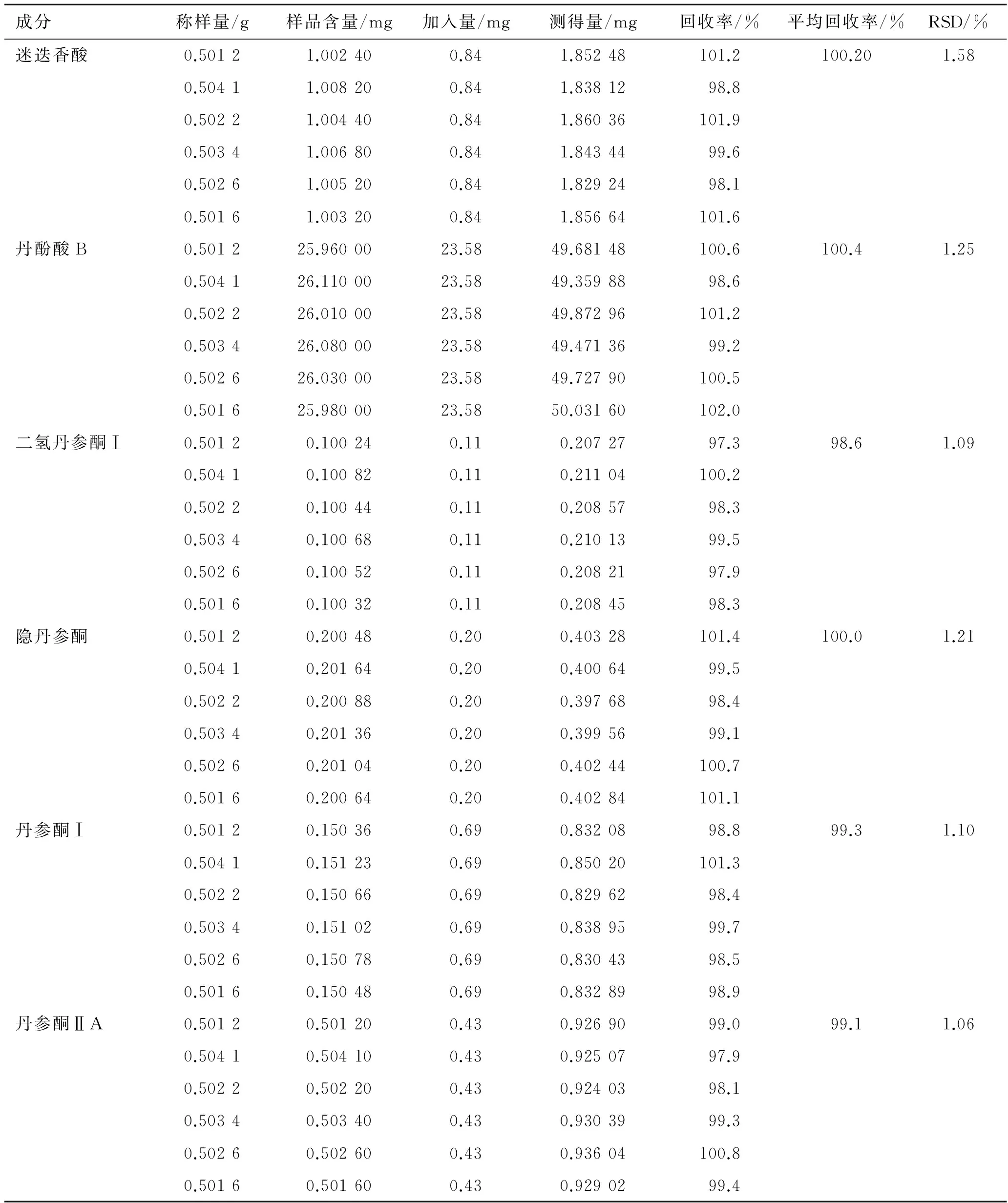
成分称样量/g样品含量/mg加入量/mg测得量/mg回收率/%平均回收率/%RSD/%迷迭香酸0.50121.002400.841.85248101.2100.201.580.50411.008200.841.8381298.80.50221.004400.841.86036101.90.50341.006800.841.8434499.60.50261.005200.841.8292498.10.50161.003200.841.85664101.6丹酚酸B0.501225.9600023.5849.68148100.6100.41.250.504126.1100023.5849.3598898.60.502226.0100023.5849.87296101.20.503426.0800023.5849.4713699.20.502626.0300023.5849.72790100.50.501625.9800023.5850.03160102.0二氢丹参酮Ⅰ0.50120.100240.110.2072797.398.61.090.50410.100820.110.21104100.20.50220.100440.110.2085798.30.50340.100680.110.2101399.50.50260.100520.110.2082197.90.50160.100320.110.2084598.3隐丹参酮0.50120.200480.200.40328101.4100.01.210.50410.201640.200.4006499.50.50220.200880.200.3976898.40.50340.201360.200.3995699.10.50260.201040.200.40244100.70.50160.200640.200.40284101.1丹参酮Ⅰ0.50120.150360.690.8320898.899.31.100.50410.151230.690.85020101.30.50220.150660.690.8296298.40.50340.151020.690.8389599.70.50260.150780.690.8304398.50.50160.150480.690.8328998.9丹参酮ⅡA0.50120.501200.430.9269099.099.11.060.50410.504100.430.9250797.90.50220.502200.430.9240398.10.50340.503400.430.9303999.30.50260.502600.430.93604100.80.50160.501600.430.9290299.4
2.9 样品含量测定 取不同批号丹参药材粉末0.5 g,精密称定,按照2.3项下方法制备供试品,按照2.1项下色谱条件进样,结果见表2。
表2 6种化合物的含量测定结果
Tab.2 Determination results of 6 compounds
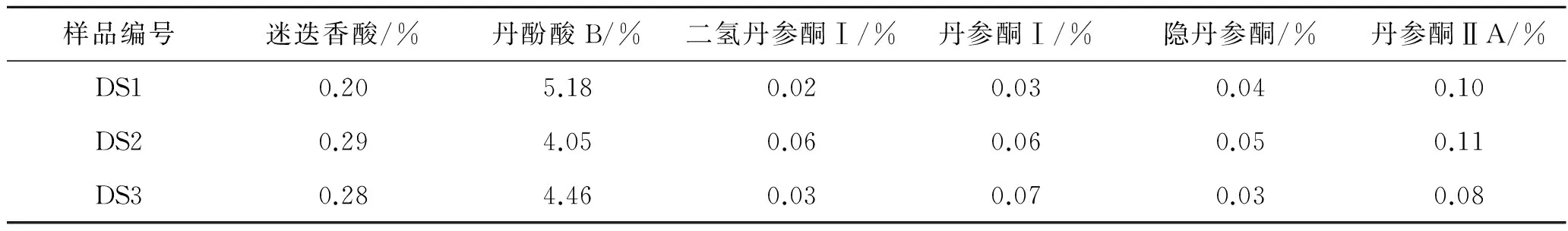
样品编号迷迭香酸/%丹酚酸B/%二氢丹参酮Ⅰ/%丹参酮Ⅰ/%隐丹参酮/%丹参酮ⅡA/%DS10.205.180.020.030.040.10DS20.294.050.060.060.050.11DS30.284.460.030.070.030.08
3 讨论
3.1 提取条件的选择 对样品的制备方法进行分析,先对不同溶剂、相同溶剂不同体积分数进行考察选取提取溶剂,再对提取方法、提取时间进行研究,最终确定制备方法为用体积分数为80%的乙醇超声提取45 min。
3.2 流动相的选择 分别考察了甲醇-水、乙腈-水、乙腈-甲酸水和乙腈-磷酸水等溶剂系统作为流动相,最终采用乙腈-甲酸水溶剂系统洗脱,丹参药材中6种化学成分具有良好的分离效果和较好的峰形。
3.3 检测波长的选择 分别对6种成分进行紫外扫描,确定其最大吸收波长;对混合对照品溶液和样品采用DAD检测器进行190~400 nm的全波长扫描,由于6种化学成分的最大吸收波长不同,综合考虑,在270 nm处,各成分均有较大吸收、峰形好,因此选择270 nm为供试品溶液的检测波长。
经方法学研究结果表明,采用HPLC法同时测定丹参中迷迭香酸、丹酚酸B、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA6种化学成分的含量,具有良好的精密度、准确度和重复性,简便易行,可为丹参药材质量评价提供理论依据。
[1] 国家药典委员会.中国药典2010年版[S].一部.北京:中国医药科技出版社,2010:194.
[2] 娄子洋,张海,李翔,等.HPLC法同时测定中药丹参中水溶性和脂溶性成分的含量[J].第二军医大学学报,2009,30(2):190-193.
[3] 韦辉,刘素香,刘毅,等.丹参药材的综合质量评价研究[J].药物评价研究,2011,34(5):343-347.
[4] 覃华,张琰,杜小燕,等.原儿茶酸对小鼠心肌缺血/再灌注损伤的保护作用[J].西北药学杂志,2015,30(6):709-712.
[5] 王虹,刘红梅,王磊.迷迭香酸对四氯化碳致小鼠急性肝损伤的保护作用[J].中成药,2009,31(3):354-358.
[6] 柳艳,李磊,刘王莹,等.丹酚酸抗氧化活性及其对DNA损伤保护作用[J].中国公共卫生,2007,23(4):448-449.
[7] 李昌勤,赵琳,薛志平,等.隐丹参酮抑菌机制研究[J].中国药学杂志,2012,47(21):1706-1710.
[8] 林肖惠,徐为人,刘鹏,等.二氢丹参酮Ⅰ的降血脂作用研究[J].中草药,2008,39(9):1378-1380.
[9] 郑国灿,李智英.丹参酮Ⅰ对HepG2细胞抑制作用的体外实验研究[J].现代医学,2004,32(5):296-298.
[10]吴迪,袁鑫,刘金艳,等.丹参酮ⅡA对中毒性心肌炎的防治作用研究[J].湖北科技学院学报,2012,26(6):473-474.
[11]刘勇,霍金莲,龙永春,等.胰岛素与丹参酮ⅡA对大鼠糖尿病周围神经病变的保护作用[J].西北药学杂志,2015,30(6):716-720.
Simultaneous determination of six components in Radix Salvia miltiorrhiza by HPLC
CHENG Qianfei
(Shaanxi Institute of International Trade & Commerce,Xianyang 712046,China)
RadixSalviamiltiorrhiza;rosmarinic acid;salvianolic acid B;dihydrotanshinoneⅠ; clyptotanshinon;tanshinoneⅠ;tanshinoneⅡA;HPLC
陕西省中医管理局中医药科研课题项目(编号:ZY10)
10.3969/j.issn.1004-2407.2016.06.001
R927.2
A
1004-2407(2016)06-0551-04
2016-03-21)

