集束化干预在内镜治疗癌症患者中的应用
曾 婷
集束化干预在内镜治疗癌症患者中的应用
曾 婷
目的 研究集束化干预在内镜治疗癌症患者中的应用效果 。方法 选择84例癌症患者,按随机数字表分为两组,即常规组42例和治疗组42例。常规组采用常规治疗干预,治疗组采用集束化干预治疗干预。结果 常规组脱管2例、皮肤感染3例、消化道不良反应4例;治疗组脱管1例、皮肤感染2例、消化道不良反应1例;常规组注射点出血3例、异位栓塞4例、肝功能衰竭1例、迟发性出血3例;治疗组注射点出血1例、异位栓塞2例、肝功能衰竭1例、迟发性出血2例,常规组总不良反应发生率(47.6%)显著高于治疗组总不良反应发生率(23.8%),P<0.05,差异有统计学意义。治疗组有效率(73.8%)显著高于常规组(54.8%),P<0.05,差异有统计学意义。结论 采用集束化干预在内镜治疗癌症患者中的应用疗效比常规治疗疗效更显著。
集束化干预;内镜治疗;癌症
(ThePracticalJournalofCancer,2016,31:1734~1736)
集束化干预在中文里又称集束化治疗或者捆绑式治疗,是ICU(intensive care unit,重症加强干预病房)新兴的专业名词,其针对一些不易治疗的临床疾病而采取有循证基础的干预和治疗方法[1]。集束化干预不能绝对应用于每一个患者,而要依据患者本身的特殊病况来决定,但可作为操作标准的最佳选择。治疗和干预措施的强度决定了集束化干预的临床效果[2]。在X射线看不到的病变可借助内镜窥视,如胃肠道的溃疡或肿瘤等,如使用或配合不当容易造成许多不良反应。我院针对内镜治疗癌症患者采取集束化干预方案并进行研究分析。
1 资料与方法
1.1 一般资料
选取2013年2月-10月我院内镜治疗的癌症患者84例,按随机数字表法分为常规组和治疗组。其中常规组直肠癌15例、胃癌14例、食管癌13例,年龄45~75岁,平均年龄(60±4.5)岁;治疗组直肠癌13例、胃癌11例、食管癌18例,年龄45~75岁,平均年龄(60±4.5)岁;两组患者在年龄及疾病类型上比较差异无统计学意义(P>0.05),两组患者临床资料比较见表1。
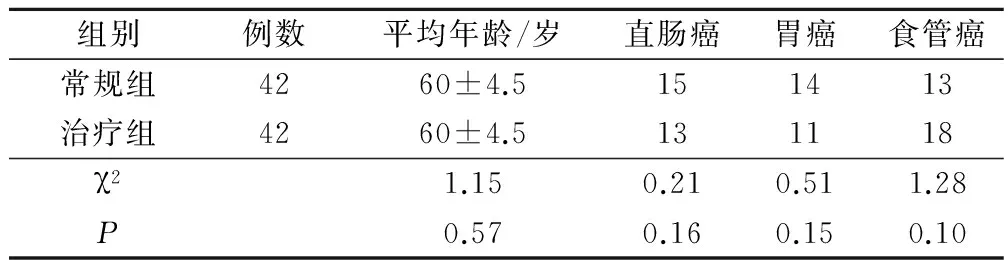
表1 两组临床资料比较/例
1.2 干预措施
常规组进行常规干预。治疗组在常规干预的基础上进行集束化干预:①心理干预。首先与患者建立起良好的护患关系,进行常规的心理干预,提供手术疾病信息及健康宣教,与患者及其家属做好配合,减少患者因环境而产生的心理压力,个别患者可实施个性心理干预。从患者的睡眠质量及负性情绪着手,实施个性化心理干预,每天与患者沟通、交流30 min以上,解决患者心理存在的问题,加强社会支持,主动是获得家属的支持,采用精神松弛疗法,缓解患者的精神压力。②术中干预。提高无菌卫生操作。皮肤感染和消化道不良反应的预防要严格执行洗手时机、 六步洗手法、无菌操作。术中严密观察患者生命体征,出现异常及时处理,手术结束后与管床护士做好交接工作。③术后干预。预防脱管:新改良预防措施采用自制特别肚兜和约束手套,特制肚兜能够缓解患者在病床上的不适感,约束手套能够帮助患者减少手指的活动但不影响身体的活动;预防堵管:新改良预防措施把米曲胰酶片磨成粉末加进食物里搅拌。此方法可以抑制真菌产生从而降低患者消化道不良反应的发生;预防消化道不良反应:依据患者的身体状况和一些不良反应,每个星期给出针对性的营养评估,按时代谢监测。
1.3 疗效评估
将两组患者的脱管、皮肤感染 、消化道不良反应(腹泻、呕吐、反流、腹胀) 以及注射点出血、异位栓塞、肝功能衰竭、迟发性出血发生率作为评估内容,对两组患者住院期间的干预效果进行评价 。
1.4 统计学方法
应用SPSS 14.0的统计软件对结果进行统计分析,计数资料用相对数表示,采用χ2检验。检验标准设置为0.05,P<0.05时差异有统计学意义。
2 结果
常规组脱管2例、皮肤感染3例、消化道不良反应4例;治疗组脱管1例、皮肤感染2例、消化道不良反应1例;常规组注射点出血3例、异位栓塞4例、肝功能衰竭1例、迟发性出血3例;治疗组注射点出血1例、异位栓塞2例、肝功能衰竭1例、迟发性出血2例,常规组总不良反应发生率(47.6%)显著高于治疗组总不良反应发生率(23.8%)(P<0.05),差异有统计学意义。两组患者不良反应比较见表2。
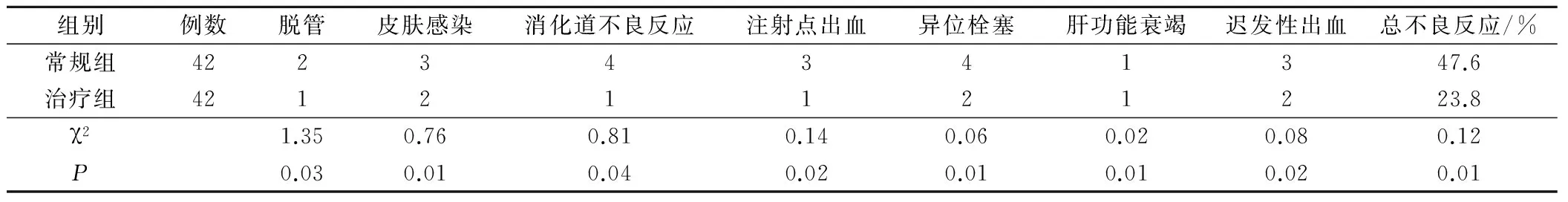
表2 常规组与治疗组不良反应比较/例
常规组治愈23例,显效8例,进步6例,无效5例;治疗组治愈31例,显效6例,进步4例,无效1例;治疗组有效率(73.8%)显著高于常规组有效率(54.8%)(P<0.05),差异有统计学意义。两组患者有效率比较见表3。
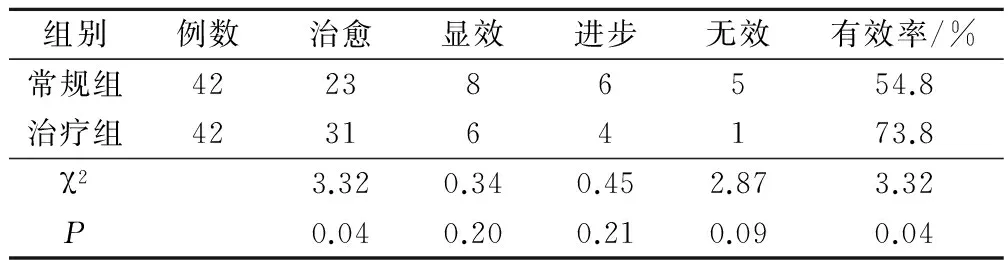
表3 常规组与治疗组有效率比较/例
3 讨论
集束化干预可为重病病人患上常见的一些疾病提供良好的指导,也是把循证文化引进临床干预的1种理念[3-4],其目的在于帮助医护人员为患者提供更优化的医疗服务和干预结局,为重症患者提供最佳的实践指南。国内一些研究人员在近期阶段也探索性的将“集束化”理念应用于临床实践中[5-6]。但在执行的过程中,一定要严格执行集束化干预措施,不能间断或选择其中的某一项或几项,否则就违反了集束化的精髓[7-8]。内镜治疗有其独特的优越处,只需细微的伤口即可完成治疗,减少了手术的创伤,也增加了手术的精确性和安全性,大大提高了患者的接受程度。内窥镜可用于多种疾病的检查和治疗,且有较高的诊断率,特别是对X射线无法探查的疾病,如消化道肿瘤等,也可用于抢救危重患者[9-10]。由于患者缺乏对相关内镜知识的了解,造成心理紧张、恐惧等负性情绪,严重影响内镜的使用;再者就是医师对内镜使用不熟悉,不清楚操作步骤,使用的过程中不注重无菌操作,容易给患者带来多种并发症;术后护士处理不当,都容易给患者带来不良影响。集束化干预就是针对以上几点对干预措施进行规范,做到医护患的完全配合。
本实验主要探讨集束化干预在内镜治疗癌症患者中的应用疗效,常规组采用常规治疗干预,治疗组采用集束化干预治疗干预。研究表明,常规组脱管2例、皮肤感染3例、消化道不良反应4例;治疗组脱管1例、皮肤感染2例、消化道不良反应1例;常规组注射点出血3例、异位栓塞4例、肝功能衰竭1例、迟发性出血3例;治疗组注射点出血1例、异位栓塞2例、肝功能衰竭1例、迟发性出血2例,常规组总不良反应发生率47.6%显著高于治疗组总不良反应发生率23.8%,P<0.05差异有统计学意义。治疗组有效率73.8%显著高于常规组有效率54.8%,P<0.05差异有统计学意义。
综上所述,采用集束化干预在内镜治疗癌症患者中的应用疗效比常规治疗疗效更显著,治疗组不良反应的发生率低,干预效果更佳。集束化干预可确保最佳的实施策略,能明显改善医疗服务质量,值得推荐使用。
[1] 单 君,朱健华,顾艳荭.集束化干预理念及其临床应用的研究进展〔J〕.护士进修杂志,2010,25(10):72-74.
[2] 张 岚,宋婷婷,戴世英.集束化干预在护理中的应用研究进展〔J〕.护士进修杂志,2012,22(27):94-96.
[3] 谭景予,陈锦秀.呼吸机相关性肺炎集束化护理方案的制订与管理〔J〕.中华护理杂志,2011,46(7):731-733.
[4] 李洁琼,郭成,王学良,等.集束化护理策略在ICU患者压疮管理中的应用〔J〕.中国实用护理杂志,2012,28(15):36-37.
[5] 陈 婷,阮满真,黄海燕,等.ICU人工气道患者的集束化护理〔J〕.护理学杂志,2011,26(13):45-46.
[6] 卢年芳,郑瑞强,林 华,等.PiCCO指导下集束化治疗感染性休克的临床研究〔J〕.中华危重病急救医学,2014,26(1):23-27.
[7] 谭月英,徐慰婕,毛红梅.消化道肿瘤经皮内镜下胃造瘘术行肠内营养的观察与护理〔J〕.国际护理学,2011,30(4):523-524.
[8] 徐 馥.内镜下黏膜剥离术治疗早期胃癌的护理〔J〕.现代中西医结合杂志,2011,20(30):3873-3874.
[9] 胡文江,向良宏,沈小平,等.超声内镜联合内镜下黏膜剥离术诊治贲门癌前病变与早期癌症的应用〔J〕.实用临床医药杂志,2015,19(13):83-84,87.
[10] 中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜专业委员会.中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)〔J〕.中华消化内镜杂志,2014,31(7):361-377.
(编辑:吴小红)
·综述与讲座·
神经免疫机制在癌症疼痛中的研究进展
王海慧综述 王素匣审校
作者单位:400038 第三军医大学西南医院
关键词:癌症;移植物抗宿主病;神经免疫;疼痛
DOI:10.3969/j.issn.1001-5930.2016.10.051
免疫系统和神经系统在疼痛的过程中扮演着重要的作用,两者的相互作用均促使了疼痛的发展。在中枢和外周神经系统内存在多种与疼痛有关的卫星细胞和免疫细胞,如星形胶质细胞、小胶质细胞和巨噬细胞,其均对神经元功能有着很大的影响[1]。神经系统和免疫系统的相互作用不仅介导着机体炎性及神经性的疼痛的发生,而且与在癌症及其治疗过程疼痛的产生也密切相关。目前认为,引起癌症疼痛的主要原因包括化疗引起的周围神经病变(CIPN)、放射治疗的不良反应、持续性术后疼痛和疾病直接引起的疼痛[2-3]。在这些疼痛产生的过程中,免疫细胞介导的过程发挥着重大的作用。鉴于此,本文将从神经系统和免疫系统相互作用的视角综述两者在多种癌症疼痛中的作用,以期为癌症疼痛的治疗提供潜在的新型靶标,并改善癌症疼痛的管理。
1 神经免疫相互作用和原发性肿瘤引起的疼痛
传统观点认为引起癌症疼痛的主要原因是不断增长的肿瘤所导致的局部组织破坏和对神经纤维的直接压迫。然而,随着研究的不断深入,发现癌症疼痛具有独特的特征,其本质与其他普通疼痛不同[4-6]。在肿瘤的发展阶段,直接的生理效应和其与宿主环境的相互作用均会引起疼痛的产生。恶性细胞、免疫细胞、间叶细胞和内皮细胞均属于宿主衍生基质类型,其影响肿瘤的发展。在此过程中,常伴随着肿瘤浸润性淋巴细胞(TILs)的渗透。恶性细胞、肿瘤浸润性淋巴细胞和肿瘤基质细胞均能产生很多疼痛调节剂,并释放到肿瘤微环境中,促使着肿瘤与相邻细胞的相互作用,使肿瘤发生转移和扩散[7-8]。这些物质包括内皮素,α肿瘤坏死因子(TNFα),前列腺素,白细胞介素-1和白细胞介素-6,β转化生长因子(的TGFβ)和氢离子[9]。黑色素瘤、前列腺癌、甲状腺癌、胃癌、胰腺癌、肺癌和结肠癌等一些恶性肿瘤细胞均会释放神经元营养因子,如神经生长因子(NGF)、脑源性神经营养因子、神经营养蛋白3和神经营养蛋白4。这些物质进而影响肿瘤附近神经元的生长和神经的传递。因而疼痛的产生不仅是由肿瘤部位释放的物质导致,而且神经调节的出现进一步放大了疼痛的程度[10]。
2 癌症治疗过程中神经免疫对疼痛的影响
大多数肿瘤可以通过手术达到完全治愈或在一定时间内得到有效控制。外科手术所造成的组织破坏可以引起复杂和迅速的细胞免疫,从而促进伤口的快速愈合。免疫细胞如肥大细胞、皮肤树突细胞、嗜中性粒细胞和巨噬细胞等在手术微环境中大量繁殖,产生并释放大量的促炎介质和信号分子。这些介质具有促使循环细胞聚集到伤口部位,控制细胞增殖,引起术后急性疼痛[11]。表皮、真皮和深层结构布满大量传导痛觉冲动的神经纤维,这些无髓神经纤维在炎症区域充当外周传入疼痛传感器,接受信号分子如肿瘤坏死因子,白介素-1β和白介素-6的刺激。此外,小神经纤维通过释放神经肽比如P物质和降钙素基因相关肽直接放大手术部位细胞的变化,即所谓的神经源性炎症[12]。小神经纤维的传出和传入功能和伤口部位免疫细胞数量的相互作用影响急性疼痛的变化。急性疼痛随着伤口的愈合和免疫细胞消散而逐渐消失,然而一些患者仍然会出现术后持续性疼痛。在一些高风险的手术如胸廓切开术和截肢手术中,术后持续性疼痛的发生率大于50%[13]。急性疼痛向术后持续性疼痛的转换机理尚不十分清楚,但可以明确的是,神经免疫的相互作用在手术导致外周和中枢神经系统的调节的过程中发挥着重要的作用。手术部位感觉神经的损伤和炎症可以导致局部的神经过敏和异常的神经信号传输,这些神经持续性的异常信号传输可以导致脊髓和脑部中枢神经过敏[14],随后疼痛和非疼痛感觉神经的信号就会被放大,从而导致患者的疼痛感觉加剧。而在最初短时间内出现的神经元损伤和神经元基因表达的改变进一步增强了突触耦合和感觉神经的信号。
3 化疗所致外周神经病变(chemotherapy-induced peripheral neuropathy,CIPN)
使用细胞毒性化疗药物目前依然是治疗癌症的重要手段之一,然而这些药物会产生不良反应,其中常见的副反应是化疗所致周围神经病变(CIPN),最常见的临床表现为感觉障碍,如麻木,感觉异常或是刺痛[15]。使用的化疗剂、给药方案、一些合并症如糖尿病都能影响化疗所致周围神经病变的发生率。临床发现CIPN患者受损神经的周围会出现炎症反应,导致背根神经节的细胞群体发生改变,包括活化巨噬细胞的数量的增加,部分神经胶质细胞出现功能障碍;在严重情况下,脊髓内的小神经胶质细胞也可能出现功能障碍。这种细胞群体的变化会导致不正常的细胞信号以及与疼痛和细胞死亡相关的介质和基因的表达,比如神经生长因子的减少,白介素-1β、白介素-6、白介素-8、肿瘤坏死因子α水平的变化以及促凋亡基因的激活[16]。进一步的研究显示,免疫细胞参与化疗引起的周围神经病变,在化疗引起的周围神经病变动物模型和其它小纤维神经病变模型中,感觉神经周围的皮肤朗格汉斯细胞处于激活状态;在临床研究中,多种条件引起的小纤维神经病变患者的朗格汉斯细胞数量也有所增加,但这些抗原呈递细胞对CIPN的病理生理学的影响仍不清楚[17]。当前治疗CIPN相关疼痛的治疗对策是预防性治疗和对症治疗,其治疗效果均有限。未来的治疗方法可能是使用缓解神经炎症的药物。有报道指出静脉注射免疫球蛋白可缓解某些药物引起的CIPN的症状,表明免疫系统在缓解CIPN症状方面有一定的作用。
4 转移性骨肿瘤和相关的疼痛
乳腺癌细胞、前列腺癌细胞和肺癌癌细胞等向骨骼转移和扩散是比较常见的,很容易引起骨疼痛[18]。原发性骨肿瘤如骨髓瘤,骨肉瘤和尤文氏肉瘤也会引起严重的骨痛(CIBP)。癌症诱导的骨疼痛的病理和生理学很复杂,涉及炎症反应和神经性疼痛的发生,与此同时还与组织破坏和中枢神经化学变化有关。随着对癌症骨痛机理的认识的慢慢深入,引起癌症骨痛的多方面因素也慢慢清晰。研究显示,生长的肿瘤使骨膜解剖结构和局部组织的破坏、感觉神经支配的改变以及促炎症信号分子的释放在癌症骨痛的发生过程中发挥着协同作用[19-20]。骨微环境为肿瘤细胞提供了一个良好的环境,在这个环境中,肿瘤细胞释放的信号蛋白如核因子κB受体活化因子及其配体、白细胞介素1、白细胞介素6和TGF-β诱导破骨细胞分化和活化,增加骨质破坏及生长因子和离子钙的释放,这些都可以促进转移部位肿瘤的生长。随着肿瘤的生长,皮质骨受到破坏,相关的骨膜也会发生炎症反应破坏。在骨髓、皮质和骨膜上存在丰富的初级传入神经,其作为感受器,具有重要的调节作用。肿瘤部位的神经纤维出现病理性出芽和重组,同样可以观察到神经瘤样结构的形成,这一过程受到肿瘤基质细胞分泌的神经生长因子的刺激,在癌症骨痛小鼠模型中,给予神经生长因子特异性抗体后,这一过程受到明显的减弱[21-22]。此外,一些促痛觉过敏介质可以敏化神经,降低兴奋阈值。破骨细胞、原始细胞、肿瘤相关免疫细胞及免疫细胞释放的前列腺素、内皮素、缓激肽、肿瘤坏死因子-α(TNF-α)、转化生长因子-β(TGF-β)、白细胞介素-1(IL-1)和白细胞介素-6(IL-6)均汇集在转移瘤部位。破骨细胞和转移瘤细胞进一步通过刺激感觉神经元及其纤维表达的瞬时受体电位香草酸受体1(TRPV1) 进一步加重疼痛。在骨转移癌患者的背根神经节和脊髓背角中的神经细胞和支持细胞会出现明显的重组。免疫组化研究显示在癌症骨痛模型动物中,背根神经节中的环腺苷酸依赖性转录因子(ATF-3,神经元损伤的标志物)的水平上调,脊髓背角中的C-Fos蛋白(神经元活性的标志物)的表达增加[23]。神经元表面的钠离子通道Nav 1.8表达的增加促进了背根神经节中神经元兴奋状态的改变。进一步的研究表明,骨转移癌疼痛患者的脊髓背角胶状质内兴奋性纤维突触发生独特的变化,导致脊髓敏感化,痛觉调制和痛觉传递改变。
5 癌症骨痛中与神经免疫作用相关的治疗靶点
尽管发现了多个潜在的治疗靶点,然而自阿片类药物引入到临床,对癌症骨痛的管理并没有明显的改善。生物药物比如狄诺塞麦,一种单克隆抗体,特异性的抑制核因子κB受体活化因子及其配体,在治疗癌症骨痛的临床试验中取得令人满意的效果。以神经生长因子(NGF)为靶点的尼珠单抗(tanezumab),被证实可以减少癌症骨痛模型动物中伤害性感受器发芽,在Ⅱ期临床试验中评价也得到证实[24]。
总之,随着对癌症及癌症疼痛的了解越来越深入,从分子和细胞水平阐明肿瘤细胞与宿主免疫和神经系统之间的密切联系显得愈发重要[25]。释放到肿瘤微环境中的可溶性介质促进了肿瘤的生长和扩散,并产生癌症疼痛,常见的信号通路,信号分子和细胞类型参与了这一病理过程,从而导致了肿瘤的发展和转移,以及癌症疼痛的产生[26]。此外,过去的观点认为,化疗引起的周围神经病变、原发肿瘤疼痛、持续性术后疼痛是由不同的病理过程引起,然而现在的研究证实这些疼痛的产生与神经免疫之间的相互作用有极大的相似性,但不同类型的癌症疼痛还是有不同之处[27]。随着对癌症生物学的研究,新的靶向治疗手段得以发展和应用,但同时,新的癌症疼痛也随之出现了。毫无疑问,一些单克隆抗体生物药物在癌症治疗中发挥了很大的作用,但这些药物也被证实与一部分患者产生的肌肉疼痛有关。然而,随着更多的靶向治疗被引入到临床实践中,更多新型的癌症疼痛可能也会出现[28-29]。
参考文献
[1] nman KS,Francis AA,Murray NR.Complex role for the immune system in initiation and progression of pancreatic cancer 〔J〕.World J Gastroenterol,2014,20(32):11160-11181.
[2] Gewandter JS,Fan L,Magnuson A,et al.Falls and functional impairments in cancer survivors with chemotherapy-induced peripheral neuropathy (CIPN):a University of Rochester CCOP study〔J〕.Support Care Cancer,2013,21(7):2059-2066.
[3] Bolind AM.Development of an analytical theory to describe the PNAR and CIPN nondestructive assay techniques〔J〕.Ann Nucl Energy,2014,66(5):167-176.
[4] Bhatnagar B,Gilmore S,Goloubeva OG,et al.Dose reduction (DR) due to chemotherapy induced peripheral neuropathy (CIPN) in breast cancer (BC) patients (pts) in the neoadjuvant/adjuvant settings〔J〕.J Clin Oncol,2013,31(15):1904-1911.
[5] Gabriela T,Serena M,Camilla F,et al.Novel therapeutic strategy to prevent chemotherapy-induced persistent sensory neuropathy by TRPA1 blockade〔J〕.Cancer Res,2013,73(10):3120-3131.
[6] Pachman DR,Loprinzi CL,Axel G,et al.The search for treatments to reduce chemotherapy-induced peripheral neuropathy〔J〕.J Clin Invest,2014,124(1):72-74.
[7] Khasabova IA,Holman M,Morse T,et al.Increased anandamide uptake by sensory neurons contributes to hyperalgesia in a model of cancer pain〔J〕.Neurobiol Dis,2013,58(10):19-28.
[8] Tarin D.Role of the host stroma in cancer and its therapeutic significance〔J〕.Cancer Metastasis Rev,2013,32(3-4):553-566.
[9] Hiraga T.Molecular mechanisms of bone cancer pain〔J〕.Clin Calcium,2014,24(8):1185-1191.
[10] Xia Q,Chen L.Cellular and molecular mechanisms of perineural Invasion in gastric cancer〔J〕.Zhonghua Wei Chang Wai Ke Za Zhi,2015,18(2):198-200.
[11] Eming SA,Paul M,Marjana TC.Wound repair and regeneration:me-
chanisms,signaling,and translation〔J〕.Sci Transl Med,2014,6(265):265sr6.
[12] Rosenkranz MA,Davidson RJ,Maccoon DG,et al.A comparison of -
mindfulness-based stress reduction and an active control in modulation of neurogenic inflammation.〔J〕.Brain Behav Immun,2013,27(1):174-184.
[13] Schmidt PC,Gabriela R,Mackey SC,et al.Perioperative gabapentinoids:choice of agent,dose,timing,and effects on chronic postsurgical pain〔J〕.Anesthesiology,2013,119(5):1215-1221.
[14] 鲁树茂,张西强,黄 楹.大型中枢神经细胞瘤小切口手术探讨〔J〕.中国现代神经疾病杂志,2014,14(1):1672-1673.
[15] 陈晓博,曹 鹏,于 锋,等.温度敏感瞬时受体电位通道参与化疗引起的外周神经病变的研究进展〔J〕.药学与临床研究,2014,22(2):144-148.
[16] 张晋彬.化疗所致周围神经炎的原因分析及护理对策〔J〕.中国药物与临床,2014,14(10):1459-1460.
[17] 渠胜英,施晓红.免疫细胞因子在2型糖尿病周围神经病变大鼠血清中的表达〔J〕.中国糖尿病杂志,2014,22(3),1006-1007.
[18] 崔青山.骨癌疼痛的原因、后果及治疗时机〔J〕.中国疼痛医学杂志,2014,20(4):196-197.
[19] Cleeland CS,Jean-Jacques B,Alison S,et al.Pain outcomes in patients with advanced breast cancer and bone metastases:results from a randomized,double-blind study of denosumab and zoledronic acid 〔J〕.Cancer,2013,119(4):832-838.
[20] 全柳霞,张 菊,万年亮.转移性骨肿瘤患者的临床特点研究〔J〕.实用癌症杂志,2014,29(7):876-878.
[21] 李 伟,曹 亮,盛 俊,等.射频消融术治疗骨转移瘤回顾性研究〔J〕.武警医学,2014,25(7):690-692.
[22] Kim SY,陈 文.初级感觉神经元中枢端TRPV1敏化及其参与慢性痛机制〔J〕.中国疼痛医学杂志,2014,20(10):693-693.
[23] 彭洪薇,师锐赞,袁向飞,等.乳腺癌耐药细胞中c-fos抗凋亡作用的研究〔J〕.中国癌症杂志,2014,24(8):581-588.
[24] Abdiche YN,Malashock DS,Pons J.Probing the binding mechanism and affinity of tanezumab,a recombinant humanized anti-NGF monoclonal antibody,using a repertoire of biosensors〔J〕.Protein Science,2008,17(8):1326-1335.
[25] 姚汝铖,郑 军.转化生长因子-β信号通路诱导的上皮间充质转化与恶性肿瘤的关系〔J〕.实用医学杂志,2013,29(13):2227-2229.
[26] 胡 岳,王 涌,邱江锋.组织型转谷氨酰胺酶在肿瘤发生、发展、侵袭和转移中的作用及其作用机制的研究进展〔J〕.肿瘤,2013,33(9):831-836.
[27] 钟 易,胡 胜.癌症免疫治疗和靶向治疗的相互作用〔J〕.中国肿瘤,2014,23(11):934-938.
[28] Marabelle Aurélien,Gray Juliet.Tumor-targeted and immune-targeted monoclonal antibodies:Going from passive to active immunotherapy〔J〕.Pediatr Blood Cancer,2015,62(8):1317-1325.
[29] Aubin F,Carbonnel F,Wendling D.The complexity of adverse side-effects to biological agents〔J〕.J Crohns Colitis,2013,7(4):257-262.
(收稿日期 2015-11-04 修回日期 2016-04-05)
(编辑:甘 艳)
Application of Cluster Intervention in Endoscopic Treatment of Cancer Patients
ZENGTing.
TheFirstHospitalofWuhan,Wuhan,430022
Objective To study the effect of cluster intervention in the endoscopic treatment of cancer patients.Methods
Cluster intervention;Endoscopic therapy;Cancer
430022 武汉市第一医院
10.3969/j.issn.1001-5930.2016.10.050
R735
A
1001-5930(2016)10-1734-03
2015-12-07
2016-06-20)
文献标识码:B
1001-5930(2016)10-1737-03
84 cancer patients were selected,according to the random number table were divided into 2 groups,the conventional group (42 cases) and the treatment group(42 cases).The conventional group received routine care,the treatment group received cluster nursing intervention treatment.Results In the conventional group,take off the tube was 2 cases,skin infection 3 cases,gastrointestinal adverse reactions 4 cases;in the treatment group,take off the tube was 1 case,skin infection 2 cases, gastrointestinal adverse reactions 1 case;In the conventional group,conventional injection point hemorrhage was 3 cases,ectopic embolism 4 cases, liver failure 1 case,late-onset hemorrhage 3 cases;in the treatment group,injection point bleeding was 1 case, ectopic embolism 2 cases, liver failure 1 case,late-onset hemorrhage 2 cases;total incidence of adverse reactions of the conventional group (47.6%) was significantly higher than that of the treatment group (23.8%),P<0.05,the difference was statistically significant.The effective rate of the treatment group(73.8%) was significantly higher than that of the conventional group (54.8%),P<0.05,and the difference was statistically significant.Conclusion Cluster intervention in the endoscopic treatment of cancer patients has more significant efficacy than the conventional treatment.

