血清S100A8和S100A9对原发性肝癌的临床诊断价值
邓 丹 李远发 陈瑞红 冯 庆 彭 为
血清S100A8和S100A9对原发性肝癌的临床诊断价值
邓 丹 李远发 陈瑞红 冯 庆 彭 为
目的 探讨原发性肝癌患者血清S100A8和S100A9的表达水平及其与临床病理特征的相关性。方法 收集原发性肝癌患者共90例,同期选择在我院进行体检健康者50例作为对照组;检测2组血清S100A8和S100A9的水平;分析肝癌患者血清S100A8和S100A9水平与临床病理特征的相关性;比较随访期间死亡组与存活组患者血清S100A8和S100A9表达。结果 与对照组比较,肝癌组患者血清S100A8和S100A9均显著升高(P<0.01)。肝癌患者血清S100A8和S100A9的高表达与患者的年龄、性别、大小、病理分型无关(P>0.05),而与TNM分期、分化程度、淋巴结转移以及血行转移有关(P<0.01)。所有患者6个月定期随访,31例死亡,59例存活;死亡组患者入院时血清S100A8和S100A9表达均显著高于存活组,差异有统计学意义(P<0.01)。结论 原发性肝癌患者血清S100A8和S100A9水平均显著升高,与肝癌的恶性程度关系密切,有望成为原发性肝癌预后的重要评判指标。
原发性肝癌;S100A8;S100A9;相关性
(ThePracticalJournalofCancer,2016,31:1597~1600)
原发性肝细胞癌为最常见的恶性肿瘤之一,调查显示,其发生率列全球第6位,病死率位居第3位,每年全球约50%的原发性肝癌发生在我国,其病死率为恶性肿瘤病死率的第2位[1-2]。原发性肝癌具有恶性度高、发病隐匿等特点,大部分患者在确诊或治疗时已是疾病晚期,已伴有肝内或淋巴转移,因此预后很差[3]。因此,探寻原发性肝癌的早期诊断标志物或其转移机制,并给予有效治疗是目前临床提高患者生存率的重要途径[4]。
S100A9为钙结合蛋白,是S100蛋白家族成员之一,常与S100A8形成异二聚体,又被称为钙卫蛋白。研究发现,S100A8和S100A9在炎症引起的肿瘤组织中表达上调,目前已证实的肿瘤包括结肠癌、胃癌、胰腺癌、卵巢癌、甲状腺癌以及皮肤癌等[5]。基因和蛋白质组研究表明S100A8和S100A9在原发性肝癌组织中高表达,且与肝癌的恶性程度密切相关[6-7]。然而,对于其在原发性肝癌患者血清中的表达水平及与临床病理参数的相关性尚未见报道。本研究对90例原发性肝癌患者血清中S100A8和S100A9水平进行检测,分析两者与原发性肝癌临床病理特征的相关性以及对其临床治疗预后的评估价值。
1 资料与方法
1.1 一般资料
收集本院肿瘤科2012年5月-2014年5月收治的原发性肝癌患者共90例,同期选择在我院进行体检健康者50例作为对照组。肝癌组90例患者中男性69例,女性21例;年龄33~68,平均(51.44±6.81)岁;≤45岁者56例,>45岁者34例;按照2002年国际抗癌联盟(UICC)肝癌诊断与分期标准制定[8];肝细胞型71例,胆管细胞型13例,混合型6例;临床分期:Ⅰ+Ⅱ期27例,Ⅲ+Ⅳ期63例;有淋巴结转移52例,无淋巴结转移38例;分化程度:高、中分化51例,低分化39例;血行转移55例,无血行转移35例。
1.2 病例纳入和排除标准
纳入标准:①符合原发性肝癌诊断标准;②年龄20~70岁;③检测前均未接受手术、放化疗以及其他生物治疗者;④首次确诊者;⑤所有患者或患者家属知情,且签署同意书。排除标准:①合并心、脑、肝、肾等系统严重原发性疾病者;②妊娠或哺乳期女性;③不配合随访者;④合并其他器官肿瘤病史者。
1.3 血清S100A8和S100A9水平测定
晨起空腹抽取所有研究对象静脉血约4 ml,血样室温静置30 min,离心15 min,分离血清,-70 ℃冰箱保存;应用酶联免疫吸附(Elisa)法检测,试剂盒均由上海北诺生物科技有限公司提供。
1.4 分析指标
①肝癌组和对照组血清S100A8和S100A9水平比较;②分析肝癌患者血清S100A8和S100A9表达与患者的性别、年龄以及肿瘤病理分型、大小、TNM分期、分化程度、淋巴结转移以及血行转移等临床病理参数间的相关性。③对所有患者给予6个月的治疗,后定期随访,记录死亡病例。
1.5 统计学方法
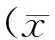
2 结果
2.1 2组血清S100A8和S100A9水平比较
与对照组比较,肝癌组患者血清S100A8和S100A9均显著升高,比较差异有统计学意义(P<0.01),见表1。

表1 2组血清S100A8和S100A9水平比较
2.2 血清S100A8和S100A9的表达与肝癌临床病理参数间的相关性
血清S100A8和S100A9的高表达与肝癌患者的年龄、性别、大小、病理分型无显著相关(P>0.05),而与TNM分期、分化程度、淋巴结转移以及血行转移呈显著性相关(P<0.01),见表2。

表2 血清S100A8和S100A9水平与肝癌临床病理参数间的相关性±s)
2.3 死亡组和存活组患者血清S100A8和S100A9的表达比较
所有患者6个月定期随访发现:31例死亡,59例存活;死亡组患者入院时血清S100A8和S100A9表达均显著高于存活组,比较差异有统计学意义(P<0.01),见表3。

表3 死亡组和存活组患者血清S100A8和S100A9的表达比较
3 讨论
近年,原发性肝癌的诊疗、预防均取得较大进展;然而临床调查显示,该病目前的5年期生存率不足50%,转移和复发仍为原发性肝癌患者预后差的主要原因[9]。因此,探寻其他新的原发性肝癌分子标志物,加强对该病转移分子机制研究,仍是当前临床研究急需解决的重要医学问题。血清生物学标志物是近年广泛应用于各种肿瘤诊断的重要方法,具有特异性强和敏感性好等特点,且操作便捷[10]。目前,已探明的原发性肝癌血清生物学标志物如甲胎蛋白(AFP)[11]、联合高尔基体蛋白73(GP73)[11]、肿瘤坏死因子-α(TNF-α)[12]、胸苷激酶1(TK1)[13]、分泌型蛋白Dickkopf-1(DKK1)[14]等。然而,以上指标仅为原发性肝癌的某方面的特性,灵敏性较弱,不能满足原发性肝癌发病机制日益复杂的需求。
S100A9属钙结合蛋白S100蛋白的家族成员,S100A9在不同恶性肿瘤中发挥不同的生物学效应;其中一种情况是S100A9与大部分肿瘤的发生、发展、浸润以及转移等密切相关,在上述肿瘤中其呈高表达,故有促癌作用[15]。此外,S100A9在一些恶性肿瘤如喉癌、食管癌、宫颈癌中呈低水平表达,具有抑制肿瘤生长的作用[15]。免疫组织化学检测结果显示,S100A9蛋白在原发性肝癌组织中表达上调,且对其存活和侵袭等起促进作用[16]。本研究结果发现,肝癌组患者血清S100A9均显著升高(P<0.01);血清S100A9的高表达与肝癌患者的年龄、性别、大小、病理分型无显著性差异(P>0.05),而与TNM分期、分化程度、淋巴结转移以及血行转移呈显著性相关,比较差异有统计学意义(P<0.01);死亡组患者入院时血清S100A9表达均显著高于存活组,比较差异有统计学意义(P<0.01)。因此,结果提示血清S100A9水平可能与原发性肝癌的浸润、转移以及临床治疗预后等密切相关。
S100A8也为S100 蛋白家族成员,常易与S100A9 形成异二聚体复合物;S100A8与一些肿瘤的发生发展、浸润以及转移相关,在以上肿瘤中S100A8呈水平表达,如包括胃癌、结肠癌、膀胱癌、甲状腺癌以及乳腺癌等[17]。研究发现,在原发性肝癌病程中,S100A8基因呈高水平表达[18]。本研究结果显示:肝癌组患者血清S100A8均显著升高(P<0.01);血清S100A8的高表达与肝癌患者的年龄、性别、大小、病理分型无显著性差异(P>0.05),而与TNM分期、分化程度、淋巴结转移以及血行转移呈显著性相关,比较差异有统计学意义(P<0.01);死亡组患者入院时血清S100A8表达均显著高于存活组,比较差异有统计学意义(P<0.01)。因此,结果提示血清S100A8水平与原发性肝癌的恶性程度以及临床治疗预后等密切相关。
综上所述,原发性肝癌患者血清S100A8和S100A9水平显著增高,且与肝癌临床病理参数TNM分期、分化程度、淋巴转移以及血行转移呈显著性相关,有望成为评价该病临床治疗预后的重要标志物。
[1] 丁 轶,刘 瑛,陈 斌,等.miR-106b 在原发性肝癌中的表达及与预后的关系〔J〕.广东医学,2014,35(13):2019-2022.
[2] Song P,Feng X,Zhang K,et al.Screening for and surveillance of high-risk patients with HBV-related chronic liver disease:promoting the early detection of hepatocellular carcinoma in China〔J〕.Biosci Trends,2013,7(1):1-6.
[3] Xiu P,Dong XF,Li XP,et al.Clusterin:Review of research progress and looking ahead to direction in hepatocellular carcinoma〔J〕.World J Gastroenterol,2015,21(27):8262-8270.
[4] Singal AG,El-Serag HB.Hepatocellular carcinoma from epidemiology to prevention:translating knowledge into practice〔J〕.Clin Gastroenterol Hepatol,2015,S1542-3565(15):1113-1121.
[5] Geetha Srikrishna.S100A8 and S100A9:New insights into their roles in malignancy〔J〕.J Innate Immunity,2012,4(1):31-40.
[6] Wu R,Duan L,Cui F,et al.S100A9 promotes human hepatocellular carcinoma cell growth and invasion through RAGE-mediated ERK1/2 and p38 MAPK pathways〔J〕.Exp Cell Res,2015,334(2):228-238.
[7] Kapanadze T,Gamrekelashvili J,Ma C,et al.Regulation of accumulation and function of myeloid derived suppressor cells in different murine models of hepatocellular carcinoma〔J〕.J Hepatol,2013,59(5):1007-1103.
[8] International Union Against Cancer.TMN classification of malignant tumours〔M〕.6th ed.NewYork(NY):Wiley,2002:102.
[9] Liu Y,Zhang JB,Qin Y,et al.Prox1 promotes hepatocellular carcinoma metastasis by way of up-regulating hypoxia-inducible factor 1α expression and protein stability〔J〕.Hepatology,2013,58(2):692-705.
[10] 李谨峰,林 川.血清肿瘤标志联合检测对原发性肝癌诊断价值的探讨〔J〕.中华肿瘤防治杂志,2010,17(11):877-879.
[11] Zhao J,Guo LY,Yang JM,et al.Sublingual vein parameters,AFP,AFP-L3,and GP73 in patients with hepatocellular carcinoma〔J〕.Genet Mol Res,2015,14(2):7062-7067.
[12] Xu P,Sun Z,Wang Y,et al.Long-term use of indomethacin leads to poor prognoses through promoting the expression of PD-1 and PD-L2 via TRIF/NF-κB pathway and JAK/STAT3 pathway to inhibit TNF-α and IFN-γ in hepatocellular carcinoma〔J〕.Exp Cell Res,2015,337(1):53-60.
[13] Zhang SY,Lin BD,Li BR.Evaluation of the diagnostic value of alpha-l-fucosidase,alpha-fetoprotein and thymidine kinase 1 with ROC and logistic regression for hepatocellular carcinoma〔J〕.FEBS Open Bio,2015,5:240-244.
[14] Kim SU,Park JH,Kim HS,et al.Serum dickkopf-1 as a biomarker for the diagnosis of hepatocellular carcinoma〔J〕.Yonsei Med J,2015,56(5):1296-1306.
[15] 杨真真,李 勇.消化系统恶性肿瘤中S100A9 的研究进展〔J〕.广东医学,2013,34(22):3510-3514.
[16] 武 睿,周 兰,崔 鲂.S100A9促进肝癌细胞HepG2的存活与侵袭依赖于RAGE〔J〕.中国生物工程杂志,2015,35(5):8-14.
[17] Mie Iehikawa,Roy Williams,Ling Wang,et al.S100A8/A9 activate key genes and pathways in colon tumor progression〔J〕.Mol Cancer Res,2011,9(2):133-148.
[18] Wilson CL,Jurk D,Fullard N,et al.NFκB1 is a suppressor of neutrophil-driven hepatocellular carcinoma〔J〕.Nat Commun,2015,6:6818.
(编辑:甘 艳)
Analysis of Diagnostic Value of Serum Levels S100A8 and S100A9 for Hepatocellular Carcinoma
DENGDan,LIYuanfa,CHENRuihong,etal.
XiantaoFirstPeople'sHospital,Xiantao,433000
Objective To investigate serum levels of S100A8 and S100A9 of hepatocellular carcinoma and its correlation with clinicopathological characteristics.Methods 90 cases of hepatocellular carcinoma were selected,and 50 healthy patients were the control group.Serum levels of S100A8 and S100A9 in hepatocellular carcinoma group and the control group were detected.Correlation of serum levels of S100A8 and S100A9 in hepatocellular carcinoma and clinicopathological characteristics was analyzed.Serum levels of S100A8 and S100A9 between death group and survival group were compared.Results Compared to the control group,serum levels of S100A8 and S100A9 of hepatocellular carcinoma obviously increased(P<0.01).Serum levels of S100A8 and S100A9 in hepatocellular carcinoma were no correlated with age,gender,size,and pathological type(P>0.05),but were correlated with TNM stage,differentiation degree,lymph node metastasis,and hematogenous metastasis(P<0.01).After follow up of 6 months,there had 31 death and 59 survival,and serum levels of S100A8 and S100A9 in death group were remarkably higher than those of survival group,there had statistical difference(P<0.01).Conclusion Serum levels of S100A8 and S100A9 of hepatocellular carcinoma obviously increased,and are closely related with malignancy grade of hepatocellular carcinoma,and it could be important indicator for prognosis of hepatocellular carcinoma.
Hepatocellular carcinoma;S100A8;S100A9;Correlation
433000 湖北省仙桃市第一人民医院
10.3969/j.issn.1001-5930.2016.10.009
R735.7
A
1001-5930(2016)10-1597-04
2015-11-04
2016-04-05)

