PCV2与PRRSV体外共感染对肺泡巨噬细胞系炎症反应的影响
石 坤,魏建超,邱亚峰,张克龙,李宗瑞,刘茜倩,李蓓蓓,刘 珂,邵东华,陈立志,马志永
(1.中国农业科学院特产研究所,长春 130117;2.中国农业科学院上海兽医研究所,上海 200241)
PCV2与PRRSV体外共感染对肺泡巨噬细胞系炎症反应的影响
石坤1,2,魏建超2,邱亚峰2,张克龙2,李宗瑞2,刘茜倩2,李蓓蓓2,刘珂2,邵东华2,陈立志1,马志永2
(1.中国农业科学院特产研究所,长春 130117;2.中国农业科学院上海兽医研究所,上海 200241)
为了探讨猪圆环病毒2型(Porcine circovirus type 2,PCV2)与猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)共感染后调控炎症反应的机制,选用稳定表达CD163的PAM细胞系3D4/21,分别设PCV2、PRRSV、PCV2+PRRSV(接种PCV2后12 h接种PRRSV)共感染组和对照组,利用间接免疫荧光检测(indirect immuno fluorescene assay,IFA)方法检测PCV2和PRRSV在PAM-CD163上的阳性率,采用RT-PCR检测IL-6、IL-8、IL-1β、IL-10表达量的动态变化。结果显示PCV2和PRRSV均能感染PAM-CD163;PCV2单独感染PAM-CD163,早期促进了IL-6、IL-8、IL-1β的表达,晚期促进IL-10表达;PRRSV单独感染PAM-CD163能在晚期促进IL-1β、IL-10的表达;与PCV2单独感染PAM-CD163相比,PCV2+PRRSV共感染促进了IL-10表达并且持续增加;与PRRSV单独感染PAM-CD163相比,PCV2+PRRSV共感染促使IL-6、IL-8、IL-1β的表达量较早出现增加,并且持续增加。可见两种病毒之间存在一定的相互作用,共同调节机体免疫系统。本研究结果有助于解析PRRSV与PCV2共感染调控炎症反应的机理。
猪圆环病毒2型;猪繁殖与呼吸综合征病毒;共感染;PAM-CD163;细胞因子
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)感染引起的,以母猪发热、厌食、早产、流产、死胎、弱仔等繁殖障碍及各种年龄猪的呼吸系统疾病和高死亡率为特征。现在PRRS已成为世界性疾病,给世界养猪业造成了巨大的经济损失[1],在我国也呈蔓延趋势。PRRSV 感染后导致严重的间质性肺炎,提示炎症反应在 PRRSV 的致病和组织损伤中具有十分重要的作用[2]。圆环病毒2型(Porcine circivirus type 2,PCV2)是断奶仔猪多系统衰竭综合征(post weaning multisystemic wasting syndrome,PMWS)的主要病原体[3]。PCV2和PRRSV混合感染与PCV2单独感染相比,出现了严重的增生性间质性肺炎,损伤严重的绝大数组织细胞中可以检测到PCV2和PRRSV抗原[4]。同时PCV2和PRRSV均能通过激活NF-κB信号通路促进炎性细胞因子的表达[5,6]。通过之前对PCV2流行病学调查和我们对上海市猪场疫病检测结果表明,PCV2分布极为广泛,并且多为混合感染,其中PCV2与 PRRSV的混合感染在PCV2阳性猪中占很大比例,在猪群中更加剧了规模化猪场疫病的复杂性[7]。猪肺泡巨噬细胞(porcine alveolar macrophage,PAM)是PCV2与 PRRSV共同的靶细胞,并且是肺部免疫最早接触病原微生物的免疫防御细胞之一,在猪执行天然免疫和特异性免疫时起重要功能[8]。本研究采用稳定表达CD163的PAM细胞系3D4/21,观察两种病毒在该细胞中的增殖规律,并检测细胞因子IL-6、IL-8、IL-1β、IL-10的mRNA水平,从而分析PRRSV和PCV2共感染对PAM的炎症反应的影响。
1 材料与方法
1.1毒株、质粒和细胞PCV2 SH株由本实验室分离并保存,TCID50为10-5/mL;PRRSV JX1株由本实验室保存,TCID50为10-6.8/mL;PCV2和PRRSV阳性质粒和PAM-CD163细胞系由上海兽医研究所茅翔研究员惠赠。
1.2主要试剂质粒小提快速试剂盒购自Omega公司;Trizol、Primes STAR HS DNA聚合、快速反转录试剂、viral RNA/ DNA extraction Kit和SYBR®Green Real-time PCR Master Mix盒均购自TaKaRa公司;胶回收试剂盒购自天根公司;RPMI1640、胎牛血清和胰酶购于Gibco公司;羊抗猪二抗和羊抗小鼠二抗购自Invitrogen公司;DAPI染料购自Sigma公司。
1.3实验设计在12孔细胞板上接种PAM-CD163,接种细胞量为2.5×105/孔。分为4组,分别为PCV2单独感染、PRRSV单独感染、PCV2+PRRSV共感染(先接种PCV2,12 h后接种PRRSV)以及空白对照组。各组要求接种1MOI的PCV2和PRRSV,空白对照组接种等体积的细胞培养液。分别在感染后24、36、48、60 h检测每组中两种病毒滴度、各种细胞因子的mRNA动态水平。
1.4间接免疫荧光法(indirect immunofluorescene assay,IFA)检测PCV2和PRRSV用4%多聚甲醛于4℃固定细胞,加入PCV2阳性猪血清或者PRRSV的N蛋白单抗,37℃作用30 min,PBS洗3次,每次5 min;加入羊抗猪荧光二抗或者FITC-羊抗小鼠荧光二抗,37℃作用30 min,PBS洗3次,每次5 min;DAPI染色10 min于室温,PBS洗3次,每次5 min;荧光显微镜下观察。
1.5SYBR Green实时RT-PCR法检测细胞因子mRNA的变化按Trizol试剂盒说明书提取细胞总mRNA,用实验室已建立的实时RT-PCR定量检测,检测结果通过管家基因GAPDH校正,用2-△△Ct法与空白对照组作相对定量比较。
1.6数据统计对获得每组检测样品中细胞因子及看家基因Ct值,应用2-△△Ct法对各组细胞因子进行比较,并进行t-检验差异分析。
2 结果
2.1PCV2和PRRSV检测时间点的确定在感染PCV2和PRRSV的12、24、36、48 h后,用IFA分别检测各组PCV2和PRRSV的感染情况,结果显示,与24、36 h和对照组相比,PCV2单独感染组中,PCV2感染48 h后阳性率最高,病毒主要均匀分布在胞浆和胞核内,见图1B。PCV2 +PRRSV混合感染组48 h 时,PCV2阳性率最高,并且荧光强度更强,见图1C。PCV2单独感染组中,病毒感染后36 h,感染率有所增加,见图1B。PCV2 +PRRSV混合感染组中,病毒感染24 h后,出现PCV2感染的阳性细胞,见图1B。PRRSV单独感染组中,PRRSV感染24 h后阳性细胞率开始增加,36 h时达到最大,48 h时PRRSV阳性细胞率又开始减少,见图1A。PCV2 +PRRSV混合感染组中病毒感染后的24、36、48 h 中PRRSV阳性细胞持续增加。
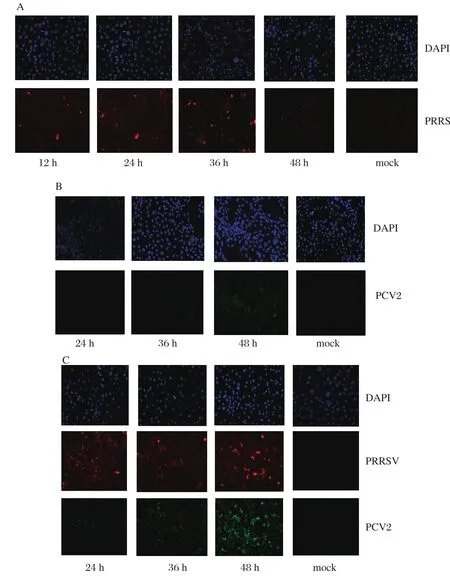
图1 PCV2(A),PRRSV(B)和PCV2+PRRSV(C)感染PAM-CD163的间接免疫荧光检测Fig. 1 PCV2 (A), PRRSV(B) and PCV2+PRRSV(C) detection in PAM-CD163 by IFA
2.2相对定量PCR检测细胞因子IL-6、IL-8、IL-1β、IL-10的mRNA的表达PCV2与PRRSV单独感染均可刺激IL-6、IL-8、IL-1β、IL-10的表达。PRRSV单独感染PAM-CD163组中,在晚期IL-1β、IL-10的表达量迅速上升;PCV2单独感染PAM-CD163时,细胞因子IL-6、IL-8、IL-1β持续大量表达,感染后期IL-10表达量显著增加。与PCV2单独感染PAM-CD163相比,PCV2/PRRSV共感染促进了IL-10表达并且持续增加;与PRRSV单独感染PAM-CD163相比,PCV2/PRRSV共感染促使IL-6、IL-8、IL-1β的表达量较早出现增加,并且持续增加。

图2 不同时间点各感染组中IL-6、IL-8、IL-10、IL-1βmRNA的检测结果(*P<0.05,**P<0.01)Fig. 2 Effects of PCV2 and/or PRRSV infection on the secretion of IL-6,IL-8,IL-10,IL-1β mRNA in PAMCD163 at different points post infection(*P<0.05,**P<0.01)
3 讨论
大量流行病学研究表明,PCV2与其他病原体混合感染是造成养猪业严重损失的重要因素。其中PCV2与 PRRSV的混合成为PMWS的常见病原,并且呈上升趋势。2001年美国的流行病学调查显示,两种病毒的混合感染率为60%[7],在荷兰有PMWS临床症状的猪场中PRRSV和PCV2的混合感染率高达83%,无PMWS症状的猪群中PRRSV和PCV2的混合感染率为35%[8]。我国华东地区PRRSV和PCV2的混感率达47.7%[9]。同时两种病毒感染均能引起免疫抑制,增强机体对多种病原体易感性,引起严重的临床症状[10]。
PAM能够抵御各种病原体的感染,是肺脏初级防御中的重要细胞,同时又是PCV2与 PRRSV 共同的靶细胞[11]。研究发现PRRSV最显著的作用是破坏PAM,减少肺内PAM的数量,同时感染后期刺激PAM分泌大量细胞因子介导炎症反应。本研究IFA结果显示PCV2和PRRSV均能感染PAM-CD163,并且能持续感染。PCV和PRRSV混合感染可造成PAM大量死亡,破坏肺部的初级防御系统,为两种病毒的扩散和疾病的发展提供了有利的条件。IL-6、IL-8、IL-1β均是重要的促炎性反应细胞因子,在病毒感染中致炎过程中扮演着十分重要的角色。IL-6连同与促炎性细胞因子IL-1β一起产生。IL-6通常在机体急性反应的情况下被诱导,参与调节炎症反应[12]。IL-8也称CXCL8,是一种促炎性CXC家族的趋化因子家族中一员,其趋化活性最强,对中性粒细胞、嗜酸性粒细胞和T淋巴细胞有强烈趋化作用,在炎症反应和免疫调节中起重要作用[13]。IL-1β是一种主要由巨噬细胞、单核细胞、淋巴细胞共同产生的促炎性细胞因子,是机体调节免疫和炎症反应的中心介质,能介导多种炎症反应,诱导致炎性细胞因子的基因表达及分泌[14]。IL-10是一种重要的免疫抑制因子,抑制单核细胞介导的促炎因子,如IL-1β、IL-6、IL-8、TNF-α和巨噬细胞刺激因子,IL-10在肺部炎症中是主要的调节者,但IL-10过量表达能抑制机体免疫反应和削弱对病原微生物的清除能力[15]。本研究中,PRRSV单独感染时IL-1β、IL-10后期表达量显著增加;PCV2单独感染时,IL-6、IL-8、IL-1β表达量持续增显著加;PCV2 /PRRSV共感染时,IL-6、IL-8、IL-1β表达量较PCV2单独感染有所减少,IL-10表达量比PRRSV单独感染时减少。可能是促炎因子IL-6、IL-8、IL-1β与免疫抑制因子IL-10之间产生一定相互抑制作用,说明PRRSV和PCV2之间可能相互干扰和影响,调节机体免疫系统,使得促炎因子IL-6、IL-8、IL-1β和抑炎因子IL-10的表达发生改变。推测共感染早期,由于PCV2先感染,诱导PAM产生IL-6、IL-8、IL-1β,三者均引起肺部的炎症反应,激活肺部淋巴细胞,提高血管的通透性,诱导发热,招募中性粒细胞、嗜碱性细胞等活动,共感染后期PRRSV产生的IL-1β加剧了肺部的炎症反应,从而引起肺脏炎性细胞浸润和肺组织损伤。
总之,PRRSV与PCV2共感染可能引起炎症反应严重失衡导致免疫系统紊乱,影响特异性免疫功能的正常运转,以及机体免疫应答的有效发挥和对病毒的有效清除。
[1] Albina E. Epidemiology of Porcine reproductive and respiratory syndrome (PRRS): an overview[J]. Vet Mierobiol, 1997, 55(l-4): 306-309.
[2] Vanderheijden N, delputte P L, Falvoreel H W, et al. Involvement of sialoadhesin in entry of porcine reproductive and respiratory syndrome virus into the porcine alveolar macrophages[J]. J Virol, 2003, 77(15): 8207-8215.
[3] Allan G M, Ellis J A. Porcine circoviruses: a review [J]. J Vet Diagn Invest, 2000, 12: 3-14.
[4] Harms P A, Sorden S D, Halbur P G, et al. ExPerimental reproduction of severe disease in CD/CD pigs concurrently infected with type 2 porcine circovirus and porcine reproductive and respiratory syndrome virus[J]. Vet Pathol, 2001, 38: 528-539.
[5] Lee S M , Kleiboeker S B. Porcine arterivirus activates the NF-kappaB pathway through IkappaB degradation[J]. Virology, 2005, 342(1): 47-59.
[6] Lv Y J, Zhang X J, Sun, Y. Activation of NF-kB contributes to production of pig-major acute protein and serum amyloid A in pigs experimentally infected with porcine circovirus type 2 [J]. J Vet Sci, 2013, 95: 1235-1240
[7] Krakowka S, Ellis J A, Meehan B, et al. Viral wasting syndrome of swine: experimental reproduction of postweaning multi-systemic wasting syndrome in gnotobiotic swine by co-infection with porcine circovirus 2 and porcine parvovirus[J]. Vet Pathol, 2000, 37(3): 254-263.
[8] Wellenberg G J, Stoekhofe-Zurwieden N , Boersma W J, et al. The Presence of co-infections in Pigs with clinical signs of PMWS in The Netherlands: a case-control study[J]. Res Vet Sci, 2004, 77(2), 177-184.
[9] 贾赞, 卢银华. 猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学凋查[J].中国病毒学, 2004, 19(5): 467-470.
[10] Chae C. Postweaning multisystemic wasting syndrome: a review of aetiology, diagnosis and pathology[J].Vet J, 2004, 168: 41-49.
[11] Van Breedam W, Delputte P L, Van gorp H, et al. Porcine reproductive and respiratory syndrome virus entry into the porcine macrophage[J]. J Gen Virol, 2010, 91(7): 1659-1667.
[12] Heinrich P C, Behrmann I, Haan S, et al. Principles of interleukin (IL)-6-type cytokine signalling and its regulation[J]. Biochem J, 2003, 374(1): 1-20.
[13] Wang L, Han G, Wang R, et al. Regulation of IL-8 production by complement-activated product, C5a, in vitro and in vivo during sepsis[J]. Clin Immunol, 2010, 137(1): 157-165.
[14] Netea M G, Nold-Petry C A, Nold M F, et al. Differential requirement for the activation of the inflammasome for processing and release of IL-lbeta in monocytes and macrophages[J]. Blood, 2009, 113(10): 2324-2335.
[15] Ouyang W, Rutz S, Crellin N K, et al. Regulation and functions of the IL-10 family of cytokines in inflammation and disease[J]. Annu Rev Immunol, 2011, 29: 71-109.
INFLAMMATORY RESPONES OF A PULMONARY ALVEOLAR MACROPHAGE IN VITRO RESPONSE TO PORCINE CIRCOVIRUS TYPE 2 AND PORCINE REPRODUCTIVE AND RESPIRATORY SYNDROME VIRUS CO-INFECTION
SHI Kun1,2, WEI Jian-chao2, QIU Ya-feng2, ZHANG Ke-long2, LI Zong-rui2, LIU Xi-qian2, LI Bei-bei2, LIU Ke2, SHAO Dong-hua2, CHEN Li-zhi1, MA Zhi-yong2
(1. Institute of Special Wild Economic Animal and Plant Science, CAAS, Changchun 130117, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
This study was to determine pathogenesis of co-infection of Porcine circovirus type 2 (PCV2) and Porcine reproductive and respiratory syndrome virus (PRRSV) in vitro. A cell line stably expressing CD163 (designated PAM-CD163) were infected with PCV2, PRRSV and PCV2+PRRSV. The changes of mRNAs of cytokines (IL-6, IL-8, IL-1β, IL-10) in PAM-CD163 were analyzed using a realtime fl uorescent quantitative PCR (real-time FQ-PCR) and indirect immunofl uorescence assay (IFA). The results showed that both PCV2 and PRRSV could replicate in PAM-CD163. When PAM-CD163 was infected with PCV2 alone, the expression of IL-6, IL-8, IL-1β increased at early stage, and IL-10 increased at later stage. While in PAM-CD163 infected with PRRSV, the expression levels of IL-1β,IL-10 were promoted in advanced stage. IL-6, IL-8 and IL-1β in PAM-CD163began to grow under PCV2+PRRSV co-infection ahead of that under PCV2 infection, and the increase continued. The fi ndings suggested there were interaction between PCV2 and PRRSV in regulating the immune system.
Porcine circivirus type 2(PCV2); Porcine reproductive and respiratory syndrome virus(PRRSV); co-infection; PAM-CD163; cytokines
S852.659.6
A
1674-6422(2016)03-0016-05
2016-01-12
国家重点基础研究发展计划(2014CB542703)
石坤,女,硕士研究生,预防兽医学专业
马志永,E-mail:zhiyongma@shvri.ac.cn;陈立志,E-mail:tcsclz@126.com

