日本血吸虫C1q结合蛋白基因的克隆表达及其免疫保护效果评估
贾秉光,洪 炀,韩 倩,吕 超,王 涛,柴淑梅,曹晓丹,陆 珂,宰金丽,马 帅,林矫矫,2,傅志强
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2. 江苏省动物重要疾病与人兽共患病防控协同创新中心,扬州 225009)
日本血吸虫C1q结合蛋白基因的克隆表达及其免疫保护效果评估
贾秉光1,洪炀1,韩倩1,吕超1,王涛1,柴淑梅1,曹晓丹1,陆珂1,宰金丽1,马帅1,林矫矫1,2,傅志强1
(1.中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海 200241;2. 江苏省动物重要疾病与人兽共患病防控协同创新中心,扬州 225009)
本研究利用PCR技术扩增到日本血吸虫C1qBP基因,构建了重组表达质粒pET-32a(+)-SjC1qBP,并在大肠杆菌中进行表达。将重组蛋白免疫小鼠评估其免疫保护效果,采用Western blot检测其免疫原性,ELISA检测其特异性抗体水平,应用补体溶血试验分析重组蛋白对补体溶血的抑制效果。结果显示日本血吸虫C1qBP基因含729 bp的编码序列,在大肠杆菌中BL21(DE3)中表达后,用His-Bind亲和层析纯化可获得50 kDa的重组蛋白rSjC1qBP。应用重组蛋白rSjC1qBP免疫BALB/c小鼠可产生较高水平的特异性IgG抗体,诱导36.08%的减虫率和43.45%的肝脏减卵率;补体溶血试验结果表明该重组蛋白能够抑制补体溶血。本研究结果为进一步研究日本血吸虫SjC1qBP的生物学功能奠定了基础。
日本血吸虫;C1qBP基因;补体;重组蛋白
日本血吸虫病是由日本分体吸虫(又称日本血吸虫,Schistosoma japonicum,Sj)感染引起一种分布广泛、危害严重的人畜共患寄生虫病[1]。血吸虫尾蚴通过皮肤感染哺乳动物宿主后,在宿主体内的移行、发育、寄生过程中始终遭受宿主的免疫攻击,但相当比例的虫体能够逃避宿主的免疫攻击且发育成熟。免疫逃避在血吸虫的发育和寄生过程中具有关键作用[2]。补体是机体免疫系统的重要效应系统,可迅速标记并清除入侵微生物或毒性成分,介导体液免疫和细胞免疫[3]。血吸虫尾蚴突破皮肤屏障后就受到宿主免疫应答的攻击,补体反应是宿主最早开始杀伤虫体的免疫应答[4]。血吸虫在长期的进化过程中积累了应对宿主补体系统的适应性,对补体反应的调节是其免疫逃避策略的重要组成部分[5]。血吸虫在尾蚴阶段对血清补体是非常敏感的,但在尾蚴转变为童虫2~4 h后对血清补体杀伤的敏感性就开始逐渐下降,这表明血吸虫在感染初期就对宿主补体反应有调节作用,这种转变可能和血吸虫膜结构变化及体被膜上的分子有关[6]。
C1q是补体系统经典途径的重要识别分子,能够启动经典途径,并且在天然免疫和特异性免疫之间发挥重要的连接作用[7]。C1q结合蛋白(Clg binding protein C1qBP)能够与C1q结合,抑制补体激活途径。我们检索了日本血吸虫基因组和转录组资料,并进行功能区和基因功能分析,发现日本血吸虫具有C1qBP蛋白(SjC1qBP)。本研究应用RTPCR克隆得到SjC1qBP编码基因,在大肠杆菌中表达制备重组融合蛋白,评估重组蛋白在实验动物中诱导的免疫保护,同时采用补体溶血试验验证该重组蛋白的C1q结合作用。
1 材料和方法
1.1主要实验材料日本血吸虫中国大陆株尾蚴由中国农业科学院上海兽医研究所钉螺室提供;质粒pMD19-T购自宝生物工程(大连)有限公司;宿主菌DH5α、BL21(DE3)购自北京全式金生物技术有限公司;表达质粒pET-32a(+)由上海兽医研究所动物血吸虫病研究室保存;雄性新西兰白兔(3.5 kg)购自罗泾飞达上海实验动物养殖中心;雄性BALB/c小鼠(6周龄)购自上海斯莱克实验动物有限责任公司;绵羊红细胞(EA,2×108个/mL)购自上海榕柏生物技术有限公司。
1.2主要试剂Trizol Reagent、M-MLV Reverse Transcriptase试剂盒购自Invitrogen公司;Ex Taq DNA 聚合酶、限制性内切酶EcoR I、Xho I、T4 DNA 连接酶、DNA-T-Tailing 等购自大连宝生物工程有限公司;DNA Marker (DL2000)、DNA Marker (DL5000)、蛋白质分子量标准、IPTG、DAB显色试剂盒等购自上海天根生物科技有限公司;羊抗小鼠IgG-HRP购自康为世纪生物科技有限公司;A型DNA快速纯化试剂盒、B型质粒小量快速提取试剂盒等购自北京博大泰恒生物技术有限责任公司;Axyprep DNA凝胶回收试剂盒购自美国Axygen公司;Ni-NTA HisBind Resin(Merck-Novagen)购自中科新生命生物科技有限公司。
1.3RNA的提取及反转录取出保存在液氮中的42 d日本血吸虫虫体,按Trizol试剂盒说明书进行总RNA提取及纯化,按照TaKaRa反转录试剂盒说明书进行反转录试验,产物保存于-80℃备用。
1.4日本血吸虫C1qBP基因的克隆以NCBI数据库中日本血吸虫(SeqID:FN315565)的序列作为参考设计特异性引物。上游引物:5′-CGCGAATTCTTA CGGCGTGAAATGTCT-3′含EcoR I酶切位点;下游引物:5′-GCGCTCGAGCAGTCTTTAAGGATTGTG CA-3′含Xho I酶切位点。以1.3中所得产物为模板,利用上述引物进行PCR扩增。PCR扩增程序:94℃预变性5 min;94℃变性30 s,56℃退火 30 s,72℃延伸 90 s,共30个循环,最后72℃延伸15 min。PCR产物经琼脂糖凝胶电泳检测。纯化回收后,将回收产物与载体pMD19-T连接后转入大肠杆菌感受态细胞。将转化后的大肠杆菌接种于含有氨苄青霉素的LB固体培养基上,挑选单个菌落扩大培养,培养10 h后以菌液为模板,进行PCR鉴定,选择阳性克隆,抽提质粒后由上海华津生物技术有限公司进行测序分析。
1.5日本血吸虫SjC1qBP基因的生物信息学分析利用DNAStar分析软件查找日本血吸虫SjC1qBP基因的开放阅读框(open reading frame,ORF),并对氨基酸残基数目、组成、编码蛋白的相对分子质量、等电点等参数进行分析;将SjC1qBP基因测序结果用DNAStar、BLAST等进行同源性分析;利用TMHMM分析软件(http://www.cbs.dtu.dk/services/ T MHMM/)预测蛋白的跨膜结构域;利用SignalP软件(http://www.cbs.dtu.dk/services/SignalP)作信号肽分析;利用Protscale软件分析其疏水性;利用GOR IV软件分析其二级结构(http://npsa-pbil.ibcp. fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)。
1.6重组蛋白rSjC1qBP的表达与纯化将1.4中测序正确的重组质粒经EcoR I、Xho I进行双酶切,纯化回收目的片段亚克隆于pET-32a(+)载体中,构建重组质粒pET-32a(+)-SjC1qBP,对其进行菌液PCR鉴定及序列测定。将含测序鉴定正确的重组质粒的5 mL菌液接种于500 mL含100 μg/mL 氨苄霉素的LB液体培养基中,37℃、250 r/min震荡培养,至细菌生长对数期(OD600≈0.6),加入终浓度为1 mmol/ L的IPGT诱导表达,将表达产物进行SDS-PAGE电泳鉴定,观察最佳诱导表达时间和表达形式。采用His·resin Bind树脂柱层析方法纯化目的蛋白,纯化后的重组蛋白装在透析带中,依次在6、5、4、3、2、1 mol/L尿素及PBS溶液中透析复性,收集复性后的重组蛋白,-80℃保存备用。
1.7重组蛋白rSjC1qBP的抗原性分析将纯化复性的重组蛋白rSjC1qBP进行SDS-PAGE电泳,并将重组蛋白rSjC1qBP电转移至NC膜上;以rSjC1qBP三免血清(1:200稀释)为一抗4℃孵育过夜,同时以小鼠阴性血清和pET-32a(+)空载体标签蛋白免疫小鼠血清作对照;以羊抗鼠IgG-HRP(1:2500稀释)为二抗孵育1.5 h,最后使用DAB显色,进行抗原性分析。
1.8动物保护实验将纯化的重组蛋白rSjC1qBP结合ISA206佐剂免疫 BALB/c小鼠,每隔2周加强免疫,共免疫3次;对照组注射PBS或ISA206。3免后第2周,采用腹部贴片方法感染小鼠(40±2)条日本血吸虫尾蚴。感染后d42剖杀小鼠,采用肝门静脉冲洗法收集虫体,按以下公式计算减虫率:减虫率=(对照组平均虫荷数-试验组平均虫荷数)/对照组平均虫荷数。同时收集每只小鼠的肝脏称重,消化后虫卵计数,并计算肝脏减卵率:减卵率=(对照组平均虫卵数-试验组平均虫卵数)/对照组平均虫卵数。
1.9ELISA检测特异性抗体水平动物免疫过程中每次免疫7 d后采集小鼠的血清,通过间接ELISA法测定其特异性IgG抗体水平。以重组蛋白rSjC1qBP(10 μg/mL)为抗原,4℃包被过夜;PBST洗涤3次,加入1.5%BSA(150 μL/孔),37℃封闭1 h;将各组待检血清1:100稀释为一抗,每份血清重复3孔,37℃孵育1 h;洗涤3次后以羊抗鼠IgG-HRP(1:2500稀释)为二抗孵育1 h,最后用可溶型TMB避光显色,室温作用后使用2 mol/L硫酸终止反应(50 μL/孔),在450 nm波长处读取每孔的OD值。
1.10绵羊红细胞溶血抑制试验将重组蛋白rSjC1qBP、pET-32a标签蛋白和BSA各20 μg,用100 μL正常豚鼠血清37℃孵育30 min,加入50 μL抗体致敏的绵羊红细胞(EA,2×108个/mL),均匀混合后在37℃下水浴30 min并进行离心(500×g,1 min),各组溶血程度(释放的血红蛋白)由上清液的OD412值来确定。
2 结果
2.1日本血吸虫SjC1qBP的克隆根据日本血吸虫C1qBP基因的参考序列(FN315565)设计引物,以日本血吸虫42 d成虫cDNA为模板,PCR扩增到大小为729 bp的DNA片段(图 1),与预期目的片段大小相符,测序结果显示与参考序列相比,存在 2个碱基变异面,编码氨基酸序列与参考顺序编码的一致。
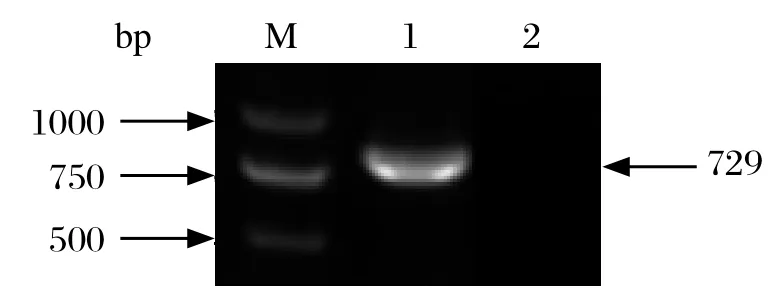
图1 SjClqBP基因PCR扩增产物Fig. 1 PCR product of SjC1qBP gene
2.2日本血吸虫SjC1qBP生物信息学分析对克隆
获得的SjC1qBP基因进行生物信息学分析,结果显示,SjC1qBP含729个核苷酸,编码242个氨基酸,理论分子量为27.58 kDa,理论等电点为4.728;利用TMHMM、SignalP等软件分析编码多肽,结果显示SjC1qBP没有跨膜区和信号肽,二级结构以无规则卷曲为主;氨基酸序列同源性分析表明,SjC1qBP与Schistosoma haematobium C1qBP(ShC1qBP,XP_012800748.1)、Lepeophtheirus salmonis C1qBP(LsC1qBP,ACO12436.1)、 Echinococcus granulosus C1qBP(EgC1qBP,EUB56334.1)和Schistosoma mansoni C1qBP(SmC1qBP,CCD59219.1)的氨基酸都有较高的相似性;SMART软件分析该蛋白氨基酸序列结果显示其属于Ffam家族蛋白含有MAM33结构域,具有补体蛋白C1q结合位点。
2.3重组蛋白rSjC1qBP的表达与纯化将构建正确的重组表达质粒pET-32a(+)-SjC1qBP转化大肠杆菌BL21(DE3),经IPTG诱导后进行SDS-PAGE检测,结果显示在50 kDa处可见特异的重组蛋白分子,并且诱导时间与该蛋白的表达量呈正比,诱导5 h后表达量较高。回收菌体蛋白进行溶解试验,结果表明重组蛋白以包涵体形式存在,但可溶解于8 mol/L尿素溶液中。在变性条件下经过Ni-NTA His·resin Bind树脂纯化后,可以获得较纯的重组蛋白(图2)。将纯化的重组蛋白用含不同浓度梯度尿素/PBS溶液透析复性,重组蛋白rSjC1qBP能够复性,最终的纯化产量约为5 mg/L。
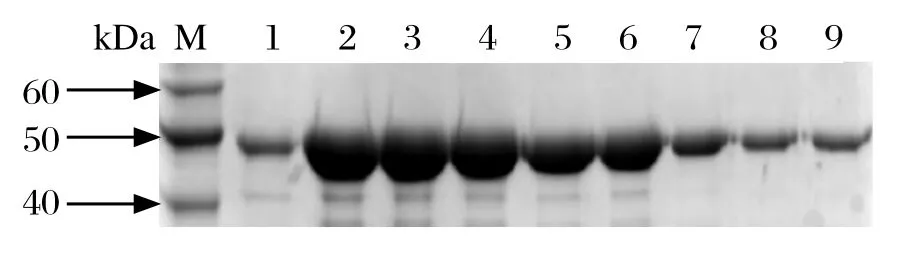
图2 重组蛋白rSjC1qBP的纯化Fig. 2 Purifi cation of recombinant protein rSjC1qBP
2.4重组蛋白rSjC1qBP的抗原性分析以复性的重组蛋白rSjC1qBP为抗原,分别以BALB/c小鼠的阴性血清(A)、重组蛋白rSjC1qBP免疫BALB/c小鼠的三免血清(B)、pET-32a(+)空载体标签蛋白免疫BALB/c小鼠的三免血清(C)为一抗进行Western blot分析,结果显示该重组蛋白能被免疫血清识别,表明重组蛋白rSjC1qBP具有较好的免疫原性(图3)。

图3 重组蛋白rSjC1qBP的免疫原性分析Fig. 3 Western blot analysis of the antigenicity of rSjC1qBP
2.5重组蛋白rSjC1qBP的免疫保护效果评估动物保护实验中,重组蛋白rSjC1qBP诱导BALB/c小鼠产生了显著的免疫保护效果。与ISA206佐剂组相比,重组蛋白rSjC1qBP诱导产生了36.08%的减虫率(P<0.05)以及43.45%的减卵率(P<0.01)(表1)。间接ELISA方法检测各组小鼠免疫前后特异性抗体IgG水平,结果表明首次免疫重组蛋白rSjC1qBP后小鼠体内特异性IgG抗体水平即显著升高,第二次免疫后快速升高,第三次免疫后抗体达到最高水平,至感染6周后剖杀,抗体仍维持在较高水平。而佐剂对照组小鼠体内的IgG抗体始终维持在较低的水平(图4)。
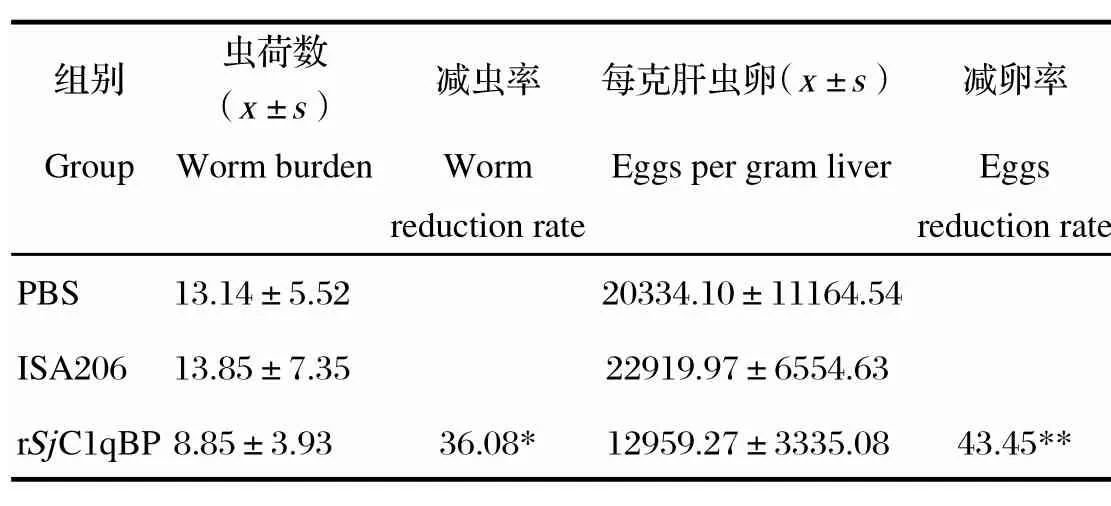
表1 rSjC1qBP免疫保护效果评估Table 1 Evaluation of the protective effi cacy induced by rSjC1qBP
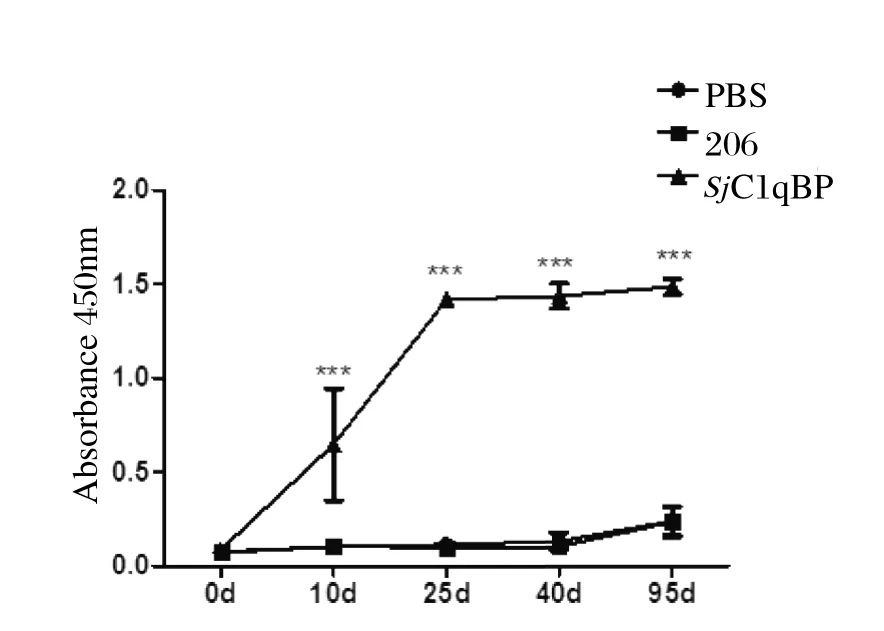
图4 重组蛋白rSjC1qBP诱导的小鼠抗rSjC1qBP特异性抗体水平(***P<0.01)Fig. 4 Kinetics of specifi c anti-rSjC1qBP IgG induced with rSjC1qBP in mice(***P<0.01)
2.6重组蛋白rSjC1qBP的补体结合活性分析以牛血清白蛋白作为对照,重组蛋白对补体介导的绵羊红细胞溶血抑制效果见图5。牛血清白蛋白不能抑制补体溶血,而重组蛋白rSjC1qBP能够抑制补体溶血,溶血抑制率达30%以上。

图5 重组蛋白rSjC1qBP溶血试验Fig. 5 Hemolytic assays of recombinant protein rSjC1qBP
3 讨论
我国是日本血吸虫病流行较严重的国家,至2013年仍有血吸虫病人18万,钉螺滋生面积365 468.00 hm2,疫区病牛的推测感染率约为0.12%[8]。化学药物吡喹酮在疫情控制与治疗中依然占有关键地位,但是吡喹酮治疗不能解决重复感染的问题。由于该药的使用已经有30多年的历史,对其产生抗药性的担忧是存在的[9]。血吸虫免疫预防疫苗是预防技术的发展方向之一[10,11],但目前研究进展相当缓慢[12]。许多寄生虫学者认为血吸虫免疫逃避是非常值得重视的现象。免疫逃避不仅是血吸虫预防疫苗研究的阻碍,更是寄生虫与宿主相互作用的重要组成部分,因此,研究血吸虫免疫逃避现象及其机制具有重要意义[13-15]。
补体系统是机体免疫系统的重要组成部分。补体反应是非常迅速、级联放大的免疫防御机制,是宿主杀伤血液内寄生虫的重要途径[4],研究表明补体反应是宿主杀伤克氏锥虫的重要效应机制[16]。早期免疫荧光实验表明补体结合蛋白质存在于血吸虫的表面[17],至今已发现多个血吸虫分子可能和调节宿主补体反应相关,作用于补体级联反应的多个节点[5]。其中血吸虫副肌球蛋白(paramyosin)调节补体反应的机制已有较详细的研究报道[14]。
血吸虫在宿主的血管系统中,C2BP、C3BP、C8BP、C9BP(C2-binding protein,C3-binding protein, and C8-binding protein, C9-binding protein)已经被研究发现存在于血吸虫体表。有研究表明血吸虫可通过与补体C1q结合和抑制膜攻击复合物形成等途径来调节宿主补体反应[18,19]。Liu等[20]在日本血吸虫蛋白质组研究中发现SjC1qBP分子与C1q结合蛋白相似。本实验室前期在日本血吸虫体被表膜蛋白质组中也鉴定到SjC1qBP分子,据此扩增编码SjC1qBP的基因序列,分析结果表明该序列与参考序列(FN315565)有2个碱基差异,但编码氨基酸序列一致,而且含有MAM33结构域属于Pfam家族蛋白,具有补体蛋白C1q结合位点,因此推测其具有结合补体C1q并影响经典补体途径的能力。
本研究将SjC1qBP基因在大肠杆菌中进行重组表达,结果能纯化到复性的重组蛋白,而且具有较好的抗原性。在免疫保护效果评估试验中,重组蛋白rSjC1qBP诱导了较高的的减虫率及肝脏减卵率,同时ELISA结果表明重组蛋白rSjC1qBP能够诱导小鼠产生较高水平的特异性IgG抗体,这些研究结果表明SjC1qBP是一种有潜力的抗血吸虫疫苗候选分子。在绵羊红细胞溶血试验中,与对照的载体蛋白和BSA相比,该重组蛋白能抑制补体溶血。结果表明SjC1qBP可能通过结合C1q而抑制经典途径的补体溶血效应。因此我们推测SjC1qBP在血吸虫中可能也通过结合补体成分C1q而影响宿主的补体杀伤效应,从而发挥免疫逃避作用。对 C1qBP 基因功能的深入研究,有助于解释血吸虫免疫逃避现象,对揭示虫体与宿主之间相互作用具有重要理论意义。
[1] King C H. Toward the elimination of schistosomiasis[J]. New Engl J Med, 2009, 360(2): 106-109.
[2] Damian R T. Parasite immune evasion and exploitation: reflections and projections[J]. Parasitology, 1997, 115 Suppl: S169-175.
[3] Sarma J V, Ward P A. The complement system[J]. Cell Tissue Res, 2011, 343(1): 227-235.
[4] McSorley H J, Hewitson J P, Maizels R M. Immunomodulation by helminth parasites: defining mechanisms and mediators [J]. Int J Parasitol, 2013, 43(3-4): 301-310.
[5] Skelly P J. Intravascular schistosomes and complement [J]. Trends Parasitol, 2004, 20(8): 370-374.
[6] Leow C Y, Willis C, Osman A, et al. Crystal structure and immunological properties of the first annexin from Schistosoma mansoni: insights into the structural integrity of the schistosomal tegument[J]. FEBS J, 2014, 281(4): 1209-1225.
[7] Kishore U, Reid K B. Modular organization of proteins containing C1q-like globular domain [J]. Immunopharmacology, 1999, 42(1-3): 15-21.
[8] 雷正龙, 郑浩, 张利娟, 等. 2013年全国血吸虫病疫情通报[J]. 中国血吸虫病防治杂志, 2014, (6): 591-596.
[9] Doenhoff M J, Cioli D, Utzinger J. Praziquantel: mechanisms of action, resistance and new derivatives for schistosomiasis[J]. Curr Opin Infect Dis, 2008, 21(6): 659-667.
[10] Hotez P J, Bethony J M, Oliveira S C, et al. Multivalent anthelminthic vaccine to prevent hookworm and schistosomiasis[J]. Expert Rev Vaccines, 2008, 7: 745-752.
[11] McManus D P, Loukas A. Current status of vaccines for schistosomiasis[J]. Clin Microbiol Rev,2008, 21: 225-242.
[12] Kupferschmidt K. A worm vaccine, coming at a snail′s pace[J]. Science, 2013, 339(6119): 502-503.
[13] Lambris J D, Ricklin D, Geisbrecht B V. Complement evasion by human pathogens[J]. Nat Rev Microbiol, 2008, 6(2): 132-142.
[14] Deng J, Gold D, LoVerde P T, et al. Inhibition of the complement membrane attack complex by Schistosoma mansoni paramyosin[J]. Infect Immun, 2003, 71(11): 6402-6410.
[15] Klabunde J, Berger J, Jensenius J C, et al. Schistosoma mansoni: adhesion of mannan-binding lectin to surface glycoproteins of cercariae and adult worms[J]. Exp Parasitol, 2000, 95(4): 231-239.
[16] Cestari I, Evans-Osses I, Schlapbach L J, et al. Mechanisms of complement lectin pathway activation and resistance by trypanosomatid parasites [J]. Mol Immunol, 2013, 53(4): 328-334.
[17] McGuinness T B, Kemp W M.Schistosoma mansoni: a complement-dependent receptor on adult male parasites [J]. Exp Parasitol, 1981, 51: 236-242.
[18] McIntosh R S, Jones F M, Dunne D W, et al. Characterization of immunoglobulin binding by schistosomes[J]. Parasite Immunol, 2006, 28(9): 407-419.
[19] Jiz M, Friedman J F, Leenstra T, et al. Immunoglobulin E (IgE) responses to paramyosin predict resistance to reinfection with Schistosoma japonicum and are attenuated by IgG4[J]. Infect Immun, 2009, 77(5): 2051-2058.
[20] Liu F, Lu J, Hu W, et al. New perspectives on hostparasite interplay by comparative transcriptomic and proteomic analyses of Schistosoma japonicum[J]. PLoS Pathog, 2006, 2(4): e29.
CLONING AND EXPRESSION OF C1Q BINDING PROTEIN GENE OF SCHISTOSOMA JAPONICUM AND ASSESSMENT OF ITS IMMUNE PROTECTION
JIA Bing-guang1, HONG Yang1, HAN Qian1, LV Chao1, WANG Tao1, CHAI Shu-mei1, CAO Xiao-dan1, LU Ke1, ZAI Jin-li1, MA Shuai1, LIN Jiao-jiao1,2, FU Zhi-qiang1
(1. Key Laboratory of Animal Parasitology of the Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
The C1qBP gene of S.japonicum (SjC1qBP) was cloned, expressed and characterized in the present study. The open reading frame (ORF) of SjC1qBP consisting of 729 bp encoding 242 amino acids was successfully expressed in Escherichia coli BL21 (DE3). The Ni-NTA purifi cation system was applied to purify the recombinant protein and a 50 kDa purifi ed protein was obtained. Immunization with the purifi ed rSjC1qBP emulsifi ed ISA206 adjuvant induced a higher level of specifi c IgG and signifi cant reductions in worms burden (36.08%) and liver eggs number (43.45%). Hemolytic testing indicated that rSjC1qBP inhibited the process of complement hemolysis. These fi ndings suggested that SjC1qBP might be a potential vaccine candidate against S. japonicum and laid a path for further research on its biological function.
Schistosoma japonicum; C1q binding protein gene; complement; recombinant protein
S852.735
A
1674-6422(2016)03-0066-06
2016-03-15
国家自然科学基金(31472188);国家科技支撑计划(2015BAI09B04);上海市领军人才后备队计划(201442)
贾秉光,男,硕士研究生,兽医学专业
傅志强,E-mail:fuzhiqiang@shvri.ac.cn

