牛病毒性腹泻病毒基因2型毒株的分离与鉴定
张淑琴,谭 斌,程世鹏
(中国农业科学院特产研究所,长春130122)
·简报·
牛病毒性腹泻病毒基因2型毒株的分离与鉴定
张淑琴,谭斌,程世鹏
(中国农业科学院特产研究所,长春130122)
本研究采用特异性RT-PCR从某实验室送检MDBK细胞中分离到1株牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV),命名为BVDV-C1。通过免疫荧光、电镜观察和5'UTR 序列测定及分子进化分析,结果表明其在MDBK 细胞中无细胞病变产生,应用牛病毒性腹泻病毒2型特异性单克隆抗体检测,在感染细胞胞浆内呈现特异性荧光信号,而牛病毒性腹泻病毒1型特异性单克隆抗体未检测到荧光。电镜观察病毒粒子呈圆形,有囊膜,直径约为50 nm。5'UTR 序列分析表明该毒株属于BVDV-2b 基因亚型。BVDV-C1 株的分离对进一步开展疫苗研发、流行病学调查以及致病机理等方面的研究具有重要意义。
牛病毒性腹泻病毒;细胞病变;分离;鉴定
牛病毒性腹泻粘膜病是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的一种牛的重要传染病。BVDV已经在世界范围内成为养牛业一个危害性极大的病原,它的感染已造成养牛业的巨大经济损失。据估算,在美国,每100 万犊牛中,由BVDV 感染造成的损失为2000~5700 万美元[1]。BVDV 的感染可引发多种临床疾病,包括呼吸系统疾病、生殖系统疾病、以及免疫抑制。还可以为其他致病原侵染动物创造条件,造成继发感染。
BVDV属于黄病毒科(Flaviviridae)、瘟病毒属(Pestivirus),与猪瘟病毒和边界病毒同属,抗原存在交叉反应[2]。BVDV可以感染牛、羊和猪等多种家畜和野生动物。患牛表现发热、白细胞减少、腹泻、流产、黏膜糜烂溃疡等急性感染症状及小牛先天持续性感染[3]。同时由于BVDV常常污染牛血清,而牛血清在生物制品行业有着广泛应用,因此生物制品行业涉及到的细胞、胰酶、血清甚至疫苗均存在BVDV污染的可能[4]。
依据可否在培养细胞上产生细胞病变,将BVDV分为两种生物型:致细胞病变型(cytopathic,CP)和非致细胞病变型(noncytopathic,NCP)。CP型可在接种后24~48 h内造成细胞病变,表现为形成空泡、核固缩、细胞融合、拉网等现象。NCP型在细胞中复制不具有致细胞病变效应,因此污染细胞也很难发现,被污染细胞再用于其他诊断或疫苗生产,很容易影响诊断结果的真实性及疫苗的免疫效果。
本研究从某实验室送检的MDBK细胞中分离到1株病毒,该病毒株在MDBK 细胞中繁殖,但不产生细胞病变,通过特异性RT-PCR、免疫荧光和电镜观察试验,证明其为BVDV-2型病毒。
1 材料与方法
1.1病毒株及细胞BVDV JL株、BVDV阴性MDBK细胞均为中国农业科学院特产研究所特种动物分子生物学重点实验室保存;细胞在含有6%的马血清的DMEM培养基(购自Hyclone公司)中培养。
1.2主要试剂ExTaq DNA 聚合酶、PCR 试剂、pMD18-T 载体均购自宝生物工程(大连)有限公司;胶回收试剂盒购自AXY 生物工程有限公司;E. coli DH5α 由本实验室保存;抗BVDV-1和 BVDV-2单克隆抗体(MAb)由中国农业科学院特产研究所自制[5]。
1.3分子生物学鉴定取疑似污染细胞,按照Trizol 试剂盒说明书提取病毒RNA,用随机引物将其反转录为c D N A,以鉴定引物进行RT-PCR 扩增,所用引物参照文献[5]合成。BLT:5′-CATGCCCATAGTAGGAC-3′;BRT:5′-CCATGTGCCATGTACAG-3′。目的片段大小约为280 bp。同时设不加模板为阴性对照,以BVDVJL 株为模板的阳性对照。PCR 扩增产物经琼脂糖凝胶电泳检测,胶回收目的片段,连接于pMD18-T载体中,转化E. coli DH5α 感受态细胞,筛选重组质粒,送交上海英骏公司测序。所测序列采用DNAStar软件与BVDV 其他毒株序列进行基因序列比对,并用Mega 绘制进化树。
1.4免疫荧光检测(immunofluorescene assay,
IFA)将BVDV阴性MDBK细胞接种于96孔培养板,细胞长成单层后,接种疑似污染MDBK细胞冻融液,并以BVDV-JL作阳性对照。置于37℃、5%CO2培养箱中培养3 d后,采用本实验室制备的BVDV-1型和BVDV-2型抗体进行免疫荧光试验。
1.5病毒的电镜观察将疑似污染细胞冻融后,接种于长至80%单层的BVDV阴性MDBK 细胞,置于37℃、5%CO2培养箱中培养5 d后,冻融通过离心去除细胞碎片,取上清用2%磷钨酸负染,透射电镜下观察。
1.7病毒TCID50测定取培养5 d的污染细胞冻融液经10倍系列稀释,接种于在96 孔培养板上已长至单层的MDBK 细胞。每个稀释度接种8个孔,100μL/孔,同时设不接种病毒的正常清净细胞对照孔,置于37℃、5%的CO2培养箱中培养4 d后固定,加入BVDV-2型荧光抗体染色后判定,记录荧光阳性孔,按照Reed-Muench法计算病毒毒价。
2 结果与讨论
2.1分子生物学鉴定应用BVDV 特异性鉴定引物BLT 和BRT进行扩增,在疑似污染细胞培养液中扩增出约280 bp 的单一目的片段(图1),扩增片段序列与GenBank进行比对,结果证实为BVDV 序列,命名为BVDV C-1 株。应用BVDV C-1的5′UTR与瘟病毒属参考毒株相应序列进行进化树分析,BVDV C-1与BVDV-1、BVDV-3参考毒株均不在一簇,亲缘关系远,而与BVDV-2b参考株在一簇,亲缘关系近。所以BVDV-C1应属于BVDV-2b基因亚型(图2)。依据BVDV 5′UTR 序列不同可将BVDV分为2种基因型,目前,又有学者提出将Th/04_KhonKaen、D32/00-‘HoBi’和CHKaHo/cont等病毒归为BVDV-3基因型[6]。在我国BVDV-1流行广泛, BVDV-2 型仅有少量报道[7.8]。本研究通过5′UTR 序列比对及基因进化分析,结果表明BVDV-C1属于BVDV-2b 亚型,该毒株的分离为我国BVDV流行病学调查以及致病机理等方面研究具有重要意义。
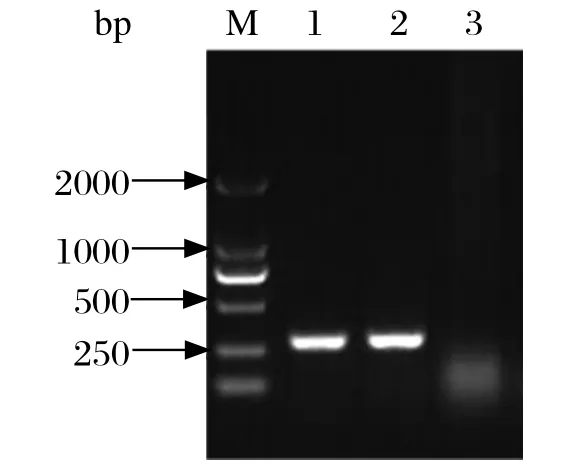
图1 牛病毒性腹泻病毒BVDV-C1 株5′UTR 的PCR鉴定Fig.1 PCR identifi cation result of 5′UTR from BVDV-C1
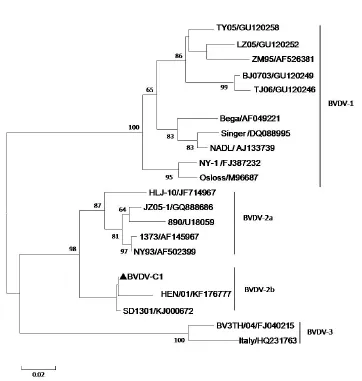
图2 牛病毒性腹泻病毒BVDV-C1 株5′UTR基因进化分析Fig.2 Phylogenetic analysis based on 5′UTR gene of BVDV-C1
2.2免疫荧光鉴定将疑似污染细胞和BVDV JL株的细胞培养液接种于MDBK单层细胞,培养3 d后固定,分别与BVDV-1和BVDV-2特异性单抗反应,荧光显微镜观察。应用BVDV-1抗体检测BVDV JL株感染细胞出现特异性荧光,病毒抗原主要分布于细胞浆中(图3A),BVDV-2抗体检测则没有荧光。应用BVDV-1抗体检测疑似污染细胞无荧光,应用BVDV-2抗体检测可见细胞胞浆中出现特性荧光,而未接种病毒的MDBK 细胞无反应(图3C)。

图3 牛病毒性腹泻病毒BVDV-C1 株的免疫荧光鉴定(200×)Fig.3 Immunofluorescence assay (IFA) identification of BVDV-C1 in MDBK cells (200×)
2.3病毒的电镜观察BVDV-C1细胞培养上清用2%磷钨酸进行负染,透射电镜下观察发现,病毒粒子略呈圆形,有囊膜,直径约50 nm(图4)。

图4 BVDV-C1 电镜图片Fig.4 Electron microscope of negatively stained cell suspension
2.4病毒TCID50测定疑似污染细胞冻融液接种于96孔培养板测定病毒的TCID50,培养4 d后固定,通过BVDV-2荧光抗体染色后判定,按照Reed-Muench法计算病毒毒价为104.5TCID50/mL 。
[1] Houe H. Economic impact of BVDV infection in dairies[J]. Biologicals, 2003, 31: 137-143.
[2] Houe H. Epidemiological features and economical importance of bovine virus diarrhea virus ( BVDV )infections [J].Vet Microbiol, 1999, 64 (2-3) : 89-107.
[3] Vilcek S, Herring A J, Herring J A, et al. Pestiviruses isolated from pigs, cattle and sheep can be allocated into at least three genogroups using polymerase chain reaction and restriction endonuclease analysis[J]. Arch Virol, 1994,136(3-4): 309-323.
[4] Xia H, Vijayaraghavan B, Belak S, et al. Detection and identification of the atypical bovine pestiviruses in commercial foetal bovine serum batches[J]. PLoS One, 2011, 6(12): e28553.
[5] 徐淑兰, 李少英, 冷雪, 等. 鉴别牛病毒性腹泻病毒基因型单克隆抗体的制备及其特性[J].农业生物技术学报, 2010,18(5):1001-1006.
[6] Ridpath J F, Bolin S R. Differentiation of types 1a, 1b, and 2 bovine viral diarrhea virus(BVDV) by PCR[J] . Mol Cell Probe, 1998, 12(2): 101-106.
[7] Liu L, Kampa J, Belak S, et al. Virus recovery and fulllength sequence analysis of atypical bovine pestivirus Th/04_KhonKaen[J]. Vet Microbiol, 2009, 138(1-2): 62-68.
[8] Tao J, Wang Y, Wang J, et al. Identification and genetic characterization of new bovine viral diarrhea virus genotype 2 strains in pigs isolated in China[J]. Virus Genes, 2013, 46(1): 81-87.
[9] Zhu L Q, Ren M, Lin Y Q, et al. Identification of a bovine viral diarrhea virus 2 isolated from cattle in China[J]. Acta Virol, 2009, 53(2): 131-134.
ISOLATION AND IDENTIFICATION OF BOVINE VIRAL DIARRHEA VIRUS-2 FROM THE ESTABLISED MDCK CELL LINE
ZHANG Shu-qin, TAN bin, CHENG Shi-peng
(Institute of Special Economic Animal and Plant Sciences ,CAAS, Changchun 130122, China)
Bovine viral diarrhea virus 2 was isolated from the suspected contaminative MDBK cells. The virus isolate replicated in MDBK cells but did not induce cytopathogenic effect after fi ve passages. Eventually, the virus isolate was identifi ed in specifi c indirect immunofl uorescent assay, RT-PCR, electron microscopy and was designated as BVDV-C1. The MDBK cells infected with BVDV-C1 showed strong fl uorescent signal with BVDV-2 antibody. DNA fragment was amplifi ed in RT-PCR from 5'-UTR of the BVDV-C1. The homology comparison and phylogenetic analysis showed that it belonged to BVDV-2b. Under electron microscopy, virus particles were near round and enveloped with size of 50 nm in diameter. The isolation of BVDV-C1 provided a basis for further research on vaccination, epidemiology and pathogenecity of BVDV in China.
Bovine viral diarrhea virus; cytopathogenic; isolation; identifi cation
S 852.659.6
B
1674-6422(2016)03-0083-04
2015-09-29
中央级公益性科研院所基本科研业务费专项资金项目(0032014016)
张淑琴,女,硕士研究生,预防兽医学专业
程世鹏,E-mail:chengshipeng@caas.cn

