Meigs综合征合并左肾嫌色细胞癌1例病例报道
张雪,佟晓光,张金磊,张颐
(中国医科大学附属第一医院妇科,沈阳 110001)
·短篇论著·
Meigs综合征合并左肾嫌色细胞癌1例病例报道
Meigs Syndrome Combined with Left Chromophobe Renal Cell Carcinoma:Report of One Case
张雪,佟晓光,张金磊,张颐
(中国医科大学附属第一医院妇科,沈阳 110001)
对我院收治的1例Meigs综合征合并左肾嫌色细胞癌患者的临床特点、诊断思路进行分析。
Meigs综合征;肾嫌色细胞癌
Meigs综合征是一种少见的妇科合并症,有文献报道,Meigs综合征的高发年龄为50~60岁,在年轻女性中尤为罕见,30岁以下发病者不足10%[1,2]。确诊Meigs综合征需要满足3个条件:(1)原发肿瘤为卵巢良性纤维瘤或纤维瘤样肿瘤;(2)合并胸水及腹水;(3)肿瘤切除后胸腹水消失且不复发。因肿瘤组织病理检查是确诊该病的关键,故术前诊断较难,易误诊。肾嫌色细胞癌是起源于肾集合小管细胞的肿瘤,是肾细胞癌的一种少见类型,约占肾细胞癌的3.2%[3],无明显年龄和性别差异。该肿瘤生长缓慢,侵袭性低。相对于其他亚型同期肾细胞癌,肾嫌色细胞癌的预后最好。Meigs综合征合并肾嫌色细胞癌罕见,迄今为止国内外未见报道。我院于2014年10月10日收治1例Meigs综合征合并左肾嫌色细胞癌的中年女性患者,现报道如下:
1 临床资料
患者,女,48岁,因咳嗽1个月、呼吸困难20余天入院。患者1个月前着凉后出现咳嗽,无咳痰及咯血,无发热,伴有流涕及咽痛,咳嗽时自觉胸部不适,无胸痛,自服咽炎片等药物治疗,咽痛好转,但仍有咳嗽。20余天前开始出现劳动后呼吸困难,症状逐渐加重,稍有活动即感呼吸费力,于当地医院行肺CT检查,提示右侧大量胸腔积液。为求进一步诊治,入我院呼吸内科住院治疗。
查体:右肺叩诊实音,右肺下叶未闻及呼吸音,右肺上叶呼吸音较弱,左肺听诊呼吸音清,未闻及干湿啰音。左下腹及脐下可触及实性包块,境界不清,无压痛。化验血清肿瘤标志物:CA125为788.40 U/mL。入院当日床头超声检查提示:右侧胸腔可见无回声区,深度约11.5 cm。泌尿系及盆腔超声提示:盆腹腔可见液性暗区,最大深度约6.0 cm;左肾中下部可见高回声,大小约7.1 cm×7.0 cm×8.0 cm,外突,轮廓清,周边及内部可见彩色血流。盆腔内(子宫前上方)见团块样低回声,范围约13.2 cm× 9.5 cm×12.7 cm,边界较清晰,深部回声略衰减,未见明显彩色血流。网膜及腹膜超声高频扫描未见明显结节。全腹增强3D-CT提示:左肾可见团块影,大小约为7.4 cm×6.7 cm,平扫CT值约为39 HU,增强后病灶可见强化,CT值约为67 HU,病灶边界尚清,其内可见小片状弱强化影,盆腔内可见巨大肿块影,范围约为12.7 cm×10.6 cm,平扫CT值约为50 HU,增强后CT值约为63 HU,其内密度不均匀,可见不规则片状低密度影。腹膜后未见确切肿大淋巴结。肾脏MR平扫+增强提示:左肾占位性病变,肾癌不除外。PET-CT提示:(1)左肾实质软组织肿块影,代谢同周围肾脏组织,高分化恶性病变不除外;(2)盆腔巨大软组织肿块影,内见密度减低影,代谢弥漫不均增高。初步诊断:右侧胸腔积液性质待定;左肾占位;盆腔占位。
入院当日(2014年10月10日)即行胸腔闭式引流术放胸水以缓解症状,住院期间共放出胸水约16 350 mL,同时查胸水肿瘤标记物,CA125为433.90 U/mL,胸水中未见典型瘤细胞;胸水涂片查抗酸杆菌为阴性。全院会诊后,遵泌尿外科医嘱于2014年10月29日行肾穿刺活检,病理提示恶性瘤,免疫组化结果支持肾细胞癌(倾向嫌色细胞癌)。考虑患者胸腹水可能与盆腔包块导致Meigs综合征相关,故转入我科先行手术治疗。
我科于2014年11月11日在双阻滞麻醉下行右侧附件切除,左侧卵巢冠囊肿核除术。术中见盆腹腔内游离淡黄色液体约1 000 mL,右侧卵巢生发超新生儿头大实性肿瘤,表面灰白色,质硬,包膜完整,可见子宫大小正常,光滑,左侧卵巢大小正常,可见左侧卵巢冠囊肿约鹅卵大,表面光滑。送术中病理提示为卵泡膜细胞瘤或纤维瘤,遂行右侧附件切除术,手术过程顺利。术后病理证实为卵泡膜细胞瘤(图1)。术后第6天复查胸水超声提示:右侧胸腔游离液性暗区最大前后径约3.10 cm,较术前(2014年11月10日)超声提示的最大深度6.7 cm明显减少。2014年12月3日于我院复查肺CT,未见胸腔积液。患者于2014年12月9日在我院泌尿外科行经腰左肾根治性切除术,术中见肿瘤位于左肾中下部,实性,大小约7 cm。病理标本切开后切面呈腐肉样改变伴坏死,切除肾脏及大部分输尿管、肾周脂肪组织及肾周筋膜。术后病理(图2)提示:左肾嫌色细胞癌,肾组织、脂肪组织、输尿管末端未见癌。术后3个月于门诊复查肝胆脾泌尿系超声、盆腔超声及胸部CT,未见异常。随访至今,胸腹水未见复发。
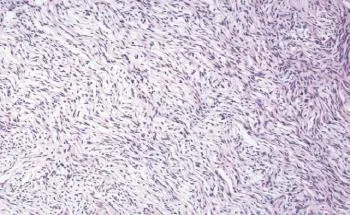
图1 卵泡膜细胞瘤组织病理学图片 ×100
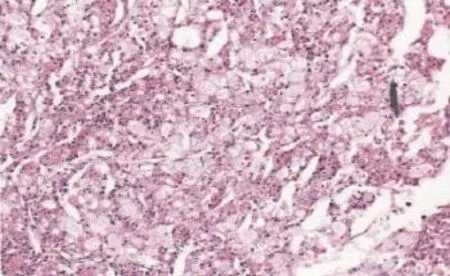
图2 肾嫌色细胞癌组织病理学图片 ×100
2 讨论
Meigs综合征由Meigs于1937年首次对其进行了正式的描述,后来发现其他盆腔良性病变也出现类似症状,故进一步将Meigs综合征分为真、假两性。真性Meigs综合征主要包括卵巢纤维瘤、纤维上皮瘤、颗粒细胞瘤及卵泡膜细胞瘤等合并胸、腹水(多为漏出液,也有渗出液)症状;假性Meigs综合征主要包括良性畸胎瘤、子宫平滑肌瘤、输卵管乳头状瘤及盆腔血管瘤等合并胸腹水(多为渗出液)症状[4]。胸腹水产生的机制尚无统一认识,目前认为肿瘤本身是产生腹水的主要来源,而胸水是腹水通过横膈淋巴管或横膈上先天裂孔进入胸腔。Meigs综合征的患者常因胸腹水就诊于内科,易被误诊为结核、肝炎和胸腹腔恶性肿瘤等;部分患者自行扪及盆腔包块就诊。肿块多在附件区,单侧多见,肿物大小不一,表面光滑,球形或结节状,质地坚硬,活动度较好。可伴有CA125升高,可作为诊断的参考。对于真性Meigs综合征和假性Meigs综合征的区分仅具有学术意义,但不涉及治疗上的差异。Meigs综合征属良性病变,治疗上应以手术治疗为主,真性Meigs综合征胸腹水在术后迅速消失。本例患者术后呼吸困难症状缓解,术中及术后病理均证实为卵泡膜细胞瘤,术后12 d复查肺CT胸腔积液消失,随访至今未见复发,符合Meigs综合征的诊断。
肾嫌色细胞癌是由Thoenes等[5]在1985年首先提出的一类独立的肾细胞癌亚型,是以染色体的普遍缺失为遗传学的显著特征,通常以1、2、6、10、13、17、21号染色体缺失为主[6]。肾嫌色细胞癌患者多无症状,绝大多数的患者是体检时B超或CT发现。腰痛是最常见的临床表现,具备典型的血尿、腰痛及腹部肿块三联症的患者为极少数。目前B超是体检时最常用的无创性检查方法。术前可在超声或CT定位下行肾脏穿刺活检,以明确诊断。外科手术仍是肾嫌色细胞癌首选的治疗方法。以2010年的AJCC癌症分期为标准,肾嫌色细胞癌发现时多在Ⅰ或者Ⅱ期,对于局限性的肾肿瘤可采用根治性肾切除术或行保留肾单位手术。而对于预后不良、肿瘤为进展期的患者,术后需要严格的随访和辅助治疗,如靶向治疗[7]。肾嫌色细胞癌是一种预后相对较好的肾脏肿瘤,Cheville等[8]和Beck等[9]报道5年癌症相关生存率和无病生存率分别为89%和80.1%。肾嫌色细胞癌总体上预后较好,但Zini等[10]发现仍有约5%的患者肿瘤侵犯下腔静脉,6%~7%的患者发生远处转移,最常见的转移部位是肝(39%)和肺(36%)。本例患者经肾穿刺活检后病理示:恶性瘤,免疫组化结果支持肾细胞癌(倾向嫌色细胞癌)。行经腰左肾根治性切除术,术后病理提示左肾嫌色细胞癌,无转移,诊断T1N0M0,为早期病变,预后较好,该患术后未行生物免疫治疗。随访至今未见复发。
本例Meigs综合征合并左肾嫌色细胞癌罕见,迄今为止国内外未见报道。两者的确定诊断均需组织病理学检查。本例患者行肾穿刺病理活检后提示左肾嫌色细胞癌可能性大,该肿瘤预后好,转移少见,患者胸水检查未见典型瘤细胞,影像学检查提示肿瘤基本位于肾周筋膜内,肾门未见明确肿大淋巴结,肾静脉未见明显瘤栓,且PET-CT未见其他部位转移病灶,可基本排除左肾嫌色细胞癌转移至胸膜的可能。本例患者盆腔包块病史较长,超声见肿块大小约13.2 cm×9.5 cm×12.7 cm,边界较清晰,深部回声略衰减,未见明显彩色血流,网膜及腹膜未见明显结节。全腹增强3D-CT平扫CT值约为50 HU,增强后CT值约为63 HU,强化不明显,临床及影像学改变均不符合卵巢恶性肿瘤。虽然CA125升高达788.40 U/mL,但其对于卵巢恶性肿瘤诊断的特异性有限。对于因不明原因胸腹水就诊的中年女性,经抗感染及对症治疗后病情无明显变化者,应积极行盆腔影像学检查,避免Meigs综合征的漏诊及误诊。肾嫌色细胞癌临床症状多不典型,在完善影像学检查的基础上应积极行肾穿刺活检术,以提高疾病的诊断率。
[1]Riker D,Goba D.Ovarian mass,pleural effusion,and ascites:revisiting Meigs syndrome[J].J Bronchol Intery Pulmonol,2013,20(1):48-51.
[2]Mui MP,Tam KF,Tam FK,et al.Coexistence of struma ovarii with marked ascites and elevated CA125 levels:case report and literature review[J].Arch Gynecol Obstet,2009,279(5):753-757.
[3]Cheville JC,Lohse CM,Sukov WR,et al.Chromophobe renal cell carcinoma:the impact of tumor grade on outcome[J].Am J Surg Pathol,2012,36(6):851-856.
[4]Nadia P,Piero C.Ovarian malignancies with cytologically negative pleural and peritoneal effusions:Demons’or Meigs’pseudo-syndromes?[J].Int J Surg Pathol,2009,17(5):396-397.
[5]Thoenes W,Störkel S,Rumpelt HJ.Human chromophobe cell renal carcinoma[J].Virchows Arch B Cell Pathol Incl Mol Pathol,1985,48(3):207-217.
[6]Mazal PR,Exner M,Haitel A,et al.Expression of kidney-specific cadherin distinguishes chromophobe renal cell carcinoma from renal oncocytoma[J].Hum Pathol,2005,36(1):22-28.
[7]Volpe A,Novara G,Antonelli A,et al.Chromophobe renal cell carcinoma(RCC):oncological outcomes and prognostic factors in a large multicentre series[J].BJU Int,2012,110(1):76-83.
[8]Cheville JC,Lohse CM,Sukov WR,et al.Chromophobe renal cell carcinoma:the impact of tumor grade on outcome[J].Am J Surg Pathol,2012,36(6):851-856.
[9]Beck SD,Patel MI,Snyder ME,et al.Effect of papillary and chromophobe cell type on disease-free survival after nephrectomy for renal cell carcinoma[J].Ann Surg Oncol,2004,11(1):71-77.
[10]Zini L,Leroy X,Lemaitre L,et al.Tumour necrosis in chromophobe renal cell carcinoma:clinical data to distinguish aggressive variants[J].Eur J Surg Oncol,2008,34(6):687-691.
(编辑 陈 姜)
R737.31
A
0258-4646(2016)02-0177-03
10.12007/j.issn.0258-4646.2016.02.021
辽宁省自然科学基金(2014021021)
张雪(1990-),女,硕士研究生.
张颐,E-mail:syzi@163.com
2015-05-19
网络出版时间:

