地衣芽孢杆菌 NJWGYH 833051的抑菌作用
王春晓 胡永红 杨文革 等
摘要:通过地衣芽孢杆菌(Bacillus licheniformis)对不同病原菌平板抑制试验以及在植物上的定殖试验,初步研究其抑菌作用。结果表明,地衣芽孢杆菌对番茄叶霉病菌有较好的抑制作用。
关键词:地衣芽孢杆菌(Bacillus licheniformis);平板抑制;生物防治
中图分类号:S476+.11 文献标识码:A 文章编号:0439-8114(2016)04-0904-04
DOI:10.14088/j.cnki.issn0439-8114.2016.04.022
The Control Effect of Bacillus licheniformis NJWGYH 833051
WANG Chun-xiao, HU Yong-hong, YANG Wen-ge, WU Gang, GU Peng-fei, DING Zhi-wen, CHEN Zhao-guo
(State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 211816, China)
Abstract: The control effect of Bacillus licheniformis was preliminary studied through B. licheniformis of different pathogens tablet inhibition experiment and its colonization in the plant. The results showed that the B. licheniformis had good inhibition to Fulvia fulva.
Key words: Bacillus licheniformis; tablet inhibition; biological control
地衣芽孢杆菌(Bacillus licheniformis)分布广泛,空气、土壤和其他各种环境中都有分布,其生理和生化特性也多种多样,在其生存环境如植物微生态和土壤中是一种优势菌种,具有广泛的应用前景。地衣芽孢杆菌产生的多种活性物质[1-3]包括溶菌酶、细菌素、抗菌蛋白和各种抗生素[4](包括磷脂类、氨基酸类、核酸类、脂肽类、肽类、多烯类)等,对很多病原微生物具有很好的抑制作用。化学农药的大量使用造成了残留物污染,对农产品产量和食品安全造成威胁[5-9]。地衣芽孢杆菌产生的抗菌物质对某些病原菌具有很好的抑制作用,可以应用在生物农药的研究生产上[10,11]。因此,研究地衣芽孢杆菌的抑菌作用,为高效绿色生物农药研究开发提供依据。
1 材料与方法
1.1 材料
试验菌种为地衣芽孢杆菌NJWGYH 833051,由南京工业大学材料化学与化学工程国家重点实验室筛选保存;番茄早疫病菌、白菜黑斑病菌、辣椒疫霉病菌、番茄灰霉病菌、番茄枯萎病菌[10,11]均由江苏省农业科学院提供。
供试植物为日本美玉番茄,由江苏省农业科学院提供。
①平板培养基(g/L):牛肉膏5、蛋白胨10、琼脂20、氯化钠5、pH 7.0~7.2、去离子水1 000 mL、121 ℃灭菌。②液体培养基(g/L):葡萄糖15、蛋白胨10、牛肉膏5、氯化钠5、硫酸锰1、磷酸二氢钾2、硫酸镁0.5、pH 7.0~7.2、去离子水1 000 mL、121 ℃灭菌。③PDA培养基(g/L):马铃薯200、蔗糖20、琼脂15~20、去离子水1 000 mL、pH 7.0、121 ℃灭菌。④LB培养基(g/L):酵母浸膏5、蛋白胨10、NaCl 10、去离子水1 000 mL、pH 7.0、121 ℃灭菌。⑤YPGA固体培养基(g/L):胰蛋白胨5、葡萄糖5、酵母膏5、琼脂20、去离子水1 000 mL、pH 7.0、121 ℃灭菌。
菌體代谢液的配制:从平板接种1环菌液到装有80 mL液体培养基的500 mL三角瓶中,按照以上最佳培养基和培养条件培养24 h,制备发酵液,浓度为108 cfu/mL。
菌悬液的配制:取部分上述发酵液, 10 000 r/min离心10 min,弃去上清液,保留菌液,经干燥测定其效价,然后用无菌水配制菌悬液,浓度为108 cfu/mL。
1.2 方法
1.2.1 对不同病原菌的平板抑制试验
1)含地衣芽孢杆菌平板的配制。从平板接种1环菌液到装有80 mL液体培养基的500 mL三角瓶中,按照以上最佳培养基和培养条件,培养24 h,制备发酵液,此后按一定的比例添加到冷却至40 ℃平板的培养基中,在超净台上倾注平板,制成含菌体平板备用。
2)含药及对照平板的配制。以多菌灵和腐霉利为阳性对照。以0.02 mol/L的稀盐酸稀释溶解多菌灵制备成母液,在LB培养基中添加合适的剂量,混合均匀,在超净台上倾注平板,制成含药平板备用;以丙酮溶解稀释腐霉利原药制成浓度为1 000 μg/mL的母液,在培养基中添加合适的剂量,混合均匀,在LB超净台上倾注平板,制成含药平板备用。
将直径为0.5 cm病原菌的菌碟菌丝朝下,分别接种在上述3种培养皿中。置于25 ℃恒温恒湿培养箱中培养。当空白对照菌落铺满平板2/3以上时,采用十字交叉法测量各平板的菌落直径,重复3次,取平均值。根据菌落直径确定药剂对病原菌生长的抑制率。
病原菌生长抑制率=(空白菌落直径-处理菌落直径)/(空白菌落直径-菌饼直径)×100%
3)番茄叶片离体试验。采摘同一株番茄上两个叶片,放入装有三片用无菌水浸湿滤纸的平板中,放入光照培养箱中,25 ℃,湿度70%,在两个叶片上同时接种番茄叶霉病菌,其中一个喷洒地衣芽孢杆菌菌液,另一个则作为空白对照。
1.2.2 地衣芽孢杆菌NJWGYH 833051在植物上的定殖试验
1)在番茄叶表的定殖试验。温室育苗,盆钵单株移栽,待番茄苗长到20 cm左右时,取在YPGA培养液中培养48 h的利福平标记菌株的菌液,噴雾接种于番茄叶片上,设不接菌为对照。每批处理24棵苗,罩膜保温,光照12 h,温度18~25 ℃。初始菌量设定为处理1 h后分离取样菌体的数量,此后分别在1、3、5、7、11、15、21 d后取样分离。
在喷菌的番茄植株上用无菌刀片随机取20 cm2叶片,剪碎,用100 mL无菌水振荡洗涤碎片30 min,随后进行梯度稀释,不同稀释度洗涤液取0.1 mL进行平板涂布,PDA平板含有400 μg/mL的利福平,每个稀释梯度涂布3块平板,于恒温恒湿培养箱中36 ℃下培养24 h,测定菌落数,并对其在番茄叶表的定殖数量(菌量用cfu/cm2表示)进行换算。
2)在番茄根部的定殖试验。温室育苗,盆钵单株移栽,待番茄苗长到20 cm左右时,取在YPGA培养液中培养48 h的利福平标记菌株的菌液,灌根接种于番茄根部,每株浇灌10 mL,设不接菌为对照。每批处理24棵苗。罩膜保温,光照12 h,温度18~25 ℃。
处理1 h后取样分离作为初始菌量,分别在1、3、5、7、11、15、21 d后取样分离1次。取样时将苗拔出,取根部土壤5 g,采用无菌水洗涤振荡30 min,然后进行梯度稀释,在含利福平浓度为400 μg/mL的PDA平板中,倾注0.1 mL不同稀释度洗涤液并进行涂布,每个稀释梯度涂布3个平板,36 ℃下培养24 h后,测定每个平板的菌落数,并换算成在番茄根部的定殖数量(菌量用cfu/g表示)。
2 结果与分析
2.1 地衣芽孢杆菌对不同病原菌的平板抑制作用
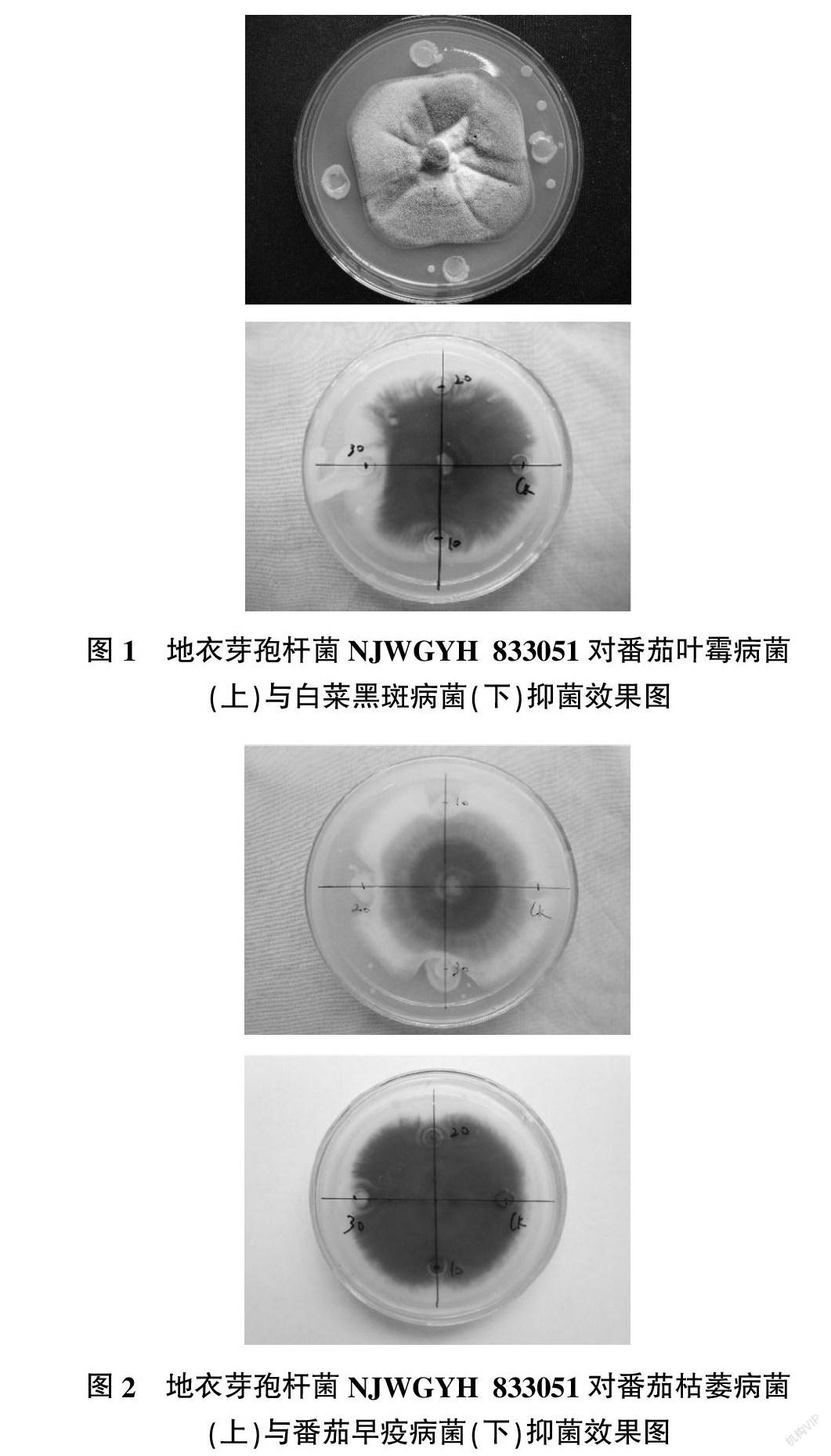
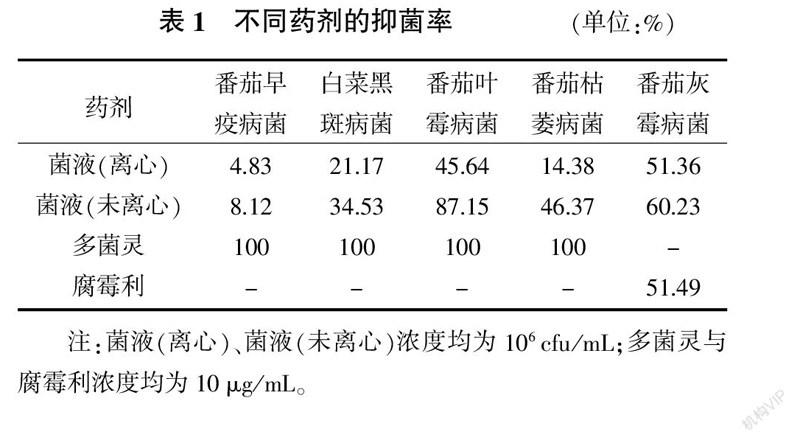
2.1.1 对不同病原菌的平板抑制试验 为考察地衣芽孢杆菌NJWGYH 833051的抑菌效果,以多菌灵和腐霉利作为对照,将不同病原菌进行平板抑菌试验,具体结果见表1。由表1可知,未离心的地衣芽孢杆菌NJWGYH 833051发酵液可以有效抑制番茄叶霉病菌,当剂量为106 cfu/mL时对其的菌丝生长抑制率达87.15%,略低于多菌灵药剂的抑菌效果;地衣芽孢杆菌NJWGYH 833051离心后对番茄灰霉病菌的抑制率为51.36%,与对照药剂腐霉利的抑制率相当;地衣芽孢杆菌NJWGYH 833051发酵液未离心时对番茄灰霉病菌的抑制率高于对照药剂腐霉利的抑制率,达60.23%。地衣芽孢杆菌NJWGYH 833051对部分病原菌的抑菌效果见表1、图1、图2。
2.1.2 番茄叶片离体试验 以离体番茄叶片为研究对象,考察了地衣芽孢杆菌NJWGYH 833051对番茄叶霉病菌的抑菌效果,结果如图3所示。由图3可以看出,1号对照叶片接种番茄叶霉病菌后3 d,其接种附近叶面开始霉变,而用地衣芽孢杆菌喷洒过的2号叶片颜色依然较绿,变化不大,说明地衣芽孢杆菌NJWGYH 833051对番茄叶霉病菌有较好的抑制作用。
2.2 地衣芽孢杆菌在番茄上的定殖效果
2.2.1 地衣芽孢杆菌在番茄叶表的定殖效果 地衣芽孢杆菌NJWGYH 833051能在番茄叶面上定殖,但随时间延长叶面上定殖的菌量会有所降低,定殖效果如图4所示。由图4可以看出,在0~30 d,喷洒地衣芽孢杆菌NJWGYH 833051菌株在番茄叶面定殖菌数为1.30×106~2.47×106 cfu/cm2鲜叶。地衣芽孢杆菌喷洒处理4 d后,菌株可能对环境不适应,菌数下降到1.81×106 cfu/cm2鲜叶,喷洒处理后第7天有1个菌数高峰,菌数达到2.24×106 cfu/cm2鲜叶,这可能是由于地衣芽孢杆菌繁殖能力和定殖能力很强,逐渐适应了环境,在短期内形成了种群优势。在后期,菌数趋于平稳,可能是叶片原有微生物恢复竞争力以及环境因素导致其菌数下降,最后趋向于平衡。
2.2.2 地衣芽孢杆菌在番茄根部的定殖效果 地衣芽孢杆菌NJWGYH 833051在番茄根部定殖效果如图5所示。由图5可以看出,地衣芽孢杆菌NJWGYH 833051能在番茄根部很好地定殖,但随时间延长根部定殖的菌量会有所降低。地衣芽孢杆菌在土壤中20 d内菌量由8.26×106 cfu/g下降到2.73×106 cfu/g。处理一周后,菌量下降,表明地衣芽孢杆菌生长环境改变后,产生了不适应;处理11 d后,菌量有所增加,说明地衣芽孢杆菌已经适应了新环境,在番茄根部进行了定殖。随后菌量逐渐下降,可能因为土壤中微生物与地衣芽孢杆菌NJWGYH 833051产生竞争作用,最后菌量到达平衡,20 d后,菌量保持在2.69×106 cfu/g左右,表明地衣芽孢杆菌NJWGYH 833051可以在番茄根际生长繁殖。
3 小结与讨论
本试验考察了地衣芽孢杆菌NJWGYH 833051对番茄早疫病菌、白菜黑斑病菌、番茄叶霉病菌、番茄枯萎病菌、番茄灰霉病菌5种致病菌的抑菌效果,结果表明,未离心的地衣芽孢杆菌NJWGYH 833051发酵液可以有效抑制番茄叶霉病菌,当剂量为106 cfu/mL时对番茄叶霉病菌的菌丝生长抑制率达87.15%,抑菌效果略低于多菌灵药剂。地衣芽孢杆菌NJWGYH 833051离心后对番茄灰霉病菌的抑制率为51.36%,与对照药剂腐霉利的抑制率51.49%接近,地衣芽孢杆菌NJWGYH 833051发酵液未离心时对番茄灰霉病菌的抑制率高于对照药剂腐霉利的抑制率51.49%,达到60.23%。通过地衣芽孢杆菌NJWGYH 833051在番茄叶面与根际的定殖效果试验,表明地衣芽孢杆菌NJWGYH 833051在番茄表面和根际的定殖能力良好,为其发挥良好的生物防治作用打下了坚实的基础。
本研究证实了地衣芽孢杆菌NJWGYH 833051具有抑菌效果,芽孢杆菌往往同时产生多种对特定病原菌具有很高活性的抑菌活性物质,从地衣芽孢杆菌中分离纯化出具有活性的抑菌物质对于新型生物农药的研制具有深远意义。后续试验将进一步研究地衣芽孢杆菌的抑菌机理,并将探索提取发酵液中的蛋白类抑菌活性物质的方法,对提取出的抑菌活性物质进行分离纯化和鉴定。
参考文献:
[1] MABROUK S,HASHEM A M,EL-SHAYEB N M A,et al. Optimization of alkaline protease productivity by Bacillus licheniformis ATCC 21415[J].Bioresource Technol,1999,69(2):155-159.
[2] 陈红歌,顾溯海,任随周,等.地衣芽孢杆菌WB-11菌株耐高温α-淀粉酶的酶学特性[J].南京农业大学学报,2004,27(1):63-66.
[3] 莫静燕.地衣芽孢杆菌原生质体的制备、再生及转化研究[D].江苏无锡:江南大学,2009.
[4] KIM Y,CHO J Y,KUK J H,et al. Identification and antimicrobial activity of phenylacetic acid produced by Bacillus licheniformis isolated from fermented soybean, Chungkook-Jang[J].Curr Microbiol,2004,48(4):312-317.
[5] 邱德文.我国生物农药产业现状分析及发展战略的思考[J].生物产业技术,2011(5):40-43.
[6] 周 燚,王中康,喻子牛.微生物农药研发与应用[M].北京:化学工业出版社,2006.
[7] 马志卿,张 兴.植物源杀虫物质的作用特点[J].植物保护,2000,26(2):37-40.
[8] 刘秀梅,聂俊华,王庆仁.多种微生物复合的微生态制剂研究进展[J].中国生态农业学报,2002,10(4):80-83.
[9] 娄予强,叶燕萍,张林辉,等.生物农药资源——鱼藤的研究进展[J].农业科技通讯,2010(1):108-111.
[10] 黃金堂.大麦白粉病抗性的遗传分析[J].麦类作物学报,2011,31(1):35-40.
[11] 唐 娟,张 毅,李雷雷,等.地衣芽孢杆菌应用研究进展[J].湖北农业科学,2008,47(3):351-355.

