在线测定秦皮甲素和秦皮乙素水解反应速率常数的ど集擦鞫注射芯片毛细管胶束电动色谱方法
朱华东 陈永雷 陈宏丽 陈兴国


摘 要 建立了在线测定秦皮甲素和秦皮乙素水解反应速率常数的扫集流动注射胶束电动色谱新方法。该方法进样频率为12次/h,可在5 min内完全分离反应体系中的所有组分,30 min即可完成一个温度下的反应速率常数测定。由于该在线测定方法不需要终止水解反应,通过一次连续进样分析得到水解反应过程电泳谱图,从而可以获得水解反应过程中的一些信息。在最佳条件时,用0.1 mol/L KOH为催化剂,测得25, 30, 35, 40和45℃时秦皮甲素的水解反应速率常数分别为3.65×10
1 引 言
秦皮作为一种常用的中药,已经有2000多年的历史,对治疗腹泻、痢疾、咳嗽和一些妇科疾病有很好的疗效,并且有一定的防癌作用[1,2]。秦皮甲素(Aesculin)和秦皮乙素(Aesculetin)是秦皮的两种主要有效成分,其结构如图1所示。药理实验表明,秦皮甲素可以延长环己烯巴比妥对小鼠的催眠作用,而秦皮乙素则没有此作用;秦皮甲素也不具有秦皮乙素的抗组胺作用以及放松对豚鼠离体气管平滑肌的作用。由于它们在潮湿的环境中性质不稳定,因此建立一种简单、经济、可靠的研究秦皮甲素和秦皮乙素的水解方法对此类药物的质量和稳定性评价具有重要意义。
毛细管电泳(Capillary electrophoresis, CE)由于具有所需样品量小、分析时间短和分离效率高的优点而适用于化学反应动力学参数的测定[3~10]。Zhang等[7]利用离线CE方法测定了秦皮甲素碱性水解反应速率常数和活化能。该方法虽然可行,但存在检测反应液中目标化合物需先用磷酸溶液终止反应、每次实验只能得到所需要测定的动力学参数中的一个点等缺点。在测定速率常数时,至少需要对反应过程中5个不同反应时间点的反应液进行分析。若欲测定不同温度、pH值、离子强度、溶剂等条件下的动力学参数,可能需要几十甚至上百次实
图1 秦皮甲素和秦皮乙素的化学结构式
Fig.1 Chemical structure of aesculin and aesculetin
验,这给反应动力学研究带来了极大不便。离线分析表明秦皮甲素水解生成秦皮乙素和葡萄糖。从这一结果看,秦皮甲素的内酯键在碱性条件下似乎是稳定的。然而,Chen等[11]的研究表明,烯醇式和内酯结构很容易在碱性条件下解离。此外,Dodge[12]指出,香豆素的碱性水解和其内酯形成是一个可逆过程,当碱过量时,水解完全。但是,过量的碱一旦被中和,则开始进行逆水解过程,即开始形成香豆素,直到达到平衡点。很明显离线分析只给出了水解反应终止后的秦皮甲素水解反应在平衡状态的信息,而无法获得亚稳状态的一些信息。而这些信息对研究秦皮甲素类药物的物理、化学、生物性质的各个过程可能是非常重要的。迄今为止,测定秦皮乙素水解反应速率常数的工作尚未见报道。由此可知,有必要建立在线研究秦皮甲素和秦皮乙素水解反应的新方法。
自从1997年Kubán[ 13]和Fang[14]等分别建立了流动注射毛细管电泳(FIchip CE)技术以来,FIchip CE已经广泛应用于各种分析领域[15~24], 并在此基础上形成了流动注射芯片毛细管电泳(FIchip CE)。由于具有高样品吞吐量和连续进样等优点,FIchip CE非常适用于化学反应动力学研究。然而,迄今为止,该技术很少用于水解动力学研究中。
鉴于此,本研究建立了一种简单快速的在线测定水解反应速率常数的扫集流动注射毛细管胶束电动色谱(SweepingFIchip MEKC)方法, 并将其用于测定秦皮甲素和秦皮乙素的水解反应速率常数。
2 实验部分
2.1 试剂
秦皮甲素和秦皮乙素均购于中国药品生物制品检定所。十六烷基三甲基溴化铵(CTAB)、十二烷基硫酸钠(SDS)、Na2B4O7、KH2PO4、HCl、KOH和乙腈(ACN)购于天津第二试剂厂。所有试剂均为分析纯。所用水均为蒸馏水。
2.2 FIchip CE系统
用于在线研究秦皮甲素和秦皮乙素水解反应的装置由K1000 FIA型流动注射分析仪(HITACHI,日本)、H通道微芯片联用接口和HPE100型电泳仪(BioRad 公司,美国)组成,整个装置如图2所示。用一根33 cm的PTFE (0.5 mm I.D.)泵管连接FI的进样阀和分流接口。通过FI的蠕动泵流路将缓冲溶液或水输送到位于试剂环两边的两个20 μL的试剂环中,将样品溶液输送位于中间的样品环中。采用手动进样模式。用恒温水浴控制水解反应温度,用磁力搅拌器混合反应物,置于恒温水浴中的10 mL烧瓶作为反应器与输送载流溶液(即运行缓冲溶液)的柱塞泵相连接。用有效长度为22.0 cm (总长25.0 cm)、内径75 μm的熔融石英毛细管作为分离通道(河北永年光导纤维厂)。检测波长为334 nm。用Chroma 软件(BioRad 公司,美国)采集处理电泳数据。
.
2.3 样品和试剂制备
用10%甲醇配制秦皮甲素(1.00 mmol/L)和秦皮乙素(0.80 mmol/L)储备溶液,保存于4℃冰箱内备用。用10%甲醇稀释上述储备液, 得到浓度分别为0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70, 0.80, 0.90和1.00 mmol/L秦皮甲素标准溶液和0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70和0.80 mmol/L秦皮乙素标准溶液。分别配制0.1 mol/L Na2B4O7、0.2 mol/L KH2PO4、0.04 mol/L CTAB和0.2 mol/L SDS储备溶液。分离缓冲溶液为5 mmol/L Na2B4O710 mmol/L KH2PO42.0 mmol/L CTAB5% ACN (pH 6.0)和10 mmol/L Na2B4O720 mmol/L KH2PO45.0 mmol/L SDS (pH 6.0)。所有溶液均用0.45 μm滤膜(上海新亚净化器件厂)过滤。
2.4 实验操作步骤
2.4.1 FI和CE操作步骤 采用16通自动进样阀完成FI充样(Loading)和注样(Injecting),具体操作参见文献[17]。
为保证良好的重现性,每天运行前分别用水、0.1 mol/L NaOH、水、缓冲溶液依次冲洗毛细管5 min。两次运行之间毛细管依次用水(2 min)、0.1 mol/L NaOH (3 min)、水(2 min)、缓冲溶液(3 min)冲洗。
2.4.2 水解反应速率常数测定步骤 先将恒温水浴调节到水解所需的温度(分别为25, 30, 35, 40和45℃)。再将1.0 mL 1.00 mmol/L秦皮甲素溶液和1.0 mL 0.2 mol/L KOH溶液分别在恒温水浴中预热至相应温度并恒温15 min。然后将这两种溶液用磁力搅拌器快速混合,同时,取反应混合溶液进样并计时,进行分离、测定。此后每隔5 min进样一次并进行分离测定。然后按同样步骤分别在15, 20, 25, 30和35℃时测定秦皮乙素的水解反应速率常数。
3 结果与讨论
3.1 CE条件优化
为了依据FIchip CE体系测得的数据研究秦皮甲素和秦皮乙素的水解速率常数,就必须要求CE能将二者的水解产物与共存物质完全分离。为此,必须对CE条件进行优化。
本实验先用5 mmol/L Na2B4O710 mmol/L KH2PO4 (pH 6.0)作缓冲溶液[7]。结果表明,在此条件下只能得到两个“矮胖”峰(电泳图未给出)。其原因是样品溶液中含有0.1 mol/L KOH,其电导率比缓冲溶液高得多,发生了去堆积效应。该效应可以通过在缓冲溶液中加入CTAB以形成胶束电动色谱来消除[25]。实验考察了CTAB浓度在1.0~5.0 mmol/L范围内变化时对峰高和峰形的影响。结果表明,当其浓度为2.0 mmol/L时,峰形和峰高最好。为了进一步改善分离效率,实验还考察了乙腈作添加剂的可行性和其浓度的影响。结果表明,用乙腈作添加剂可有效提高分离效率,且当乙腈浓度为5%时,峰形最好。
FIchip CE的最大采样频率取决于水解反应时间和CE的分离速度,短的分离时间和高样品吞吐量将有利于快速动力学研究。为此,实验考察了电压对分离时间和采样频率的影响。结果表明,虽然使用高电压会提高分离速度、缩短分离时间,但同时会增加基线噪声,使检出限变高。当电压为
Symbolm@@ 6.0 kV时(CTAB使EOF逆转,需要采用负高压),秦皮甲素和其水解产物在5 min内可得到完全分离,但是当电压大于
Symbolm@@ 6.5 kV时,秦皮甲素和其水解产物的峰发生部分重叠。所以用
Symbolm@@ 6.0 kV作为最佳电压。
在研究秦皮乙素的水解反应时,仍先用5 mmol/L Na2B4O710 mmol/L KH2PO4 (pH 6.0)作缓冲溶液,结果表明在此条件无法将目标分析物分离。随后采用10 mmol/L Na2B4O720 mmol/L KH2PO4 (pH 6.0)为缓冲溶液,此时,采用文献[7]中使用的0.4 mmol/L的初始反应物浓度时,秦皮乙素的峰高为2.1 mAU,水解10 min后几乎检测不到秦皮乙素的峰。这是由于使用紫外检测器的FIchip CE低灵敏度导致的。为解决这一问题,实验采用在线“扫集”技术[25~29],即建立了在线扫集流动注射芯片胶束电动色谱(SweepingFIchip MEKC)体系。具体步骤如下,用100 μL的样品环和1.0 mL/min的流速增加进样体积,在缓冲溶液中加入SDS形成胶束并实现MEKC分离。由于样品溶液中不含SDS,施加电压后SDS胶束将样品区带扫集到一个狭窄的区带,从而达到富集效果。实验考查了SDS浓度在5~30 mmol/L范围内变化时对灵敏度的影响,结果表明,SDS的浓度为10 mmol/L时灵敏度最高。在此条件下,0.4 mmol/L秦皮乙素的峰高为22.5 mAU,灵敏度提高了10.7倍。因此,选择10 mmol/L Na2B4O720 mmol/L KH2PO410 mmol/L SDS (pH 6.0)作为运行缓冲溶液。当电压为6.5 kV时,秦皮乙素和其水解产物在5 min内可很好地分离。当电压大于6.5 kV时,基线噪声变差,分离度明显下降。因此选择6.5 kV作为最佳分离电压。
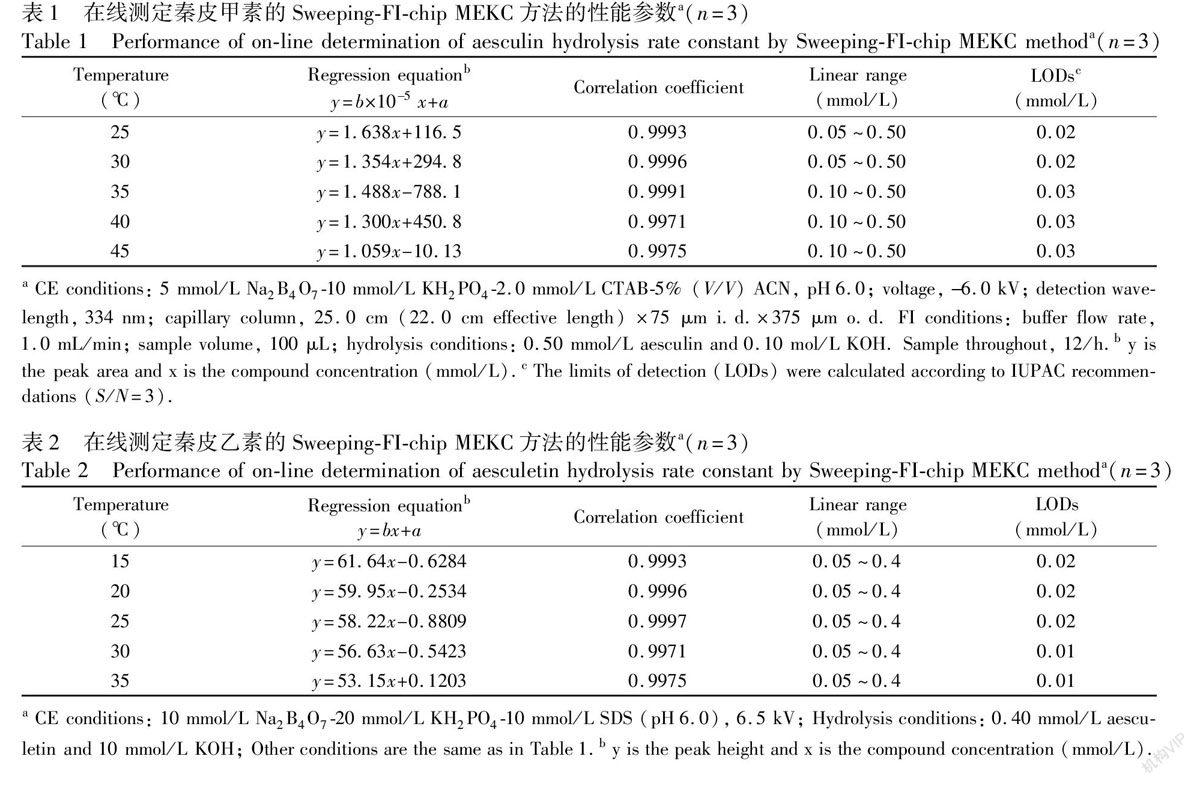
3.2 在线SweepingFIchip MEKC方法的性能
为了准确测定秦皮甲素和秦皮乙素水解反应速率常数,要求用于定量分析二者浓度的方法必须具有高准确度和精密度。为此,我们通过实验对本文所建立的在线SweepingFIchip MEKC方法的性能进行了考察。在最优条件下,以每5 min进一次样(12次/h)的频率连续进样、分离和测定,结果见表1和表2。由表可见,各个水解反应条件下的反应物的峰面积或峰高与其浓度的回归方程的线性相关系数均大于0.997,而且秦皮甲素和秦皮乙素两者的峰面积相对标准偏差分别为1.4%和1.1%, 峰高相对标准偏差分别为1.2%和0.9%, 迁移时间的相对标准偏差分别为0.4%和0.6%。结果表明,本方法可以准确测定秦皮甲素和秦皮乙素的浓度。
上述结果表明,所建立的方法灵敏度高、重现性好,完全满足在线研究秦皮甲素和秦皮乙素水解动力学的要求。
3.3 秦皮甲素水解速率常数的在线测定
秦皮甲素在30℃时水解反应后所得溶液的电泳谱图如图3所示。在秦皮甲素峰的前面有3个未知化合物峰。随水解时间的增加,其中一个峰的峰高变化不规则,另外两峰的峰高增加,同时秦皮甲素的峰降低。这些现象表明,3个未知化合物是秦皮甲素的水解产物或水解中间体。有趣的是,这个结果与以往离线用磷酸溶液终止秦皮甲素水解反应后测定其动力学参数的结果不同[11]。这是因为离线测定给出的是秦皮甲素水解平衡状态的信息,而用SweepingFIchip MEKC在线测定时,秦皮甲素在碱过量条件下进行水解,如前所述,当碱过量时,香豆素结构中的内酯结构很容易解离,水解进行完全,过量的碱一旦被中和(用磷酸溶液终止水解反应),则将重新形成内酯结构,直到达到平衡点,这说明在线测定给出的是秦皮甲素水解过程中的信息。
1, 秦皮甲素; 2~4, 秦皮甲素的水解产物。
Conditions are the same as in Table 1. 1, aesculin; 2-4, the aesculin hydrolyzates
在上述条件下也测定了秦皮甲素在25℃, 35℃, 40℃及45℃的水解速率常数。实验结果表明,水解速率随温度的升高迅速增大。25℃时,秦皮甲素在2 h内水解完全,当温度升高到45℃时,水解时间缩短为0.5 h。
秦皮甲素在一定的反应时间(t)的瞬时浓度(c)通过如下方法获得:准确地记录从反应开始到每次注射时间t,而使用校准曲线计算得到c。以logc对t作图在各个温度下均得到一条直线,说明秦皮甲素水解类似一级反应。由于水在水解过程中是大量的,其浓度可认为是常数。因此,水解速率常数k可以用一级动力学方程(1)计算:
3.4 秦皮乙素水解速率常数的在线测定
当用同样的方法测定秦皮乙素水解速率常数时的电泳谱图见图4。由图可见,由于KOH浓度很大(0.1 mol/L),导致秦皮乙素剧烈水解,25℃时水解30 min即反应完全。要测定秦皮乙素水解速率常数,至少需要5次精确进样分析,实验中FIchip CE的采样频率为12次/h,25℃时勉强可以通过5次进样测定秦皮乙素水解反应速率常数,而在30℃, 35℃, 40℃和45℃时则无法测定。考虑到秦皮乙素类药物一般在室温和酸碱性温和的条件下生产或存放,因此测定了1535℃、10 mmol/L KOH条件下秦皮乙素水解反应速率常数。结果见表4。由Arrhenius方程计算的活化能为31.55 kJ/mol。
4 结 论
建立了在线测定秦皮甲素和秦皮乙素水解速率常数的sweeptingFIchip MEKC的方法。本方法不需要终止反应,30 min内可以测定至少5个点的数据,满足了测定水解反应速率常数对分析速度的要求。与传统的离线测定化学反应常数的方法相比,本方法简单、快速、准确。
References
1 Kaneko T, Tahara S, Takabayashi F, Harada N. Free Radical Res., 2004, 38(8): 839-846
2 Wang C J, Hsieh Y J, Chu C Y, Lin Y L, Tseng T H. Cancer Lett., 2002, 183(2): 163-168
3 Biyani M, Nishigaki K. Electrophoresis, 2001, 22(1): 23-28
4 Wang J, Chatrathi M P, Tian B M, Polsky R. Anal. Chem., 2000, 72(11): 2514-2518
5 Kunkel A, Günter S, Wtzig H. Electrophoresis, 1997, 18(10): 1882-1889
6 Kunkel A, Günter S, Wtzig H. J. Chromatogr. A, 1997, 768(1): 125-133
7 Zhang L, Tong P, Chen G N. J. Chromatogr. A, 2005, 1098(1-2): 194-198
8 ZHANG LingYi, REN Jun, PENG Li, LIU Fan, ZHANG WeiBing. Chinese J. Anal. Chem., 2015, 43(10): 1545-1550
张凌怡, 任 俊, 彭 丽, 刘 翻, 张维冰. 分析化学, 2015, 43(10): 1545-1550
9 Chen Y F, Xu L L, Zhao W W, Guo L P, Yang L. Anal. Chem., 2012, 84(6): 2961-2967
10 Kanoatov M, Galievsky V A, Krylova S M, Cherney L T, Jankowski H K, Krylov S N. Anal. Chem., 2015, 87(5): 3099-3106
11 Chen Q H, Hou S X, Zheng J, Bi Y Q, Li Y B, Yang X J, Cai Z, Song X R. J. Chromatogr. B, 2007, 858(12): 199-204
12 Dodge F D. In the Meeting at New Orleans, 1915: 446-448
13 Kuban P, Engstrm A, Olsson J C, Thorsén G, Tryzell R, Karlberg B. Anal. Chim. Acta, 1997, 337(2): 117-124
14 Fang Z L, Liu Z S, Shen Q. Anal. Chim. Acta, 1997, 346(2): 135-143
15 Chen H L, Wang K T, Pu Q S, Chen X G, Hu Z D. Electrophoresis, 2002, 23(17): 2865-2871
16 Cheng Y Q, Fan L Y, Chen H L, Chen X G, Hu Z D. J. Chromatogr. A, 2005, 1072(2): 259-265
17 Fan L Y, Cheng Y Q, Li Y Q, Chen H L, Chen X G, Hu Z D. Electrophoresis, 2005, 26(22): 4345-4354
18 Liu X M, Zhang J S, Chen X G. J. Chromatogr. B, 2007, 852(12): 325-332
19 Liu X M, Liu L H, Chen H L, Chen X G. J. Pharm. Biomed. Anal., 2007, 43(5): 1700-1705
20 Liu L H, Fan L Y, Chen H L, Chen X G, Hu Z D. Electrophoresis, 2005, 26(15): 2999-3006
21 Pan Z W, Chen X G, Hu Z D. Biomed. Chromatogr., 2004, 18(8): 581-588
22 Zhu H D, Lü W J, Li H H, Ma Y H, Hu S Q, Chen H L, Chen X G. Analyst, 2011, 136: 1322-1328
23 Hartwell S K, Kehling A, Lapanantnoppakhun S, Grudpan K. Anal. Lett., 2013, 46(11): 1640-1671
24 Clavijo S, Avivar J, Suárez R, Cerd V. TrAC, Trends Anal. Chem., 2015, 67: 26-33
25 Palmer J, Munro N J, Landers J P. Anal. Chem., 1999, 71(9): 1679-1687
26 Quirino J P, Terabe S. Science, 1998, 282(5388): 465-468
27 Quirino J P, Terabe S. Anal. Chem., 1999, 71(8): 1638-1644
28 Quirino J P, Terabe S, Bocek P. Anal. Chem., 2000, 72(8): 1934-1940

