器官芯片及其应用
孙威 陈雨晴 罗国安 张敏 章弘扬 王月荣 胡坪


摘 要 微流控芯片是细胞体外培养的重要平台,基于该平台所发展的器官芯片技术更因其能够模拟人体器官的复杂结构及功能而受到重视。本文从不同器官的角度介绍了近年来器官芯片技术在构建人体生理学模型、药物研发及毒理学研究中的应用,并对器官芯片技术的发展前景进行了展望。
关键词 微流控芯片; 器官芯片; 细胞; 人体器官; 综述
1 引 言
自2011年美国总统奥巴马宣布启动由NIH、FDA和国防部联合设立的人体芯片(Humanonchip)[1]专项以来[2],在全世界范围内掀起了人体芯片的研究热潮。所谓人体芯片,就目前的研究水平而言,更确切地说是芯片仿真人体器官系统(Organonachip systems),也称为器官芯片(Organsonchips)[3],是一种利用微加工技术,在微流控芯片上制造出能够模拟人类器官的主要功能的仿生系统[4]。除了具有微流控技术微型化、集成化、低消耗的特点[5]外,器官芯片技术能够精确地控制多个系统参数,如化学浓度梯度[6]、流体剪切力[7]、以及构建细胞图形化培养[8]、组织组织界面[9]与器官器官相互作用[10]等,从而模拟人体器官的复杂结构、微环境和生理学功能。
人体生理学研究是生命科学研究的重要部分,传统的二维细胞培养模式在研究人体病理生理学方面已经取得了许多成就,但是这些简单的模式难以体现人体组织器官复杂的生理功能[11],因此研究人员常使用动物实验代替体外培养模式。然而,动物实验也存在周期长、成本高等缺点,且动物模型常常不能预测人体对于各种药物的响应[12]。器官芯片概念的提出,正是为了解决动物实验的诸多不足,希望在芯片上建立更加真实的生理模型,并能成为一种仿生、高效、节能的生理学研究及药物开发工具。
经过近几年来的快速发展,研究人员已经在微流控芯片上实现了众多人体器官的构建,如芯片肝、芯片肺、芯片肠、芯片肾、芯片血管、芯片心脏以及多器官芯片等。不仅如此,知名研究单位和制药公司之间的合作已使器官芯片步入了实用阶段。据报道,荷兰生物技术公司Mimetas研发了一种芯片肾,并与几家制药公司达成了应用合作协议将其用于药物筛选[13]。另外,强生公司也计划利用哈佛大学wyss生物工程研究所隶属Emulate公司的人体血栓仿真芯片系统进行药物试验,并利用肝芯片测试药物的肝毒性[14]。
2 器官芯片的设计理念
细胞的生长需通过各种复杂的外环境与内环境的协同作用共同完成。因此在建立体外生理学模型时需要考虑外界环境参数的真实性[15]。将微流控技术与微加工、细胞生物学相结合而产生的器官芯片技术在对外界环境参数的控制中具有其他技术难以比拟的能力,通过产生流体剪切力、机械应力、生化浓度梯度等理化刺激,细胞能够响应这些刺激而发生自组装,展现更加真实的生理学功能,因而在体外生理学模型建立中具有特殊的优势[16]。
(1) 产生流体剪切力 流体的流动会产生剪切力,人体内每时每刻都存在着流体的流动,而传统静态培养却无法给与系统剪切力。微流控技术能够通过微泵灌流实现细胞的动态培养,这有利于稳定地给予细胞营养物质并及时将废物排出,且相比于静态培养,细胞所处的动态环境与体内更为相似。此外,灌流培养产生的流体剪切力对于人体的部分生理学功能如肾的重吸收而言必不可少[17]。
(2)提供动态的机械应力 人体内存在着与生命活动相关的压力,如血压、肺部压力、骨骼压力等。这种稳态压力对于维持机体的生理学功能如组织形成、细胞的分化甚至是肿瘤的形成具有重要的作用[18]。微流控技术能够利用弹性多孔膜制造周期性的机械应力,例如将细胞培养于多孔膜上,利用外界作用力使多孔膜发生形变从而模拟部分生理功能,如肺的呼吸、肠道蠕动以及心脏收缩等。
(3)形成浓度梯度 由于在微尺度下,流体主要以层流形式运动,这有利于在通道中产生各种类型的浓度梯度[19]。以浓度梯度作为驱动的各种生化信号对于许多生理过程如细胞迁移、分化、免疫反应以及癌症的转移等起着关键的作用[20]。微流控技术能够通过改变流速与通道尺寸,并利用微阀、微泵技术或独特的通道设计等实现稳定的、三维的生化浓度梯度,从而模拟人体内各种复杂的生理学过程[21]。此外,多通道的浓度梯度的实现为芯片上药物的高通量筛选提供了可能性。
(4)实现细胞图案化培养 人体的组织不是由单一的细胞堆叠而成,而是需要多种细胞有序的排列,通过复杂的相互作用形成功能化的整体。微流控技术对细胞具有超强操控能力,模板法[22]、表面修饰[23]、电化学法[24]、层流[25]、微柱结构[26]等都有助于实现在芯片上的细胞图案化。这对构建具有一定复杂几何结构的体外生理学模型大有裨益,同时能够为研究细胞细胞相互作用、细胞细胞外基质相互作用提供一个理想的平台。
3 器官芯片的研究进展
3.1 芯片肝
肝脏是人体内最重要的药物代谢器官,药物的肝毒性研究是新药开发的重要内容。传统静态二维细胞培养模式下的肝细胞由于缺失与细胞外基质的联系,很快就会失去肝功能[27],且它们缺乏持续的灌流,不能理想地模拟生物微环境,而利用微流控技术与组织工程学能够使具有肝功能的细胞自组装,从而保持部分肝功能。现有的芯片肝大多着眼于在芯片上建立肝脏的部分生理学模型,如胆小管、肝小叶、肝血窦模型等,并且利用这些模型进行药物筛选及毒理学研究。例如,在早期的研究中,Lee等[28]设计了一种仿内皮细胞间隙结构的芯片并在其中培养原代肝细胞,培养液于间隙外部进行灌流培养,如图1所示。这是首次在芯片上建立的肝血窦模型,具有高度渗透性的内皮间隙结构能够将索状结构中的原代肝细胞与外部血窦样区域分离,但又能够进行物质交换。在缺乏外基质的条件下细胞能够存活7天,在药物扶他林的作用下,细胞在短时间(4 h)内几乎没有显示毒性,但在较长时间(24 h)作用下发生死亡,表明此模型中的肝细胞具有生理活性。该研究为之后芯片肝模型的建立奠定了基础。Ho等[24]利用介电泳产生的放射状电场梯度,将肝细胞与上皮细胞图案化排列在一个圆形PDMS芯片上,成功模拟了肝小叶结构。在随后的研究中,该课题组改进了此模型,设计了“蜂巢”形状的仿肝小叶介电泳阵列,并研究了细胞细胞相互作用,结果表明,肝小叶结构能够有效增加CYP1A1酶的活性。Hegde 等[29]制造了一个双层芯片,通过多孔PET膜将通道分隔,并通过上层通道持续灌流培养下层通道中的胶原和纤连蛋白夹心的大鼠原代肝细胞,在芯片上建立了肝细胞“三明治”培养法。经超过两星期的培养,肝细胞能够形成胆小管结构,并实现了一定的肝功能。
与现有的体外肝脏模型相比,芯片肝的主要优势在于能够在微米尺度形成具有部分肝功能的肝细胞簇,从而建立更加接近人体形态学的肝模型,并能够在较长时间内保持肝脏特异性功能[30]。由于微流控技术具有高内涵筛选的潜力,如何实现芯片肝的多参数、大通量的快速分析将成为研究人员下一步的研究重点。
3.2 芯片肾
肾脏是人体重要的排泄器官,对维持体内渗透压与自稳态具有重要的作用。肾脏的基本功能单元是肾单位,能够通过生成尿液借以清除体内代谢产物及废物,并且通过重吸收功能保留水分及其他营养物质[31]。对于肾单位功能的影响因素中,流体剪切力的影响非常重要,它能够改变肾脏细胞的功能与形态,并与某些疾病如多囊性肾病有密切关系。Jang等[32]设计了一个双层芯片模拟肾近球小管结构,并在系统中引入1 dyn/cm2的流体剪切力。芯片由多孔弹性膜分为两层,在上层通道贴膜培养人原代近端肾小管上皮细胞。在流体剪切力作用下,细胞的白蛋白转运和葡萄糖重吸收能力能够分别达到Transwell实验的2倍与3.5倍,充分证明了流体剪切力对于构建肾脏生理学模型的重要性。研究人员通过此芯片肾测试了顺铂的细胞毒性并与传统的Transwell培养进行了对比[33],在下层流体中定量(100 μmol)加入顺铂溶液,灌流作用24 h,引起细胞死亡,检测乳酸脱氢酶活性,同时使用VFITC与PI染色法检测细胞活率,结果表明,在相同条件下,芯片肾中细胞活率大于Transwell培养。
在肾脏病理生理学方面,Zhou等[34]在一个圆形十二通道的芯片上研究了上皮间质转化引起的肾间质纤维化。将人近端肾小管上皮细胞置于恒定流速的血清蛋白中,观察到细胞出现了间质表型转变,且在加入C3a补体后也能得到同样的结果,而在高温灭活的血清中并没有观察到此现象的发生,这为研究这一病理过程提供了一个新的视角。Wei等[35]设计了一个单层管状通道的微流控芯片,在管壁上培养单层的人肾小管上皮细胞(HK2),通过加入含有CaCl2与Na3PO4的HBSS缓冲液模拟了肾磷酸钙结石的生成,首次在芯片上建立了体外肾结石模型并具有成为此疾病模型的潜力。
除了PDMS材料,水凝胶材料也成功应用于肾生理学模型的建立,Mu等[36]通过水凝胶键合技术将两块水凝胶拼接在一起,形成两个平行的三维微脉管网络,建立了肾单元的生理模型,可在不同的水凝胶通道中培养不同的细胞,如 MDCK细胞与人脐静脉内皮细胞(HUVECs)细胞,并通过水凝胶的传质作用实现肾单元被动扩散的模拟。此水凝胶结构能够在芯片上建立更加复杂的质量运输的生理学肾模型,增加芯片肾的多样性与复杂性。
3.3 芯片肠
肠是消化管中最长的一段,也是消化功能最重要的一段。大部分药物都是通过口服进入人体,口服药物须经过小肠进入血液循环,因此研究药物经肠道细胞的吸收成为了药物筛选的重要步骤[37]。小肠壁上的绒毛使得小肠拥有巨大的表面积,从而达到快速吸收营养物质的作用,所以芯片上小肠绒毛形态学的建立对研究肠功能具有重要的意义。Sung等[22]通过激光烧蚀、PDMS软光刻技术,并使用水凝胶作为模板,首次在芯片上构建了“梳子”状3D水凝胶结构以模拟人的肠道绒毛结构,该结构与人肠绒毛的形状与分布密度接近,长度约450~500 μm。研究人员通过在水凝胶表面覆盖一层人肠上皮细胞(Caco2)进行细胞渗透率与跨膜电阻(TEER)的测定,发现相对于传统2D模型,此模型更加接近人体实际情况。进一步实验可在水凝胶结构内引入血管内皮细胞从而制作更加复杂的生理学模型,并进行药物吸收实验。
肠道具有特殊的运动方式,包括分节收缩、肠道蠕动和肠绒毛的运动,而肠道蠕动在对营养物质的消化及吸收中具有重要的作用。为了模拟人体肠道蠕动,Kim等[38]设计了一个双层PDMS芯片,通过弹性多孔膜将两层通道分隔,在真空泵的作用下周期性的拉伸(0.15 Hz)该PDMS膜以模拟人体肠道蠕动的扩张与收缩。同时,在膜上培养了Caco2细胞并通过实验证明经过周期性的伸缩,细胞能够分化并形成人体肠道内的肠绒毛结构。更为重要的是,研究人员还将人肠道内寄生的大肠杆菌与上皮细胞进行共培养,结果表明二者的共存能够增加Caco2细胞的屏障功能。此研究实现了包括循环机械应力、流体剪切力以及微生物共培养等多个生理学相关参数的控制,高度真实地反映了人肠道复杂的生理学状况,并取得了一定的研究成果。此外,Esch等[39]在不同形状的硅基质阵列上固定一层SU8多孔膜,随后利用二氟化氙将硅基质除去,得到一层三维膜。在该膜上培养Caco2细胞并通过荧光检测发现,细胞能够形成小肠绒毛结构并分泌闭合蛋白,表明细胞之间能够形成紧密连接。
虽然器官芯片技术对复杂的肠道生理学功能进行了精确的模拟,但鲜有通过芯片肠对药物吸收能力进行研究。Imura等[40]制作了一个由多孔膜分隔的双层芯片肠并测定了环磷酰胺和荧光黄的吸收率。因此,在已有的肠模型基础上实现药物吸收的测定应成为下一步的研究方向。
3.4 芯片肺
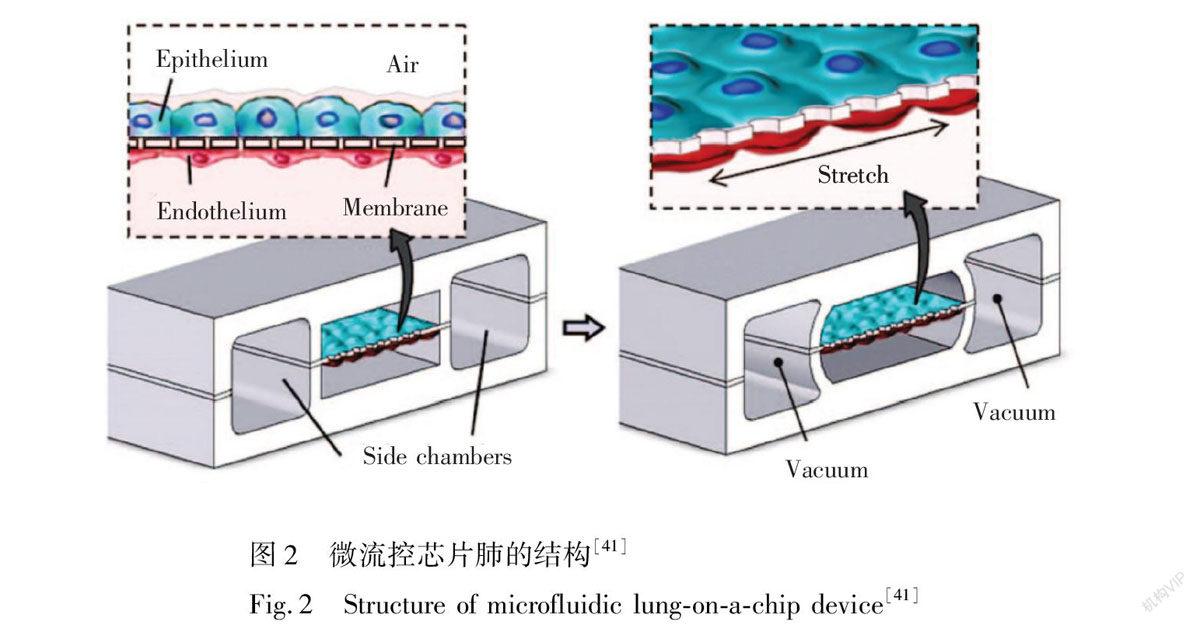
肺是人的呼吸器官,肺泡是肺部气体交换的主要部位,也是肺的功能单位。肺泡由一层单层上皮细胞和肺毛细血管内层的内皮细胞构成,具有复杂的生理结构。因此,传统的体外培养模式难以对肺的生理模型进行准确模拟,而微流控技术因其对流体流量及芯片尺寸的精确控制、持续的流体灌输以及持续的气体交换能力为建立体外肺模型与肺的病理学研究提供了一个强有力的平台。Huh等[41]构建了一个双层芯片肺以模拟人的呼吸过程,其结构如图2所示。由图2可见,该芯片分为上下两层,上层为气体通道,下层为液体通道,中间由一个多孔弹性的PDMS膜将其分隔,膜的上侧培养置于气液界面的人肺泡上皮细胞,下侧则是浸润在动态流体环境中的血管内皮细胞,从而模拟人肺泡毛细血管屏障;同时在通道的左右两侧存在两个与真空泵连接的侧通道,通过有规律的真空条件变化(0.25 Hz)引起PDMS膜发生形变以模拟人呼吸时肺泡壁的扩张和收缩,而这在传统的体外模型中是难以实现的。更重要的是,该模型能够通过在气道引入炎症刺激物,并在液体通道加入中性粒细胞引起系统的生理学响应,并用于纳米毒性的研究。随后的工作中,通过引入白细胞介素2,研究人员成功建立了基于微流控芯片的肺水肿病理学模型[42]。
肺泡壁仅由一层上皮细胞组成,容易受到损伤而导致破裂。基于微流控平台的肺上皮细胞的损伤模型有剪切力模型、机械拉伸模型以及两种作用力同时具备的模型[43]。例如Huh等[44]设计了一个自动化的芯片用于研究流体剪切力对细胞的损伤,芯片由上下两个流体通道构成,通道由一个多孔聚酯膜分隔,下层通道通入液体,上层接种小气道上皮细胞,同时注入液塞流,液塞流在流动过程中产生流体剪切力,从而建立细胞损伤模型。基于此模型,他们还成功设计了一种微流体肺气道芯片[45],模拟了呼吸道表面液体(ASL)淤积导致的液塞流对肺上皮细胞的损伤。研究表明,大量的细胞损伤发生在液塞流传播过程,而表面活性物质能够有效防止细胞死亡,提示表面活性物质可以作为包括急性呼吸窘迫综合征等多种病症的潜在治疗手段。
虽然上述芯片肺模型已经具有一定的生理学结构,但是由于肺部结构的复杂和特殊性,现有的芯片肺模型仍相对简单。因此,在芯片上实现更多的肺部生理学结构模拟,建立一个完整的芯片肺模型将成为研究人员研究的重点。
图2 微流控芯片肺的结构[41]
Fig.2 Structure of microfluidic lungonachip device[41]
3.5 芯片心脏
成熟的心肌细胞是一种高度极化的细胞,具有收缩性。心肌细胞的收缩性与其外界的物理化学环境存在着紧密的联系,如流速、钙离子浓度、基底物质、电刺激等[46]。近几十年来,研究人员致力于制造功能性心脏模型,并取得了许多重要的成果。但是这些模型的结构、生理学结构以及外部支持使其无法与微流控技术相结合。而微流控技术是在微观尺度上利用对心脏组织的微操控获得更加接近生理的形态学、电生理学以及收缩性数据。Grosberg等[47]在一块弹性薄膜表面覆盖一层心肌细胞薄片,通过施加电刺激研究心肌细胞的收缩性。此外,研究人员采用了实时数据分析技术检测装置中肾上腺素的动态变化,检测范围为10
Symbolm@@ 12~10
Symbolm@@ 4 mol/L。
心肌缺氧会导致心肌细胞损伤,从而引起心律失常、局部缺血和心力衰竭。Ren等[48]设计了一种微流控仿生芯片,用于模拟缺氧对心肌细胞的损伤。该芯片利用两列平行的微柱阵列构造毛细血管内皮屏障,从而精确模拟了心肌组织的结构功能。当不同浓度的解偶联剂FCCP作用于心肌细胞时,细胞出现了凋亡现象,且与FCCP的浓度及作用时间存在一定相关性。Ca2+的调控是心肌细胞的主要特征功能之一,而在细胞急性缺氧时该功能会受到影响。为了研究在缺氧早期细胞内钙离子浓度的变化,Martewicz等[49]设计了一个能够在线检测细胞内Ca2+动态变化的芯片,通过快速改变芯片内氧浓度模拟细胞急性缺氧,证明了缺氧可诱导新生大鼠心肌细胞内Ca2+浓度的可逆变化。
大多数基于微流控技术的心脏模型使用的是PDMS材料,但是PDMS不利于细胞在芯片上的粘附。为此,Annabi 等[50]使用了两种细胞兼容的水凝胶GelMA与Metro分别覆盖于PDMS通道表面,以促进心肌细胞在芯片表面的粘附。与GelMA覆盖的通道相比,Metro表面生长的原代心肌细胞表现出了更好的粘附性与收缩性。
现有的器官心脏模型通过改变外界参数很好的体现了心肌细胞的收缩性,为了建立更加真实的心脏模型,更多因素如三维环境以及共培养模式应成为研究的重点。此外,现阶段在芯片上使用的细胞多为哺乳动物心肌细胞,因此,下一阶段研究尤其是药物毒性测试实验需要使用更多的人类细胞以获得更加真实的结果。
3.6 芯片血管
血管是指血液流经的一系列管道,是连接各个器官并实现器官之间物质交换的重要部分,微血管网络对维持新陈代谢以及组织微环境的稳定具有重要作用。建立体外血管形态学与生理学模型能够加快对微血管网络这一复杂系统的病理生理学研究[51]。因此,芯片血管的建立对于研究体外器官间相互作用乃至“Humanonchip”构建具有重要的意义。Kim等[52]设计了一个三维灌注式芯片,芯片由5个平行的通道组成,通道之间存在着微柱阵列将其分隔,但可以进行物质传导,中心通道与最外侧通道分别用于HUVECs与基质细胞的培养,其余通道用于灌流,通过基质细胞分泌的促血管生成因子作用于HUVECs, 实现了芯片上的血管新生和血管再生。该芯片的主要优点在于灌流式培养更加真实地反映了人体内血管的形态学特征,并表现出较强的屏障功能和长期稳定性。
人的血液处在不断流动的状态,流体与血管壁之间能够产生剪切力。研究剪切力对血管壁的作用在血管疾病如动脉粥样硬化、血栓形成、炎症性血管疾病及肿瘤经血管转移等的病理学研究具有重要的意义[53]。Nguyen等[54] 设计了一种微流控人工血管,通过控制管内流体的流动方向及流速发现当毛细管内剪切力超过10 dyn/cm2时能够引起血管出芽生成,从而提出了生物体内潜在的血管密度自平衡机制。Zheng等[55]以I型胶原作为支架,在芯片中制造了一个三维结构的微血管网络,通过加入生长因子如VEGF,对HUVECs与血管周细胞的相互作用及血管生成进行了研究。研究者在进一步的实验中引入化学刺激如佛波酯来模拟血管对炎症的响应,结果表明化学刺激能够导致内皮细胞变为血栓前状态。此外,Wang等[56]合成了一种弹性的多孔透明纤维素人工血管,并将其植入三维胶原蛋白基质构建的微芯片中以模拟肿瘤粘附作用及经血管的迁移。
由于微血管网络的复杂性,在建立芯片血管模型时研究人员还需要考虑剪切力外的其他因素,如在系统中引入VEGF、转化生长因子β[51]以及胆固醇等刺激对血管内皮细胞的响应,进一步增加芯片血管的真实性。
3.7 多器官芯片
预测和评估人体对各种药物的响应,建立“Humanonchip”的重要步骤之一是将多个独立的器官集成在一个芯片上。而肝脏代谢产生的毒素往往会引起其他器官毒性,因此,为了研究这种器官之间代谢作用的机理,肝细胞或组织常被用于与其他器官共同研究。Groothuis课题组[57]设计了一种由两个细胞培养腔串联而成的灌流培养芯片,并在两个培养腔内均放置大鼠肠道与肝脏切片,模拟人体内的首过代谢。通过在上游培养腔中加入胆汁分泌产物引起上游肠成纤维细胞分泌生长因子,此生长因子能够导致下游串联的培养腔内肝细胞活性下降,而单独培养的肝细胞并没有出现类似现象。Ramello 等[58]利用一个肝肾细胞共培养芯片实现了抗癌药匹服平的肾毒性研究。首先在芯片上接种肝、肾细胞孵育24h,随后在肝肾芯片上加入50 μmol匹服平培养液灌流培养72 h,并设置肝细胞与肾细胞的单独培养体系作为对照,通过检测细胞数量、Ca2+释放量及细胞代谢物等指标进行分析实现毒性测试。实验结果证明,在肝肾共培养体系中,匹服平在肝细胞中代谢产生的具有肾毒性的氯乙醛导致了犬肾细胞下降30%,而单独培养的肝、肾细胞体系中并没有此现象。
人体结构的复杂性促使研究人员建立更加复杂的微流控多器官芯片系统。Zhang等[1]设计了一个多通道的三维微流控芯片,通过在不同的通道内分别培养不同的细胞模拟人体内的肝、肺、肾和脂肪组织,并实现了对转移生长因子β1在不同通道的浓度控制。Shuler课题组[10,59,60]利用多器官芯片对药物药代动力学药效动力学(PKPD)进行了多项研究。如Sung等[59]设计了一个如图3所示的多层芯片,通过水凝胶三维培养3种不同的细胞株以模拟肝脏、肿瘤和骨髓结构。实验通过在系统中加入5氟尿嘧啶引起细胞代谢变化,与计算得到的5氟尿嘧啶的PKPD理论模型结果相符。在最近的研究中,Maschmeyer等[61]在一个多器官芯片上以十万分之一的比例缩小人的肠、肝、皮肤和肾,从而建立了多器官芯片模拟系统。此共培养体系能够维持28天,细胞均保持高活性并能够自发形成功能化的结构并实现系统的自稳态。
综上可知,器官芯片的研究已涉及人体的主要器官。此外,在微流控芯片上还成功构建了其它器官模型,如血脑屏障模型[8,62,63]、肌肉模型[64]、骨骼模型[65]、脾脏模型[66]、乳腺模型[67]、皮肤模型[68,69]等。
图3 多器官微流控培养结构[59]
Fig.3 A multiorgan microfluidic framework[59]
a.分层的多器官芯片原理图; b. 组装的芯片实体图。
a. A schematic of layered multiorgan chip; b. A picture of the assembled device.
4 展 望
由于微流控技术能够通过精密的微加工技术对芯片上微通道的尺寸、空间位置以及连接方式等进行精确的控制;能够使用各种新型的材料作为细胞生存的基底以及能够提供持续的灌流培养模式,使其在体外细胞培养中有着无与伦比的实用性与潜力。随着微加工技术与细胞三维培养相结合所诞生的器官芯片技术作为一种新型体外细胞培养平台,在提出后即得到了广泛重视和迅速发展。器官芯片技术旨在建立一个人工的仿生微环境,从而实现组织器官水平的模拟,并在此基础上进行人体生理学研究、药物开发以及其毒理学等相关研究。器官芯片技术能够克服传统二维细胞培养模式与动物实验的不足,它具有建立高度仿生的体外生理学模型的潜力,甚至可能影响以制药工业为代表的部分产业的发展进程。器官芯片最终目标是将不同器官的细胞集成于单一芯片中,构建更加复杂的多器官芯片模型甚至是人体模型,最终实现“Humanonchip”,为人体循环系统的研究以及药物的药代动力学与药效动力学的建立提供了一个崭新的平台。
器官芯片技术目前还处在萌芽阶段,仍有大量技术及产业化方面的问题需要解决:(1)开发更加适合细胞培养的新材料。现有的芯片材料多为PDMS、聚碳酸酯等,它们具有良好的渗透性与生物相容性,因此在芯片细胞培养中广泛使用,然而PDMS被证明能够吸附疏水性小分子,可能会减少有效的药物浓度和活性并引起实验误差。因此需要进行表面化学改性,或者选择其它代替材料。(2)使用更加可靠的人类细胞。下一代器官芯片将着眼于使用原代细胞与人类诱导多能干细胞,这对于特异性疾病的研究、个体化医疗及新药开发具有重要意义。(3)由于芯片体积小,细胞容量低,因此需要开发高灵敏度的检测方法和装置。只有在不影响细胞活力的情况下实现细胞进程与生物标志物的准确的实时检测,才能充分发挥器官芯片技术的潜能。因此发展适合于芯片的电化学、光学、免疫学的检测手段,如使用各类传感器,同时设计更加标准化的芯片,使之与传统的生物检测手段相匹配,亦将成为研究的重点。相信随着技术的发展以及研究的深入,器官芯片技术必将广泛应用于生命科学、医学、药学等领域的研究中。
References
1 Zhang C, Zhao Z, Abdul Rahim N A, van Noort D, Yu H. Lab Chip, 2009, 9(22): 3185-3192
2 http://www.accessdata.fda.gov/scripts/fdatrack/view/track_project.cfm?program=occhiefscientist&id=OCSModernizingToxicology
3 Huh D, Hamilton G A, Ingber D E. Trends Cell Biol., 2011, 21(12): 745-754
4 Esch E W, Bahinski A, Huh D. Nat. Rev. Drug Discov., 2015, 14(4): 248-260
5 LIN BingCheng. Micro/nano Fluidic Chip Laboratory. Beijing: Science Press, 2013: 2-5
林炳承. 微纳流控芯片实验室. 科学出版社, 2013: 2-5
6 Ye N, Qin J, Shi W, Liu X, Lin B. Lab Chip, 2008, 7(12): 1696-1704
7 Galie P A, Nguyen D H, Choi C K, Cohen D M, Janmey P A, Chen C S. Proc. Natl. Acad. Sci. USA, 2014, 111(22): 7968-7973
8 Ho C T, Lin R Z, Chen R J, Chin C K, Gong S E, Chang H Y, Peng H L, Hsu L, Yew T R, Chang S F, Liu C H. Lab Chip, 2013, 13(18): 3578-3587
9 Booth R, Kim H. Lab Chip, 2012, 12(10): 1784-1792
10 Sung J H, Shuler M L. Lab Chip, 2009, 9(10): 1385-1394
11 Sung J H, Esch M B, Prot J M, Long C J, Smith A, Hickman J J, Shuler M L. Lab Chip, 2013, 13(7): 1201-1212
12 van der Meer A D, van den Berg A. Integr. Biol. (Camb) , 2012, 4(5): 461-470
13 http://mimetas.com/news_files/pharmafundskidneyonachip.php
14 http://wyss.harvard.edu/viewpressrelease/204/emulateannouncesstrategiccollaborationwithjohnsonjohnsoninnovationtouseorgansonchipsplatformtobetterpredicthumanresponseindrugdevelopmentprocess
15 LIU WenMing, LI Li, REN Li, WANG JianChun, TU Qin, WANG XueQin, WANG JinYi. Chinese J. Anal. Chem., 2012, 40(1): 24-31
刘文明, 李 立, 任 丽, 王建春, 涂 琴, 王雪琴, 王进义. 分析化学, 2012, 40(1): 24-31
16 Bhatia S N, Ingber D E. Nat. Biotechnol., 2014, 32(8): 760-772
17 Jang K J, Mehr A P, Hamilton G A, McPartlin L A, Chung S, Suh K Y, Ingber D E. Integr. Biol. (Camb) , 2013, 5(9): 1119-1129
18 Wang Y, Toh Y C, Li Q, Nugraha B, Zheng B, Lu T B, Gao Y, Ng M M, Yu H. Integr. Biol. (Camb) , 2013, 5(2): 390-401
19 WANG LiHui, LIU DaYu, WANG Bo, SUN Jie, LI LianHong. Chinese J. Anal. Chem., 2008, 36(2): 143-149
王丽辉, 刘大渔, 王 波, 孙 杰, 李连宏. 分析化学, 2008, 36(2):143-149
20 Yum K, Hong S G, Healy K E, Lee L P. Biotechnol. J., 2014, 9(1): 16-27
21 Keenan T M, Folch A. Lab Chip, 2008, 8(1): 34-57
22 Sung J H, Yu J, Luo D, Shuler M L, March J C. Lab Chip, 2011, 11(3): 389-392
23 Zhou J, Khodakov D A, Ellis A V, Voelcker N H. Electrophoresis, 2012, 33(1): 89-104
24 Ho C T, Lin R Z, Chang W Y, Chang H Y,Liu C H. Lab Chip, 2006, 6(6): 724-734
25 Takayama S, Ostuni E, LeDuc P, Naruse K, Ingber D E,Whitesides G M. Nature, 2001, 411(6841): 1016
26 Toh Y C, Lim T C, Tai D, Xiao G, van Noort D,Yu H. Lab Chip, 2009, 9(14): 2026-2035
27 Iredale J P, Arthur M J. Gut, 1994, 35(6): 729-732
28 Lee P J, Hung P J,Lee L P. Biotechnol. Bioeng., 2007, 97(5): 1340-1346
29 Hegde M, Jindal R, Bhushan A, Bale S S, McCarty W J, Golberg I, Usta O B, Yarmush M L. Lab Chip, 2014, 14(12): 2033-2039
30 GómezLechón M J, Tolosa L, Conde I, Donato M T. Expert Opin. Drug Metab. Toxicol., 2014, 10(11): 1553-1568
31 Hoffmann D, Adler M, Vaidya V S, Rached E, Mulrane L, Gallagher W M, Callanan J J, Gautier J C, Matheis K, Staedtler F, Dieterle F, Brandenburg A, Sposny A, Hewitt P, EllingerZiegelbauer H, Bonventre J V, Dekant W, Mally A. Toxicol. Sci., 2010, 116(1): 8-22
32 Jang K J, Suh K Y. Lab Chip, 2010, 10(1): 36-42
33 Jang K J, Mehr A P, Hamilton G A, McPartlin L A, Chung S, Suh K Y, Ingber D E. Integr. Biol. (Camb), 2013, 5(9): 1119-1129
34 Zhou M, Ma H, Lin H,Qin J. Biomaterials, 2014, 35(5): 1390-1401
35 Wei Z, Amponsah P K,AlShatti M, Nie Z, Bandyopadhyay B C. Lab Chip, 2012, 12(20): 4037-4040
36 Mu X, Zheng W, Xiao L, Zhang W,Jiang X. Lab Chip, 2013, 13(8): 1612-1618
37 Yeon J H,Park J K. Anal. Chem., 2009, 81(5): 1944-1951
38 Kim H J, Huh D, Hamilton G, Ingber D E. Lab Chip, 2012, 12(12): 2165-2174
39 Esch M B, Sung J H, Yang J, Yu C, Yu J, March J C, Shuler M L. Biomed. Microdevices, 2012, 14(5): 895-906
40 Imura Y, Asano Y, Sato K,Yoshimura E. Anal. Sci., 2009, 25(12): 1403-1407
41 Huh D, Matthews B D, Mammoto A,MontoyaZavala M, Hsin H Y, Ingber D E. Science, 2010, 328(5986): 1662-1668
42 Huh D, Leslie D C, Matthews B D, Fraser J P, Jurek S, Hamilton G A, Thorneloe K S, McAlexander M A, Ingber. Sci. Transl. Med., 2012, 4(159): 159ra147
43 Douville N J, Zamankhan P, Tung Y C, Li R, Vaughan B L, Tai C F, White J, Christensen P J, Grotberg J B, Takayama S. Lab Chip, 2011, 11(4): 609-619
44 Huh D, Fujioka H, Tung Y C, Futai N, Paine R, Grotberg J B,Takayama S. Proc. Natl. Acad. Sci. U S A, 2007, 104(48): 18886-18891
45 Tavana H, Zamankhan P, Christensen P J, Grotberg J B,Takayama S. Biomed. Microdevices., 2011, 13(4): 731-742
46 Polini A, Prodanov L, Bhise N S, Manoharan V, Dokmeci M R, Khademhosseini A. Expert Opin. Drug Discov., 2014, 9(4): 335-352
47 Grosberg A, Alford P W, McCain M L, Parker K K. Lab Chip, 2011, 11(24): 4165-4173
48 Ren L, Liu W, Wang Y, Wang J C, Tu Q, Xu J, Liu R,Shen S F, Wang J. Anal. Chem., 2013, 85(1): 235-244
49 Martewicz S, Michielin F, Serena E, Zambon A, Mongillo M, Elvassore N. Integr. Biol. (Camb) , 2012, 4(2): 153-164
50 Annabi N, Selimovic S, Acevedo Cox J P, Ribas J,Afshar Bakooshli M, Heintze D, Weiss A S, Cropek D, Khademhosseini A. Lab Chip, 2013, 13(18): 3569-3577
51 van der Meer A D, Orlova V V, ten Dijke P, van den Berg A, Mummery C L. Lab Chip, 2013, 13(18): 3562-3568
52 Kim S, Lee H, Chung M, Jeon N L. Lab Chip, 2013, 13(8): 1489-1500
53 Zheng Y, Chen J, Craven M, Choi N W, Totorica S,DiazSantana A, Kermani P, Hempstead B, FischbachTeschl C, Lopez J A, Stroock A D. Proc. Natl. Acad. Sci. U S A, 2012, 109(24): 9342-9347
54 Nguyen D H, Stapleton S C, Yang M T, Cha S S, Choi C K, Galie P A, Chen C S. Proc. Natl. Acad. Sci. USA, 2013, 110(17): 6712-6717
55 ZHANG HuiYan, ZHANG Zhen, JI XingHu, HE ZhiKe. Chinese Journal of Analytical Chemistry, 2014, 42(9): 1276-1280
张慧妍, 张 珍, 吉邢虎, 何治柯. 分析化学, 2014, 42(9): 1276-1280
56 Wang X Y, Jin Z H, Gan B W, Lv S W, Xie M, Huang W H. Lab Chip, 2014, 14(15): 2709-2716
57 van Midwoud P M, Merema M T, Verpoorte E, Groothuis G M. Lab Chip, 2010, 10(20): 2778-2786
58 ChouchaSnouber L, Aninat C, Grsicom L, Madalinski G, Brochot C, Poleni P E, Razan F, Guillouzo C G, Legallais C, Corlu A, Leclerc E. Biotechnol. Bioeng., 2013, 110(2): 597-608
59 Sung J H, Kam C, Shuler M L. Lab Chip, 2010, 10(4): 446-455
60 Esch M B, Mahler G J, Stokor T, Shuler M L.Lab Chip, 2014, 14(16): 3081-3092
61 Maschmeyer I, Lorenz A K, Schimek K, Hasenberg T, Ramme A P, Hubner J, Lindner M, Drewell C, Bauer S, Thomas A, Sambo N S, Sonntag F, Lauster R, Marx. Lab Chip, 2015, 15(12): 2688-2699
62 Griep L M, Wolbers F, de Wagenaar B, ter Braak P M, Weksler B B, Romero I A, Couraud P O, Vermes I, van der Meer A D, van den Berg A. Biomed. Microdevices, 2013, 15(1): 145-150
63 Prabhakarpandian B, Shen M C, Nichols J B, Mills I R, SidorykWegrzynowicz M, Aschner M, Pant K. Lab Chip, 2013, 13(6): 1093-1101
64 Grosberg A, Nesmith A P, Goss J A, Brigham M D, McCain M L, Parker K K. J. Pharmacol. Toxicol. Methods, 2012, 65(3): 126-135
65 Altmann B, Lochner A, Swain M, Kohal R J, Giselbrecht S, Gottwald E, Steinberg T, Tomakidi P. Biomaterials, 2014, 35(10): 3208-3219
66 Baker M. Nature, 2011, 471(7340): 661-665
67 Grafton M M, Wang L, Vidi P A, Leary J, Lelievre S A. Integr. Biol. (Camb) , 2011, 3(4): 451-459
68 Atac B, Wagner I, Horland R, Lauster R, Marx U, Tonevitsky A G, Azar R P, Lindner G. Lab Chip, 2013, 13(18): 3555-3561
69 Abaci H E, Gledhill K, Guo Z, Christiano A M, Shuler M L. Lab Chip, 2015, 15(3): 882-888
Organsonchips and Its Applications
SUN Wei1, CHEN YuQing1, LUO GuoAn2,3, ZHANG Min3, ZHANG HongYang1, WANG YueRong1, HU Ping*1
1(Shanghai Key Laboratory of Functional Materials Chemistry, School of Chemistry and Molecular Engineering,
East China University of Science and Technology, Shanghai 200237, China)
2(Department of Chemistry, Tsinghua University, Beijing 10084, China)
3(Shanghai Key Laboratory of New Drug Design & Modern Engineering Center for TCM, School of Pharmacy,
East China University of Science and Technology, Shanghai 200237, China)
Abstract Microfluidic chips are significant platforms of cell culture in vitro. Microfluidic chipbased organsonchips technology has received attention because it can mimic the complex structures and functions of human organs. In this review, the recent advances of organsonchips technology in different organs are reported including the build of human physiological models, drug discovery and toxicology research. And the development of this technology is proposed.
Keywords Microfluidic chip; Organsonchips; Cell; Human organ; Review
(Received 26 October 2015; accepted 23 December 2015)
This work was supported by the National Science and Technology Major Project for Significant New Drugs Development(No. 2013ZX09507005)

