水溶液体系中Ca(OH)2和FeSO4的除磷效应
周桑扬, 付新喜, 吴晓芙, 冀泽华 (中南林业科技大学 环境科学与工程研究中心, 湖南 长沙 410004)
水溶液体系中Ca(OH)2和FeSO4的除磷效应
周桑扬, 付新喜, 吴晓芙, 冀泽华
(中南林业科技大学 环境科学与工程研究中心, 湖南 长沙 410004)
为了解决人工湿地冬季除磷效果减弱的问题,试验选取了Ca(OH)2和FeSO4作为辅助除磷试剂,考察了水溶液体系中两者的除磷效应。结果表明:Ca(OH)2和FeSO4均具有较好的除磷效果,单独使用时Ca(OH)2要优于FeSO4,但单独使用会显著改变体系的pH值,破坏人工湿地的生态环境。采用Ca(OH)2与FeSO4的合理配比和先添加Ca(OH)2再施用FeSO4的顺序,不仅可极大地提高磷的去除率,还可以有效地调节系统溶液的酸碱度至中性,从而保持人工湿地生态系统的稳定性。本研究结果为强化人工湿地除磷提供了新方案和基础数据。
人工湿地; 除磷; Ca(OH)2; FeSO4
污水中的氮磷元素能刺激藻类和光合水生生物生长,并最终诱发水体富营养化。根据Liebig最小定律(Liebig Law of the Minimum)[1],磷被视为水体富营养化最主要的诱导因素[2]。因此,污水除磷对于控制水体富营养化具有重要意义。传统的除磷工艺如生物法除磷效果不佳,且驯化时间较长,对进水水质水量的要求较高,适应性和灵活性较差[3],难以高效除磷;而化学沉淀法如石灰法虽然除磷效果好,但出水pH过高,增加了回调用酸的成本。人工湿地具有独特而复杂的净水机理,利用基质——微生物——植物复合生态系统的物理、化学和生物三重协同作用,通过过滤、吸附、沉淀、离子交换、植物吸收和微生物分解等多种途径实现对污水的高效净化。利用人工湿地系统中的基质、植物和微生物的共同作用去除磷元素,被认为是一种廉价有效的废水处理技术[4]。人工湿地除磷工艺具有投资少、效果好、维护方便、环境友好以及生态服务功能突出等优点,可作为污水除磷技术的一种有效方案。
人工湿地在冬季或当基质吸附磷素饱和后,其除磷效果显著降低,可使用化学法辅助除磷。董婧蒙[5]等的研究表明,0.07 g石灰(Ca(OH)2)在处理100 mL浓度为100 mg/L磷时,10 min的去除率能达到99%。张萌[6]等的研究表明,亚铁盐(FeSO4)和高铁盐(Fe2(SO4)3)均能有效除磷,但高铁盐的除磷成本较亚铁盐高。若单独使用Ca(OH)2或FeSO4会使水溶液体系的pH值发生较大改变,破坏人工湿地的生态环境。本试验考察水溶液体系中Ca(OH)2和FeSO4的除磷效应,同时结合二者调节体系的酸碱度,为提高人工湿地除磷效率找到新方法。
1 材料与方法
1.1试验原理
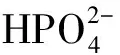
Ca(OH)2除磷反应式如下[9]:
3K H2PO4+ 5Ca(OH)2→
Ca5(PO4)3(OH)↓+6H2O+3KOH
(1)
FeSO4除磷反应式如下[10]:
2KH2PO4+3FeSO4→
Fe3(PO4)2↓+2H2SO4+K2SO4
(2)
1.2试验试剂与测定方法
1.2.1 试验试剂 试验磷源: KH2PO4(分析纯,国药集团化学试剂有限公司)。准确称取烘干后的KH2PO44.3870g,定容于2000mL容量瓶中,配得浓度为500mg/L的磷标准溶液。
除磷剂 : Ca(OH)2(分析纯,天津市恒兴化学试剂制造有限公司)。准确称取Ca(OH)20.01,0.02,…,0.06 g溶于100 mL溶液中,得浓度为0.01,0.02,…,0.06 mg/L的Ca(OH)2。
FeSO4·7H2O(分析纯,天津市恒兴化学试剂制造有限公司)。准确称取3.6579 g FeSO4·7H2O,定容于2000 mL容量瓶中,配得浓度为1000 mg/L的FeSO4标准溶液。
1.2.2 测量方法 试验所考察的主要指标为磷酸盐含量(以磷计),反应后pH值及Ca2+、Fe2+的剩余量。主要分析项目、方法与仪器见表1。

表1 分析项目及方法Tab 1 Analysisitemsandmethods分析项目分析方法分析仪器磷酸盐钼锑抗分光光度法UV—1700紫外分光光度计pH值pH计测量PHS—3C精密pH计Ca元素火焰原子吸收分光光度法AA—7002火焰原子吸收分光光度仪Fe元素火焰原子吸收分光光度法AA—7002火焰原子吸收分光光度仪
1.3试验方法
1.3.1 除磷剂添加量影响试验 取500 mg/L的磷标准溶液,配置25、50、100 mg/L的磷溶液各100 mL,移至250 mL带塞锥形瓶,Ca(OH)2和FeSO4采用相同的投加量梯度,分别为100,200,…,600 mg/L。盖紧瓶塞后放入25 ℃恒温震荡箱中震荡10 h,静置2 h后过滤,测得过滤清液中的磷、Ca2+与Fe2+浓度以及pH值。
1.3.2 温度影响试验 调整恒温震荡箱温度为5℃、25 ℃、40 ℃进行试验,其余步骤与1.3.1相同。
1.3.3 除磷剂添加顺序影响试验 污水排放标准中,pH值应在6~8之间。结合Ca(OH)2和FeSO4反应后pH值的变化情况,选取 Ca(OH)2与FeSO4的配比为:
1∶1为两组,二者均为200 mg/L或300 mg/L;
2∶3为一组,二者分别为200 mg/L,300 mg/L;
3∶4为一组,二者分别为300 mg/L,400 mg/L。
配置100 mg/L的磷溶液,分别按照上述配比,先添加Ca(OH)2或FeSO4,在25 ℃恒温震荡箱中震荡5 h后,再添加FeSO4或Ca(OH)2,继续震荡5 h,静置2 h后过滤,测得过滤清液中的磷。
2 结果与分析
2.1试剂添加量对磷去除的影响
不同浓度的Ca(OH)2和FeSO4对磷的去除效果如图1所示。由图1可知,二者对磷均有较好的去除效果,但Ca(OH)2的除磷效果更优。
溶液中磷的去除率随FeSO4的添加量增多而升高。FeSO4投加量为600 mg/L时,浓度为25、50、100 mg/L的磷的去除率分别为92.81%、70.52%和49.41%。处理效果不如Ca(OH)2的原因可能是FeSO4进入溶液中发生水解,释放出游离的H+,降低溶液pH值,FeSO4与KH2PO4反应生成Fe3(PO4)2,Fe3(PO4)2不溶于水,但易溶于稀酸[12]。所以一部分Fe3(PO4)2会重新溶解,表现为磷的去除效果减弱。
城镇生活污水中的TP一般情况下小于25 mg/L,而国家城镇污水处理污染物排放标准[GB 18918-2002]的一级A标准中最高允许排放浓度为0.5 mg/L。以25 mg/L为处理废水总磷含量,基于试验结果,可计算出单独使用Ca(OH)2和FeSO4时达到国家一级A标准的添加用量分别为100 mg/L和600 mg/L。
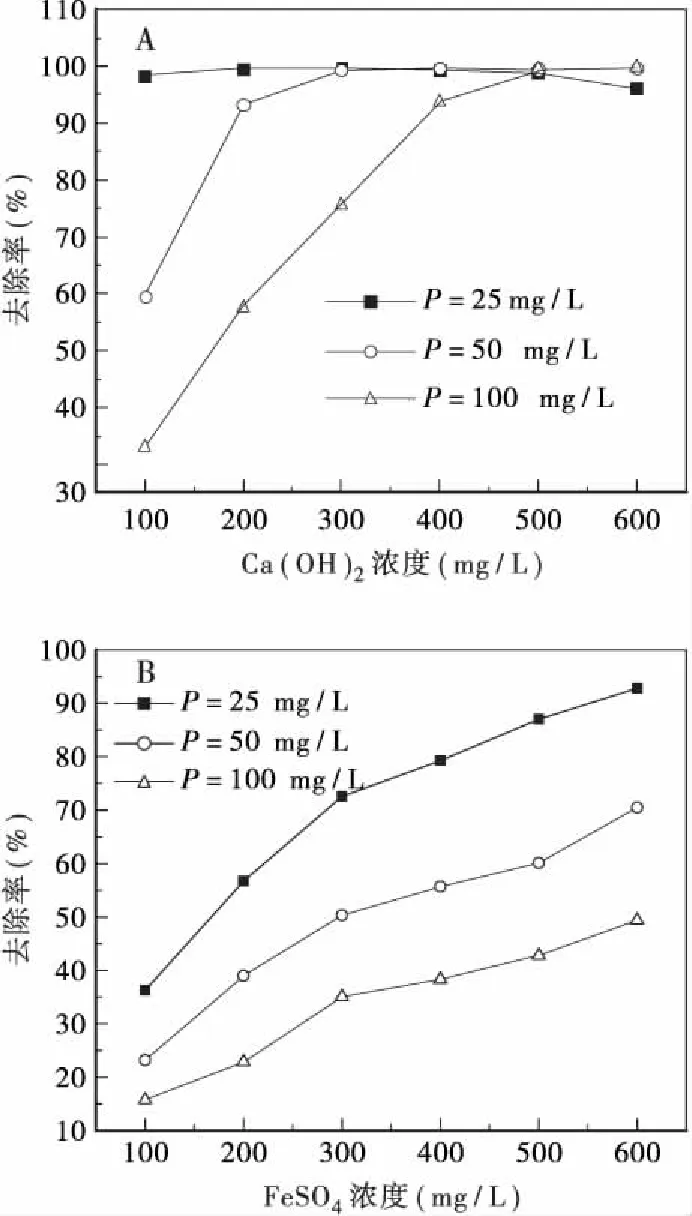
图1 试剂添加量对磷的去除效果Fig.1 The phosphorus removal by reagents at different concentrations
2.2温度对磷去除的影响
不同温度下,Ca(OH)2和FeSO4对不同浓度磷的去除效果如图2、图3所示。由图2、图3可知,在不同温度下,相同浓度的磷去除率差异较小,温度的降低对磷的去除率均有一定的提升。
理论上,温度的升高可以提高反应的速率,但试验的反应时间足够长,能使Ca(OH)2和FeSO4与磷充分反应生成沉淀。升高温度会增大沉淀物质的溶解度,所以低温条件下磷的去除率增大。也有研究表明[13],FeSO4与磷反应生成物Fe3(PO4)2的溶解度随着溶液pH值的降低而升高。水解反应为吸热反应,温度升高促进FeSO4的水解,电离出更多的H+,降低溶液pH,进一步使Fe3(PO4)2的溶解度升高,表现为除磷效果变差。
试验结果表明,温度对除磷的影响不显著,在反应时间充足的条件下,低温可在一定程度上促进磷的去除,所以在冬季不会降低Ca(OH)2和FeSO4辅助除磷的效果。
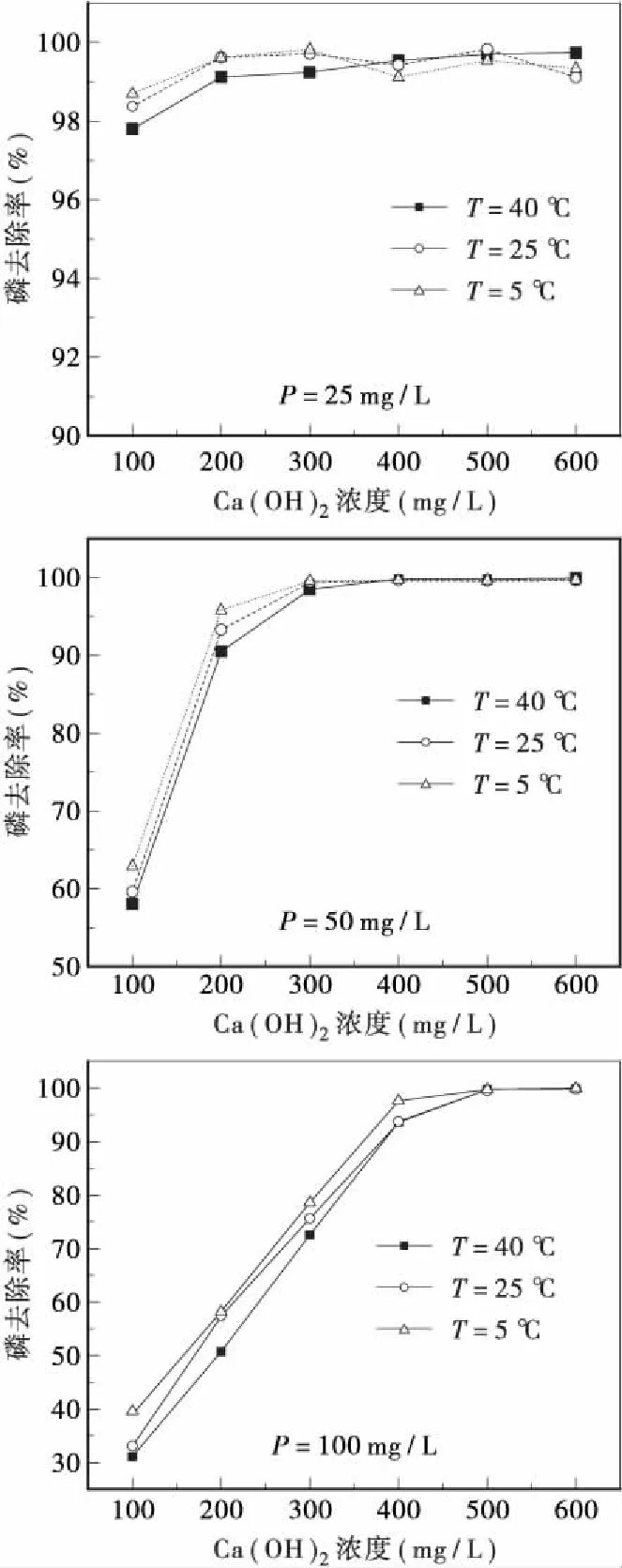
图2 不同温度条件下Ca(OH)2对磷的去除效果Fig.2 The phosphorus removal by Ca(OH)2 at different temperature
2.3溶液体系pH值的变化
添加Ca(OH)2和FeSO4与磷反应后溶液体系pH值的变化如图4所示。
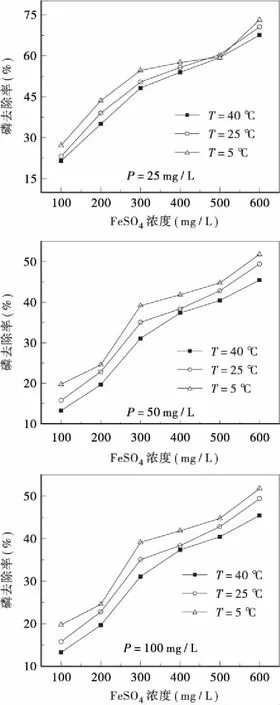
图3 不同温度条件下FeSO4对磷的去除效果Fig.3 The phosphorus removal by FeSO4 at different temperature
投加Ca(OH)2后,溶液pH值随Ca(OH)2添加量增大而升高,当Ca(OH)2添加量为600 mg/L时,在溶液磷浓度25、50和100 mg/L点上,pH值分别达到11.82、11.75和11.46,说明投加Ca(OH)2会对体系的酸碱环境产生极大的影响。在等量Ca(OH)2添加点上,图4-A显示溶液pH值随磷的浓度增大而降低。磷酸盐本身呈酸性,磷与Ca(OH)2的反应不仅消耗Ca2+,同时也消耗OH-[14],给定Ca(OH)2添加量点上,磷浓度增大必然会降低溶液pH值,因此Ca(OH)2添加量和溶液磷浓度对体系pH值的影响有对应的比例关系。
投加FeSO4后,溶液pH值随FeSO4添加量增大而降低,当FeSO4添加量为600 mg/L时,在溶液磷浓度25、50和100 mg/L点上,pH值分别达到3.11、3.03和2.87,说明投加FeSO4也会对体系的酸碱环境产生极大影响。在等量FeSO4添加点上,图4-B显示溶液pH值随磷的浓度增大而降低。磷酸盐在溶液中水解,浓度越高,反应剩余的KH2PO4电离出越多的H+,因此在给定的FeSO4添加量点上,磷浓度增大会降低溶液pH值。
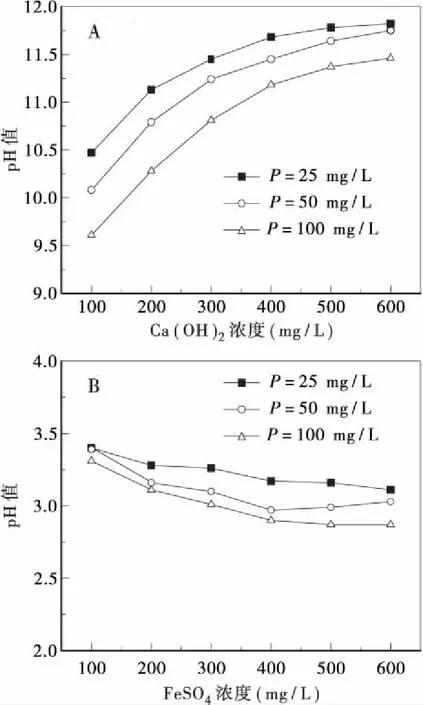
图4 反应后溶液pH值变化Fig.4 The change of pH value
2.4Ca(OH)2—FeSO4联合作用的除磷效果
除磷过程中按照不同顺序添加Ca(OH)2和FeSO4,能在提高磷的去除率的同时调节系统溶液的酸碱度至中性。设定除磷剂的投加顺序:方式A为先添加Ca(OH)2再施用FeSO4,方式B为先添加FeSO4再施用Ca(OH)2。除磷剂的投加顺序对磷的去除效果及溶液pH值的影响见表2。结果表明,给定除磷剂浓度比,方式A的除磷效果优于方式B。
有研究表明,FeSO4除磷最佳pH值为6~9[15-16],且Ca(OH)2在碱性条件下的除磷效果最好[14]。投加方式为A时,溶液中先加入的Ca(OH)2能迅速与磷反应生成沉淀,同时升高体系的pH值;后加入的FeSO4在较高的pH条件下反应,最终将体系的pH调节为中性,此过程中Ca(OH)2和FeSO4始终在除磷的最佳pH范围内,所以提升了除磷效率。投加方式为B时,先加入的FeSO4降低体系的pH值,后加入的Ca(OH)2将体系的pH从酸性调节至中性,此过程中除磷剂均不在除磷的最佳pH范围,所以除磷的效率较低。
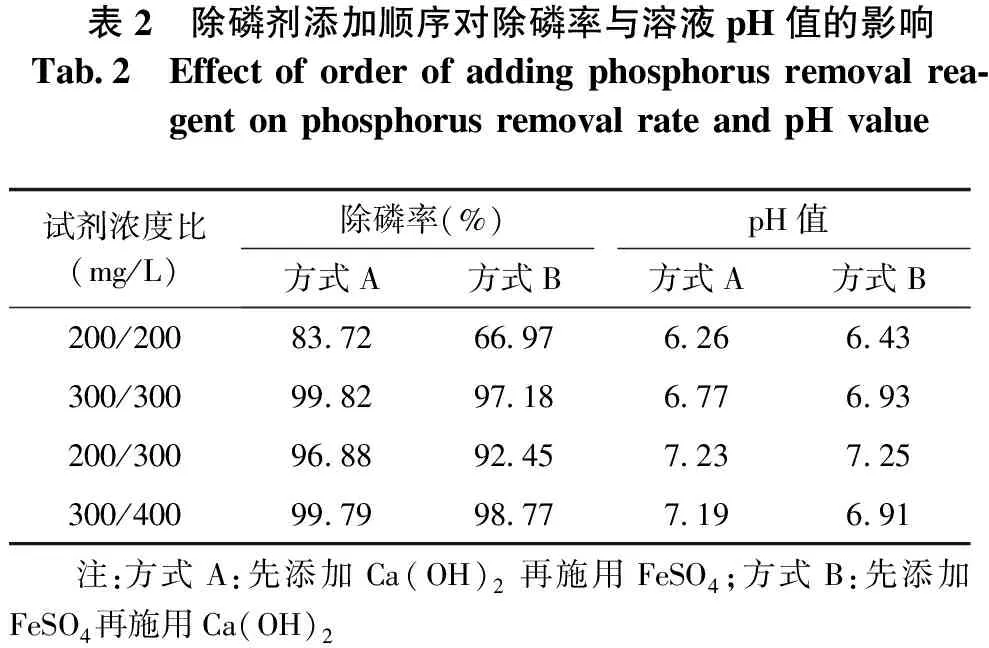
表2 除磷剂添加顺序对除磷率与溶液pH值的影响Tab 2 Effectoforderofaddingphosphorusremovalrea⁃gentonphosphorusremovalrateandpHvalue试剂浓度比(mg/L)除磷率(%)pH值方式A方式B方式A方式B200/20083 7266 976 266 43300/30099 8297 186 776 93200/30096 8892 457 237 25300/40099 7998 777 196 91 注:方式A:先添加Ca(OH)2再施用FeSO4;方式B:先添加FeSO4再施用Ca(OH)2
3 结论与讨论
(1)Ca(OH)2和FeSO4均为良好的除磷试剂。Ca(OH)2与磷的反应由于OH-的加入使得溶液体系pH值升高;FeSO4在溶液中水解,反应时降低溶液pH值。
(2)在5 ℃~40 ℃范围内,温度对Ca(OH)2和FeSO4的除磷效果没有显著影响。低温条件下沉淀物溶解度低,因此,寒冷冬季不会降低Ca(OH)2和FeSO4的辅助除磷效果。
(3)Ca(OH)2和FeSO4的添加顺序和用量比例对除磷效果和稳定溶液pH值有显著影响,先添加Ca(OH)2再施用FeSO4的去磷效果最优。当Ca(OH)2与FeSO4浓度比为200/200、300/300、200/300、300/400 mg/L时,可调节反应后溶液pH值至中性。
[1] 秦麟源.废水生物处理[M] .上海:同济大学出版社,1989.
[2] 毕学军,赵桂芹,毕海峰.污水生物除磷原理及其生化反应机制研究进展[J].青岛理工大学学报, 2006,27(2): 9-13.
[3] 俞蕴芳,顾俊. 城市污水化学除磷药剂的选择实验研究[J].污染防治技术,2010,23(4): 75-76.
[4] 李晓东,孙铁珩,李海波,等.人工湿地除磷研究进展[J].生态学报, 2007, 27(3): 1226-1232.
[5] 董婧蒙,王里奥,钟山,等.石灰石与石灰联合处理高浓度含磷废水[J].环境科学与管理,2010, 35(4):75-77,84.
[6] 张萌,邱琳,于晓晴,等.亚铁盐与高铁盐除磷工艺的对比研究[J].高校化学工程学报,2013, 27(3):519-525.
[7] 龚云峰,孙素敏,钱玉山. 污水化学除磷处理技术[J].能源环境保护, 2009, 23(3): 1-4,13.
[8] 何怀胜.化学沉淀—过滤法处理含锌磷化废水[J].化工给水排水设计,1998(2):10-13.
[9] Stratful I , Scrimshaw M D, Lester J N. Conditions influencing the precipitation of magnesium ammonium phosphate [J]. Water Research, 2002, 35(17):4191-4199.
[10] 邢伟,黄文敏,李敦海,等.铁盐除磷技术机理及铁盐混凝剂的研究进展[J].给水排水,2006, 32(2): 88-91.
[11] 陶秀成,黄小甲,王玲.汽车磷化废水的处理研究及其应用[J].实验与技术,2008,24(7): 594-595.
[12] 马玉萍,陈立爱,叶勇,等.硫酸亚铁用于污水厂二沉池出水化学除磷[J].环境工程学报, 2015, 9(3): 1303-1307.
[13] 杨艳飞.磷酸亚铁和磷酸亚铁锂制备工艺及其性能研究[D].郑州:郑州大学,2012.
[14] 董婧蒙.传统钙法除磷的机理及改良[D].重庆:重庆大学, 2009.
[15] 张萌,邱琳,于晓晴,等.亚铁盐除磷工艺的优化研究[J].中国环境科学,2012,32(7): 1223-1227.
[16] 李婷,董文艺,王宏杰,等.Fe(Ⅱ)/O2除磷的影响因素及反应动力学[J].化工学报,2013,64(5):1840-1846.
PhosphorusremovaleffectwithCa(OH)2andFeSO4inaqueoussystem
ZHOU Sangyang, FU Xinxi, WU Xiaofu, JI Zehua
(Institute of Environmental Science and Engineering,Central South University of Forestry and Technology,Changsha 410004, China)
In order to enhance the phosphorus removal rate in constructed wetlands in cold seasons, Ca(OH)2and FeSO4were selected as phosphorus removal reagent, and their effects were investigated. The results showed that Ca(OH)2and FeSO4were both effective in removal of phosphorus from aqueous solutions, and in comparison, Ca(OH)2performed better than FeSO4. Individual use of either Ca(OH)2or FeSO4caused significant changes in pH of the system. Such changes could lead to destructive impact on ecological environment. Combined use in the order of adding Ca(OH)2first and then FeSO4greatly increased the phosphorus removal rates. The optimal ratios of Ca(OH)2to FeSO4aimed at high phosphorus removal efficiency and effective adjustment of pH condition for protection of the constructed wetland ecosystem were determined for solutions containing different amount of phosphorus. The results obtained from the present study were of significance in providing useful data for improvement of phosphorus removal process in constructed wetlands used as wastewater treatments systems.
constructed wetlands; phosphorus removal; calcium hydroxide; ferrous sulfate
2016-03-28
国家“十二五”科技支撑计划项目(2014BAC09B00)。
周桑扬(1991-),男,湖南长沙人,硕士研究生,主要从事环境污染控制研究。
付新喜,博士;E-mail: 459889441@qq.com。
X 703
A
1003 — 5710(2016)03 — 0006 — 05
10. 3969/j. issn. 1003 — 5710. 2016. 03. 002
(文字编校:张 珉)

