促进初中化学定量观建构的教学案例
邓锦松+童文浩+张茶妹
摘要:用观念的视角分析“中和反应”对促进初中化学定量观建构的价值,并以观念建构为本对本节课进行设计与展开教学。
关键词:观念建构;定量观;中和反应;教学案例
文章编号:1008-0546(2016)10-0066-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2016.10.023
本案例以初中化学沪教版第七章“中和反应”为例。
一、“中和反应”教学价值的再认识
通过查阅文献和下校调研中发现大家对“中和反应”的教学价值仅停留在以知识为本的层面上,具体的教学思路是:通过实验探究盐酸和氢氧化钠溶液混合过程中是否发生反应,从而引出中和反应的概念,分析其微观实质,并介绍有关应用等。没有对“中和反应”对建构定量观的价值进行深度的挖掘,甚至,某些教师本身也缺乏定量意识,如在一次龙岩市“中和反应”实验教学技能比赛时,有些教师对教材中的操作步骤“逐滴加入”按部就班,浪费时间,而有的教师能根据盐酸与氢氧化钠溶液反应的质量关系,估算所需盐酸的量,灵活处理教材中的操作步骤,刚开始时采用快滴或倾倒的方式,等到所加盐酸的量接近反应完全时,再改用胶头滴管逐滴加入,节约了比赛时间,收到了良好的教学效果。
教材没有将中和反应作为酸或碱的性质来介绍,而是单独将它编为一个课题,原因是中和反应是复分解反应的典型,而盐酸与氢氧化钠溶液的反应又是最简单的中和反应,有利于建立复分解反应中离子交换与结合的模型,具有丰富的观念价值。因此,中和反应的成功教学,能帮助学生理解其他酸、碱、盐之间反应的微观实质,提高书写相关化学方程式的能力,认识复分解反应中离子交换的方式与数量关系,促进定量观等化学观念的建构。
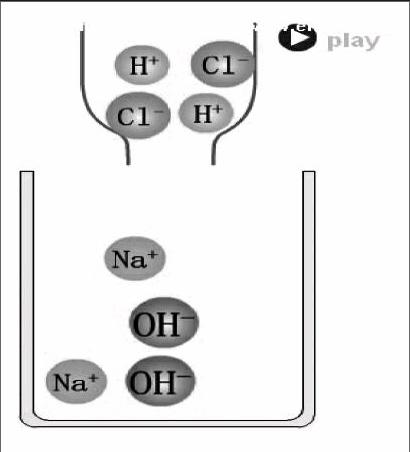
盐酸溶液中含有H+、Cl-和H2O分子,氢氧化钠溶液中含有Na+、OH-和H2O分子,H+、OH-的浓度与盐酸、氢氧化钠溶液的溶质质量分数成正比。盐酸、氢氧化钠溶液中离子的组成及它们量的关系是探究中和反应微观实质的基础。中和反应的微观实质是H+和OH-结合成H2O,可表示为:H++OH-→H2O,H+和OH-结合的比例为1∶1,这个比例是书写中和反应化学方程式配平的依据。以上这些内容是学生建构酸、碱、盐溶液的组成及相互反应都是以一定量的形式存在和发生等观念的重要载体。在中和反应的实验过程中又体现“物质的量变会引起质变,物质的量变是有范围的”的规律,往氢氧化钠溶液滴加盐酸前OH-的浓度大,溶液呈碱性,酚酞试液变红色,随着滴加盐酸的量加大,OH-被消耗,c(OH-)愈来愈小,当氢氧化钠溶液中OH-恰好与H+结合成水时,溶液呈中性,酚酞试液变为无色,而当反滴一滴氢氧化钠溶液溶液时,c(OH-)又大于c(H+),溶液又呈碱性,颜色又变为红色。
二、教学设计
1. 目标设计
(1)围绕“酸和碱混合能否发生反应”展开探究与对话,理解验证没有明显化学现象的化学反应是否发生反应的一般思路和方法,建立中和反应的概念,感受量变质变规律在化学反应中的体现。
(2)通过分析中和反应的微观动画,能从定性与定量的角度认识中和反应的微观实质,并能根据H+和OH-结合的数量关系配平有关中和反应的化学方程式。
(3)通过应用中和反应的原理解释生产生活中的一些现象,体会中和反应与生产生活的密切性,建构化学价值观。
2. 教学过程
[知识再现]
(1)写出盐酸、硫酸、氢氧化钠、氢氧化钙的化学式。
(2)盐酸、稀硫酸、氢氧化钠溶液、氢氧化钙溶液为什么能导电?
(3)盐酸、稀硫酸为什么具有共同的化学性质?氢氧化钠、氢氧化钙溶液为什么具有共同的化学性质?
(4)上述各物质的水溶液与酸碱指示剂作用有什么现象?
设计意图:通过知识再现,唤起学生原有的认知,为本节的学习扫清障碍。
[导入]酸具有共同化学性质的原因是酸的溶液中都含有H+,碱具有共同性质的原因是碱溶液中都含有共同的OH-,那么,将这两类不同的物质混合是否会发生反应呢?请同学们分组完成下列实验:
第1组:氢氧化钠溶液和稀盐酸
第2组:石灰水和稀盐酸
第3组:氢氧化铜的悬浊液和稀硫酸
第4组:氢氧化铁的悬浊液和稀盐酸
[师生对话]
师:请分组描述所观察到的现象。
生:……
师:3组实验的氢氧化铜不见了,4组实验的氢氧化铁也不见了,说明3、4组的酸和碱确实发生了反应,而1、2组的实验无明显现象,那么能不能说它们就没有发生反应呢?
生:不能。
师:可以通过什么方法证明1、2组两种物质确实发生了反应?
生:可以往氢氧化钠溶液中滴加几滴酚酞试液,然后逐滴加入稀盐酸,通过酚酞试液的变色来证明它们能发生反应。
师:对了!你是怎么想到的,能说说你的根据吗?
生:判断化学反应是否发生可以根据是否有新物质生成或反应物是否消失来判断,如刚才的3、4组实验,可以根据氢氧化铜悬浊液、氢氧化铁悬浊液的消失来证明它们发生了反应。而1、2组中的氢氧化钠溶液和石灰水是澄清的,在反应中看不到它们是否消失,但可以通过滴加酚酞试液,观察它的颜色变化间接证明它们是否消失来实现。
师:小结判断化学反应是否发生的一般思路和方法。
设计意图:通过学生操作、观察有明显现象和无明显现象的常见酸和碱反应的实验,创设认识冲突。然后,围绕“如何判断化学反应是否发生”为话题展开对话,形成判断化学反应是否发生的一般思路和方法,为探究中和反应的实验作铺垫。
[实验探究]课本[实验1]。
[问题]溶液温度升高、酚酞试液由红色变为无色,分别说明了什么?
[学生回答]说明溶液由碱性变成中性,盐酸与烧杯中的溶液发生了反应,并放出了热量。
[追问]红色的消失的原因是什么?是酚酞被盐酸消耗,还是盐酸消耗了氢氧化钠呢?你能用实验证明吗?
[实验探究]课本[实验2]。
[问题]向烧杯中反滴一滴氢氧化钠溶液,溶液由无色又变为红色,这一现象说明了什么?
[学生回答]说明溶液由中性又变成了碱性,溶液中还存在酚酞试液,说明[实验1]中是盐酸消耗了氢氧化钠。
[追问]以上实验说明,盐酸和氢氧化钠溶液能发生反应,反应的结果是酸性消失、碱性也消失,那么,决定溶液酸碱性的H+和OH-都去哪儿了?
[动画演示]反应的微观动画。
[师生对话]
师:稀盐酸和氢氧化钠溶液中分别含有哪些离子?
生:……
师:在反应前后,减少的离子是什么,不变的离子是什么?
生:……
师:H+和OH-结合生成什么物质?它们结合的比例如何?
生:……
小结:在稀盐酸与氢氧化钠溶液的混合过程中,H+和OH-结合生成水,溶液的酸碱度随之发生改变,溶液的酸碱度取决于c(H+)、c(OH-)的大小,刚开始时氢氧化钠溶液中c(OH-)大,溶液呈碱性;当滴入稀盐酸时,H+和OH-结合成H2O,c(OH-)减少,pH减小;当溶液由红色刚好褪成无色时,氢氧化钠溶液中OH-恰好都与稀盐酸中H+结合成水,pH=7,溶液呈中性;当反滴1滴氢氧化钠溶液时,c(OH-)又大于c(H+),溶液又呈碱性,溶液又变成红色。在这个过程中充分反映了哲学中“量变引起质变,质变是有范围”的规律。
[问题]在上述的过程中H+和OH-结合成H2O,那么Na+和Cl-呢?
[实验]课本[实验3]。
[追问]加热至蒸干,产生的白色晶体是什么物质?
[学生回答]产生的白色晶体是NaCl。
[归纳小结] 盐酸和氢氧化钠溶液反应的微观实质是溶液中的H+和OH-结合成H2O,Na+和Cl-结合成NaCl,它们结合的比例1∶1,化学方程式为:HCl+NaOHNaCl+ H2O。
[板书]中和反应的定义:酸+碱→盐+水 实质:H++OH-→H2O。
设计意图:以课本实验、Flash动画创设问题情境,生成“话题”,师生围绕话题展开对话。从宏观到微观,定性到定量,并以“符号”为纽带将中和反应的宏观与微观、定性与定量信息融合其中,帮助学生从多角度认识中和反应,感悟复分解反应中离子交换与结合是按一定比例进行的,“量变引起质变,质变是有范围”的观念。
[练习]请写出稀硫酸与氢氧化钠溶液反应的化学方程式。
[师生对话]围绕“你是如何配平这个化学方程式的”展开对话。
生1:根据质量守恒定律配平。
生2:根据中和反应的实质配平,1个H+和1个OH-结合成1个H2O分子。
教师:中和反应可以结合中和反应中H+和OH-结合的数量关系进行配平。
[练习]胃酸过多的病人常吃一种叫“复方氢氧化铝”的药物,其主要成分是氢氧化铝Al(OH)3,请写出治疗胃酸过多的反应原理。
设计意图:要求学生用中和反应概念和实质书写、配平中和反应的化学方程式,在练习的过程中再次从定性和定量角度领会中和反应的微观实质。
[学以致用]
请解释日常生活中的这些现象:施用熟石灰可以改良酸性土壤;被蚂蚁、蚊子咬了,皮肤会瘙痒、红肿,涂上稀氨水或肥皂水可以止痒、消肿。
[小结]
中和反应
1.定义:酸+碱→盐+水
2.实质:H++OH-→H2O(H+和OH-结合的比例为1∶1)
3.热效应:放热
4.反应类型:复分解反应
5.应用:改良酸性土壤、治疗胃酸过多、处理工厂的废水等
设计意图:对中和反应的定义、实质、热效应、反应类型和应用方面进行板书,促进学生全方位认识中和反应。
三、案例评析
2011年版的课程标准指出在初中化学教学中要“引导学生认识物质世界的变化规律,形成化学的基本观念”,因此,初中化学教学应从“知识为本”的教学转向“观念为本”的教学。定量观是初中化学基本观念,实施定量观建构的教学有其自身策略,本节教学所采取的策略能有效促进学生对定量观的建构。
1. 用观念的“眼光”分析教材
化学基本观念是化学知识背后的思想、观点,定量观是用“量”角度看待物质及其转化的思想与方法,它内隐于具体的知识当中,因此,实施定量观建构的教学要与具体事实相结合为主要教学原则,在教材分析时要用我们的“慧眼”将知识中隐含的观念内涵挖掘出来。中和反应蕴含着丰富的微粒观、定量观内涵,能有效推动学生认识复分解反应中离子的交换及结合的数量关系。在本节的教学中,教师没有将中和反应停留在其知识的事实层面,而是将中和反应过程中pH的变化所隐含“量变引起质变,质变是有规律”的思想揭示出来;不但揭示中和反应中离子的交换方式,而且将离子结合的数量关系昭示学生,并将此关系应用于书写化学方程式,深化学生对化学反应是以一定量的形式发生的认识。
2. 实施对话教学,促进观念建构
对话教学是相对于传统的“独白”而言的,以参与者持续的话语投入为特征,并由反思和互动的整合来构成教学关系。促进定量观的教学要求学生在积极主动的探究活动中,经历知识的形成过程,对具体知识做出超越事实的思考,并在具体情景的迁移应用中,不断概括和升华。因此,实施对话教学能有效促进观念的建构。在本课中,教师以实验、动画视频等创设情景,设置①溶液温度升高、酚酞试液由红色变为无色,分别说明了什么?②红色消失的原因是什么?是酚酞被盐酸消耗,还是盐酸消耗了氢氧化钠呢?你能用实验证明吗?③向烧杯中反滴一滴氢氧化钠溶液,溶液由无色又变为红色,这一现象说明了什么?④决定溶液酸碱性的H+和OH-都去哪儿了?⑤H+和OH-结合成H2O,那么Na+和Cl-呢?⑥加热至蒸干,产生的白色晶体是什么呢?等话题。学生围绕着有关“话题”展开对话,在对话的过程中,不断地反思互动,由浅入深、层层递进、螺旋上升地建构中和反应的定义、实质、热效应、反应形式。
参考文献
[1] 中华人民共和国教育部.全日制义务教育化学课程标准(2011年版)[M].北京:北京师范大学出版社,2012
[2] 吴成业.对话教学:内涵、价值追求及其建构[J].现代教育论丛,2009(1):5

