乳腺癌组织中RunX2基因的表达水平及临床意义分析
胡 滨,范楚苓,徐晓军,3,赵 明,刘亚坤,李菲菲
乳腺癌组织中RunX2基因的表达水平及临床意义分析
胡 滨1,2,范楚苓1,徐晓军1,3,赵 明1,刘亚坤1,李菲菲1
目的 探讨乳腺癌和癌旁组织中核心结合因子(RunX2)基因的表达差异及其与乳腺癌患者的临床特征和预后的关系。方法 选择75例乳腺癌患者癌组织标本,所有患者术前未经放疗和化疗,采用免疫组化法检测乳腺癌组织和癌旁组织RunX2的表达情况。分析乳腺癌患者RunX2基因的表达与年龄、病理分型、术后分期、淋巴转移、肿瘤大小、雌激素受体(ER)表型、孕激素受体(PR)表型、人类表皮生长因子2(HER2)表型、ki67表达水平以及生存率的关系。结果 75例患者的癌组织中有44例乳腺癌组织高表达RunX2,31例组织低表达RunX2;而癌旁组织仅23例高表达,52例均表达较低。癌组织和癌旁组织中RunX2的表达水平差异有统计学意义(P<0.05)。RunX2基因的表达高低与患者年龄、术后分期、淋巴结转移、病理类型、PR表型、HER2表型无明显相关性,但是与患者的ER表型和ki67表达相关(P<0.05),并且高表达RunX2患者术后3年的总体生存率较低表达患者差。结论 乳腺癌组织中RunX2基因高表达与患者的ER表型和临床预后呈正相关性,进一步证实了RunX2在乳腺癌发生发展中起到重要作用。
乳腺癌;RunX2;雌激素受体;临床预后
乳腺癌是女性最常见的恶性肿瘤之一,全球每年约有170万新发病例,约50万人死亡,居癌症发生率和死亡率的首位[1]。RunX2又称核心结合因子(core binding factor-α,RunX2),属于runt域基因家族,是一种参与骨髓间质干细胞成骨分化和骨发育的重要转录因子[2]。研究[3-4]表明 RunX2和多种肿瘤的发生密切相关,已被证明在成骨与骨肉瘤的发生发展过程中起重要作用,是骨髓间质干细胞成骨分化和骨发育的重要转录因子,通过促进溶骨作用、促进肿瘤血管新生等多个途径转移癌细胞的生长。除了骨组织外,乳腺是RunX2的表达量最高的组织之一,报道[5]显示在临床预后差的乳腺癌中异常高表达,为进一步了解RunX2与乳腺癌之间的关系,该研究采用免疫组化法检测RunX2基因在乳腺癌和癌旁正常组织中的表达情况,并且分析其表达与年龄、病理分型、术后分期、淋巴转移、肿瘤大小、雌激素受体(estrogen receptor,ER)表型、孕激素受体(progesterone receptor,PR)表型、人类表皮生长因子 (human epidermal growth factor receptor-2,HER2)表型、ki67表达水平以及生存率的关系。为进一步揭示RunX2与乳腺癌的发生、发展和预后之间联系奠定基础。
1 材料与方法
1.1 病例资料 选择2009年1月~2012年12月间于安庆市第一人民医院胃肠甲乳外科及安徽医科大学第一附属医院乳腺外科确诊为乳腺癌患者的乳腺癌组织标本75例。所有患者为女性,年龄33~81 (65.60±0.78)岁。术前未行放疗和化疗。术后分期Ⅰ~Ⅱ期39例,Ⅲ~Ⅳ期36例。导管侵润癌53例,非导管侵润癌22例。有淋巴结转移42例,无淋巴结转移33例。75例乳腺癌组织中,ER阳性34例,PR阳性36例,HER2阳性39例,ki67高表达46例。
1.2 免疫组化 采用SP法将肿瘤固定后,脱水,制成蜡块,标本蜡块连续切片,确保切片厚度不大于2 μm,常规二甲苯脱蜡,使用H2O2去离子水消除内源性过氧化物酶活性,PBS冲洗2次,一抗1∶500配置,4℃过夜孵育,孵育结束后使用PBS清洗3次,室温使用与一抗对应二抗孵育15~20 min,PBS清洗3次,每次5 min,辣根酶标记链霉素卵白素工作液滴加至标本,室温孵育15 min,PBS清洗3次,每次5 min,DAB显色,使用苏木精染色,然后盐酸乙醇分化,酒精按梯度脱水,二甲苯透明后,封片,至显微镜下观察,拍照分析。
1.3 结果判定 采用双盲法阅片,细胞染色成棕黄色为阳性细胞。RunX2基因阳性染色主要定位在细胞核。根据阳性细胞个数占整个肿瘤细胞的百分率计分,<5%为0分,5%~25%为1分,26%~50% 为2分,51%~75%为3分,>75%为4分。再根据阳性细胞染色深浅计分,不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分,最后将两者分数相乘,0分为阴性(-),1~4分为阳性(+),5~8分为弱阳性(++),9~12分为强阳性(+++),以(-)和(+)视为阴性/低表达,(++)以上表达者视为高表达。

表1 RunX2表达水平高低和乳腺癌患者临床病理特征的关系(n)
1.4 统计学处理 采用SPSS 16.0软件进行分析。临床指标相关性分析采用 χ2检验,采用Kaplan-Meier生存曲线分析生存率差异。
2 结果
2.1 癌组织和癌旁组织中RunX2基因的表达水平分析 75例乳腺癌组织中有44例乳腺癌组织中RunX2高表达,高表达率为58.7%;31例阴性/低表达,阴性/低表达率41.3%。与此同时,癌旁组织中23例高表达,52例阴性/低表达,χ2检验表明癌组织和癌旁组织RunX2高表达率明显增加(χ2=14.67,P<0.05)。
2.2 RunX2基因的表达与乳腺癌临床病理特征和患者预后的关系 RunX2基因的表达与乳腺癌患者的年龄、术后分期、病理类型、淋巴结转移间差异无统计学意义。在分子表型上,RunX2基因的表达与乳腺癌组织中ER表型及ki67的表达相关(图2),差异具有统计学意义(P<0.05),但与PR、HER2的表达差异无统计学意义,见表1。
75例乳腺癌患者术后均接受化疗,其中49例可作生存期分析。Log-Rank检验显示49例患者RunX2高表达和低表达患者术后3年总生存率分别为70%(95%置信区间:0.51~0.83)和43%(95%置信区间:0.32~0.54),Log-Rank检验分析显示RunX2高、低表达组在生存过程中存在明显差异(χ2=27.99,P<0.05)(图3),高表达组患者总体预后较差。
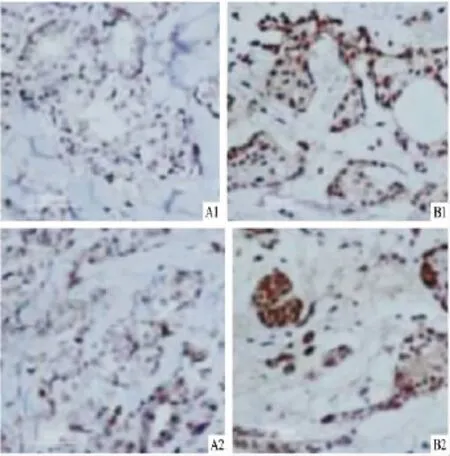
图1 免疫组化法检测患者乳腺癌组织
3 讨论
研究[6]显示RunX2为骨母细胞特异性转录因子,在骨母细胞的发育、分化和骨形成过程中起着重要的作用,随后的一系列研究[7-8]表明RunX2在多种肿瘤的发生发展中也发挥了重要作用,已被证明在成骨与骨肉瘤的发生发展过程中起重要作用,通过促进溶骨作用对肿瘤血管新生等多个途径促进癌细胞的生长转移。尤其是近年来RunX2被证明与乳腺癌的发展密切相关,多个研究[9-10]均报道在临床预后差的乳腺癌中RunX2高表达,并且可能与乳腺癌的ER、PR和HER2分子亚型密切相关。但是RunX2的表达水平、与临床病理特征的关系以及对患者预后的影响的研究一直不确切。这使得是否能将RunX2作为诊断、治疗和预后的分子标记物等带来了争议。
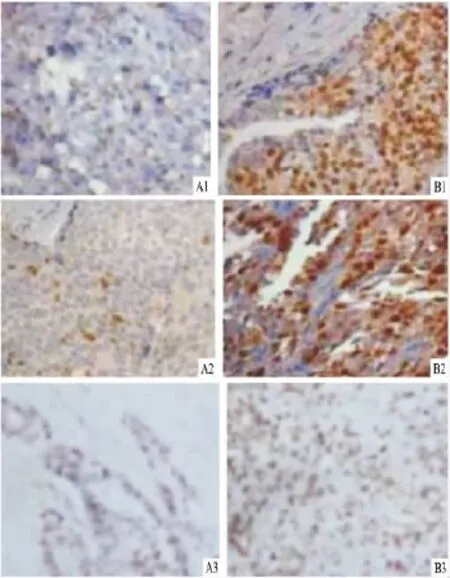
图2 免疫组化分析不同乳腺癌患者组织中ER、ki67与RunX2表达的相关性 ×40
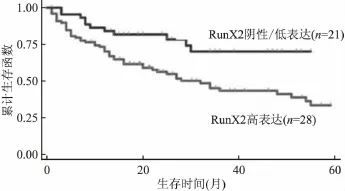
图3 49例患者RunX2表达水平相关的生存曲线分析
本研究通过对75例乳腺癌患者组织的检测,结果显示癌组织中有44例高表达RunX2、31例组织低表达RunX2;而癌旁组织仅23例高表达、52例均表达较低。癌组织和癌旁组织中RunX2的表达差异有统计学意义。这一结果进一步支持了RunX2表达上调与乳腺癌的发生发展相关。随后对RunX2基因的表达高低与患者的临床病理特征进行分析,结果显示在这75例患者中RunX2表达水平与年龄、术后分期、淋巴结转移、病理类型无明显相关性,但是与患者的ER表型和患者术后生存率相关。ER是乳腺细胞生长、分化的重要调节因子,雌激素信号通路参与乳腺上皮细胞增殖和分化,特异性表达雌激素信号通路,增加细胞增殖率,提高了患乳腺癌的风险[11-12]。ER的表达量为乳腺癌治疗和判断预后的重要指标,因此了解ER信号的调控对于乳腺癌发病和预后机制的阐明至关重要。研究[13]表明,在ER阳性乳腺癌组织中,ER mRNA的表达量明显升高,而且ER突变率也明显增加,ER对雌激素的敏感性增强,诱发乳腺癌。研究[14]表明,ERs通过雌激素活化后引发的细胞内级联信号反应,包括胰岛素样生长因子受体(IGFR)活化,产生基质金属蛋白酶,进而使肝素结合样生长因子(HB-EGF)释放。激活EGFR诱导MAPK(丝裂原活化蛋白激酶)信号通路。但是ER信号通路为何异常活化,机制尚不清楚。本研究显示RunX表达与ER表达相关,这进一步支持了RunX2对乳腺癌发生发展具有重要影响作用。与此同时,也提示,作为一种重要的转录因子,RunX2可能参与了ER的调节,具体调节机制有待进一步研究。
[1] Herceg Z,Vaissière T.Epigenetic mechanisms and cancer:an interface between the environment and the genome[J].Epigenetics,2011,6(7):804-19.
[2] Komori T.Signaling networks in RUNX2-dependent bone development[J].J Cell Biochem,2011,112(3):750-5.
[3] Mego M,Mani S A,Cristofanilli M.Molecular mechanisms of metastasis in breast cancer-clinical applications[J].Nat Rev Clin Oncol,2010,7(12):693-701.
[4] Barnes G L,Javed A,Waller S M,et al.Osteoblast-related transcription factors Runx2(Cbfa1/AML3)and MSX2 mediate the expression of bone sialoprotein in human metastatic breast cancer cells[J].Cancer Res,2003,63(10):2631-7.
[5] Chimge N O,Baniwal S K,Little G H,et al.Regulation of breast cancer metastasis by Runx2 and estrogen signaling:the role of SNAI2[J].Breast Cancer Res,2011,13(6):R127.
[6] Onodera Y,Miki Y,Suzuki T,et al.Runx2 in human breast carcinoma:its potential roles in cancer progression[J].Cancer Sci,2010,101(12):2670-5.
[7] Ding M,Lu Y,Abbassi S,et al.Targeting Runx2 expression in hypertrophic chondrocytes impairs endochondral ossification duringearlyskeletal development[J].J Cell Physiol,2012,227(10):3446-56.
[8] Dave B,Mittal V,Tan N M,et al.Epithelial-mesenchymal transition,cancer stem cells and treatment resistance[J].Breast Cancer Res,2012,14(1):202.
[9] Huang T H,Morrison S L.A trimeric anti-HER2/neu ScFv and tumor necrosis factor-αfusion protein induces HER2/neu signaling and facilitates repair of injured epithelia[J].J Pharmacol Exp T-her,2006,316(3):983-91.
[10]Reddy S D,Ohshiro K,Rayala S K,et al.MicroRNA-7,a homeobox D10 target,inhibits p21-activated kinase 1 and regulates its functions[J].Cancer Res,2008,68(20):8195-200.
[11]Radojicic J,Zaravinos A,Vrekoussis T,et al.MicroRNA expression analysis in triple-negative(ER,PR and Her2/neu)breast cancer[J].Cell Cycle,2011,10(3):507-17.
[12]Webster R J,Giles K M,Price K J,et al.Regulation of epidermal growth factor receptor signaling in human cancer cells by microRNA-7[J].J Biol Chem,2009,284(9):5731-41.
[13]Tong J S,Zhang Q H,Wang Z B et al.ER-a36,a novel variant of ER-a,mediates estrogen-stimulated proliferation of endometrial carcinoma cells via the PKCd/ERK pathway[J].PLoS One,2010,5(11):e15408.
[14]Malanchi I,Santamaria-Martínez A,Susanto E,et al.Interactions between cancer stem cells and their niche govern metastatic colonization[J].Nature,2011,481(7379):85-9.
RunX2 expression level and its association with clinical characteristics in patients with breast cancer
Hu Bin1,2,Fan Chuling1,Xu Xiaojun3,et al
(1Basic Medical School of Anhui Medical University,Hefei 230032;
2Dept of Gastrointestinal Thyroid Breast Sugery,The First People's Hospital of Anqing,Anqing 246004;
3Dept of Breast Surgery,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To analyze the expression level of RunX2 gene in breast cancer patients and to investigate its relationship with patients'clinical characteristics and outcomes.Methods Tissue samples were selected from 75 breast cancer patients without radiation and chemotherapy before surgery.Immunohistochemistry was used to compare the expression level of RunX2 between cancer and para-carcinoma tissues.The relationship was analyzed between RunX2 expression and age,pathological type,postoperative stage,lymph node metastasis,tumor size,ER,PR,HER2 and ki67 expression and the overall survival rate.Results In 75 patients'tumor tissues,there were 44 cases with high expression of RunX2 in breast cancer,31 cases with low expression of RunX2.Meanwhile,in patients'adjacent tissues,there were only 23 cases of adjacent tissues with high RunX2 expression,the rest of 52 were low or negative RunX2 expression.The expression level of RunX2 in cancer tissues and para-carcinoma tissues had significantly difference(P<0.05).The expression level of RunX2 was not correlated with age,the postoperative stage,lymph node metastasis,pathologic types,PR and HER2 expression.But high RunX2 expression was significantly associated with ER and ki67 expression.Patients with high RunX2 expression had a poorer survival rate than those with negative or low expression.Conclusion The elevated RunX2 expression may be related to breast cancer ER phenotype and clinical outcomes.It provides further evidence that this gene might have an important,context-dependent role in breast cancer.
breast cancer;RunX2;estrogen receptor;clinical outcomes
R 365
A
1000-1492(2016)09-1356-04
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.056.html
2016-06-08接收
国家自然科学基金(编号:81302319)
1安徽医科大学基础医学院,合肥 2300322安庆市第一人民医院胃肠甲乳外科,安庆 2460043安徽医科大学第一附属医院乳腺外科,合肥 230022
胡 滨,男,主治医师,硕士研究生;李菲菲,女,副教授,硕士生导师,责任作者,E-mail:13965021937@163.com

