GnRH-a预处理对子宫内膜异位症患者冻融胚胎移植结局的影响
朱晗璐,何 晔,吴 欢,周 平,魏兆莲,曹云霞
GnRH-a预处理对子宫内膜异位症患者冻融胚胎移植结局的影响
朱晗璐,何 晔,吴 欢,周 平,魏兆莲,曹云霞
目的 探讨促性腺激素释放激素激动剂(GnRH-a)预处理对子宫内膜异位症合并不孕症患者冻融胚胎移植(FET)结局的影响。方法 行FET的子宫内膜异位症合并不孕症患者的110个周期作为研究对象,将其分为GnRH-a组和对照组,比较两组患者的一般资料和妊娠结局的差异。通过单因素和多因素分析,探讨妊娠结局的影响因素。结果两组患者的年龄、不孕年限、体质指数等一般资料差异均无统计学意义,GnRH-a组临床妊娠率显著高于对照组(P<0.05)。单因素和多因素分析结果显示,GnRH-a是妊娠结局的保护因素。结论 GnRH-a预处理可改善子宫内膜异位症合并不孕症患者FET的周期结局。
促性腺激素释放激素激动剂;子宫内膜异位症;冻融胚胎移植;不孕症;影响
子宫内膜异位症(endometriosis,EMT)常发生于生育年龄,发病率为10%~15%,常合并不孕症。EMT患者中有30%~50%合并有不孕症的发生。目前,EMT导致女性不孕的机制仍未完全阐明,尚无根治方法。EMT合并不孕症患者已广泛应用体外受精-胚胎移植技术(in vitro fertilization embryo transfer,IVF-ET)助孕,其中冻融胚胎移植(frozenthawed embryo transfer,FET)因其较高的胚胎种植率倍受关注,但EMT因素不孕症患者的临床妊娠率仍处于较低(20%~40%)水平[1]。研究[2]表明,促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)可提高EMT患者的受孕率,但还没有得到一致的结论。GnRH-a预处理是否对EMT因素不孕症患者FET的结局存在影响,该研究通过对110个EMT的FET周期进行分组并给予GnRH-a预治疗干预,分析其血清指标、超声指标以及临床资料,探讨GnRH-a预治疗与EMT因素不孕症患者FET周期结局间的关系。
1 材料与方法
1.1 病例资料 选择2015年1月~11月在安徽医科大学第一附属医院生殖研究中心行FET的EMT合并不孕症患者作为研究对象。纳入标准:年龄≤35岁;经腹腔镜或剖腹手术,根据美国生育协会(AFS)修正标准分期确诊为EMTⅡ、Ⅲ期;未避孕未孕1年以上。排除标准:腹腔镜或剖腹手术确证为子宫腺肌症(adenomyosis,AM)患者或超声检查下显示子宫肌层回声明显增粗增强;合并子宫肌瘤、多囊卵巢综合征、生殖道畸形、双方或一方染色体异常等其他不孕原因的患者;有剖宫产或子宫肌瘤剜除手术史的瘢痕子宫患者;胚胎移植前使用醋酸阿托西班注射液治疗的患者。
1.2 方法
1.2.1 分组及FET前治疗和内膜准备 研究对象在决定接受胚胎移植助孕前2个月内均未接受任何GnRH-a制剂治疗,根据FET前是否给予GnRH-a预处理分为GnRH-a组和对照组。
GnRH-a组:FET内膜准备前先给予GnRH-a药物治疗。自然周期患者于月经第2天注射长效Gn-RH-a制剂预治疗(达菲林/抑那通/贝依/达必佳/博恩诺康3.75 mg/1.875 mg,1次/月),治疗1~3个周期后待恢复自然排卵,自月经第10天起行阴道超声检查,监测卵泡发育及子宫内膜厚度;人工周期患者于月经第2天注射GnRH-a制剂预治疗(达菲林/抑那通/贝依/博恩诺康3.75 mg/1.875 mg,1次/月),治疗1~3个周期后给予戊酸雌二醇(补佳乐)4 ~6 mg/d口服。
对照组:FET前2个月内未接受任何GnRH-a制剂治疗。自然周期患者自月经第10天行阴道超声检查,监测卵泡发育情况及子宫内膜厚度;人工周期患者于月经第2天给予戊酸雌二醇(补佳乐)4~6 mg/d口服。
1.2.2 周期监测及移植日的确定 自然周期自月经第10天起行阴道超声监测,根据卵泡生长情况、尿LH或血LH水平,当优势卵泡ø≥16 mm或LH≥45 IU/L时预测排卵日,并予以超声复查确认,根据胚胎情况(均为D5天囊胚)确定排卵后第5天为移植日。
人工周期自雌激素制剂给药7 d后行阴道超声监测,观察子宫内膜厚度及评价内膜生长速度,并结合血E2浓度适时调整补佳乐剂量,当子宫内膜厚度≥8 mm时加用黄体酮20 mg/d肌注1 d,40 mg/d肌注1 d,后改为60 mg/d维持,并根据胚胎情况(均为D5天囊胚)确定第5天为胚胎移植日。
1.2.3 子宫内膜厚度及蠕动波检测 研究对象中的所有EMT患者于移植前2~4 h采用超声诊断仪检查,阴道探头频率5~8 MHz。患者排空膀胱后取截石位,操作者扫查患者盆腔情况后,取子宫长轴正中矢状面,测量并记录子宫内膜厚度。并握持探头尽量保持于矢状面不动,同时注视显示屏子宫切面图像,连续动态监测子宫内膜运动5 min,同时录像。影像分析采用KM Player软件4倍速度快速播放,2名研究员分别观测并记录是否有子宫内膜蠕动及蠕动波的频率。子宫内膜蠕动波类型按Ijland分类系统评价[3]:N为无运动;CF为宫颈至宫底;FC为宫底至宫颈;OP为同时源自宫颈和宫底的相向波;R为起源于不同位置的随机蠕动波。任何类型的1次内膜蠕动都记录为1次有效蠕动波,平均每分钟的蠕动波次数记录为子宫内膜蠕动波频率(uterine peristalsis wave frequency,UPF)。
1.2.4 移植日血清雌激素、孕激素、CA125检测
移植当日清晨留取患者空腹静脉血,室温下血液自然凝固10~20 min,离心10 min(3 000 r/min),收集上清液。应用化学发光免疫分析法测定标本中E2、P以及CA125值。
1.2.5 胚胎评估标准 本研究移植的胚胎均为D5天囊胚,囊胚的质量通过镜下形态学观察进行评定,根据内细胞团和滋养层细胞进行质量评估。内细胞团分级:A级,细胞数目多,排列紧密;B级,细胞数目少,排列松散;C级,细胞数目很少。滋养层细胞分级:A级,上皮细胞层由较多的细胞组成,结构致密;B级,上皮细胞由不多的细胞组成,结构松散;C级,上皮细胞层由稀疏的细胞组成。其中胚胎评分为4BB以上者为优质胚胎,优质胚胎率是指移植胚胎中优质胚胎数占移植总胚胎数的百分比。记录移植胚胎数和胚胎评分。
1.2.6 周期结局判断 胚胎移植后11 d进行尿人绒毛膜促性腺激素(HCG)定性检测及血β-HCG定量检测,阳性确定为生化妊娠。两周后行阴道超声检查,发现妊娠囊者判定为临床妊娠。记录周期结局及超声影像下妊娠囊个数。
1.3 统计学处理 采用SPSS 17.0软件进行分析,正态分布计量资料用表示,计数资料用率表示,采用χ2检验,两组间均数比较采用t检验(正态分布)。多因素分析使用Logistic回归。检验水准α= 0.05。
2 结果
2.1 总体实验组与对照组比较 本研究纳入110 个FET周期,其中GnRH-a组有55个,共移植胚胎数109个;对照组55个FET周期,共移植胚胎数105个。两组年龄、不孕年限、BMI、基础FSH/LH、周期分组、周期移植胚胎数以及优质胚胎率等基本指标在两组间分布差异无统计学意义,说明两组的可比性好,见表1。两组周期结局的比较可以看出,GnRH-a组的胚胎种植率及临床妊娠率显著高于对照组,差异有统计学意义(P<0.05)。血清指标和超声指标在两组的分布差异无统计学意义。见表2。
2.2 人工周期组中和自然周期组中实验组与对照组比较 按照人工周期组和自然周期组分别进行比较,结果显示人工周期组所有指标差异均无统计学意义。自然周期中年龄、不孕年限、BMI、FSH/LH、周期移植胚胎数以及优质胚胎率等基本指标在Gn-RH-a组和对照组的分布差异无统计学意义,两组数据有可比性。见表3。GnRH-a组的临床妊娠率显著高于对照组,并且移植日血清CA125浓度与对照组相比较低,差异均有统计学意义(P<0.05)。见表4。
2.3 妊娠结局的影响因素分析 年龄、不孕年限、BMI、基础FSH/LH、是否GnRH-a预处理、移植日CA125水平、E2、P、移植日内膜厚度、UPF、周期平均移植胚胎数及优质胚胎率作为妊娠结局(妊娠组= 1,非妊娠组=0)的影响因素,单因素分析结果显示,妊娠结局与是否GnRH-a预处理差异有统计学意义(P=0.022),其余指标差异均无统计学意义。根据周期分组进行亚组分析结果显示,人工周期组的所有指标差异无统计学意义自然周期中GnRH-a预处理和移植日CA125水平在两组间分布差异均有统计学差异(P<0.05)。见表5。
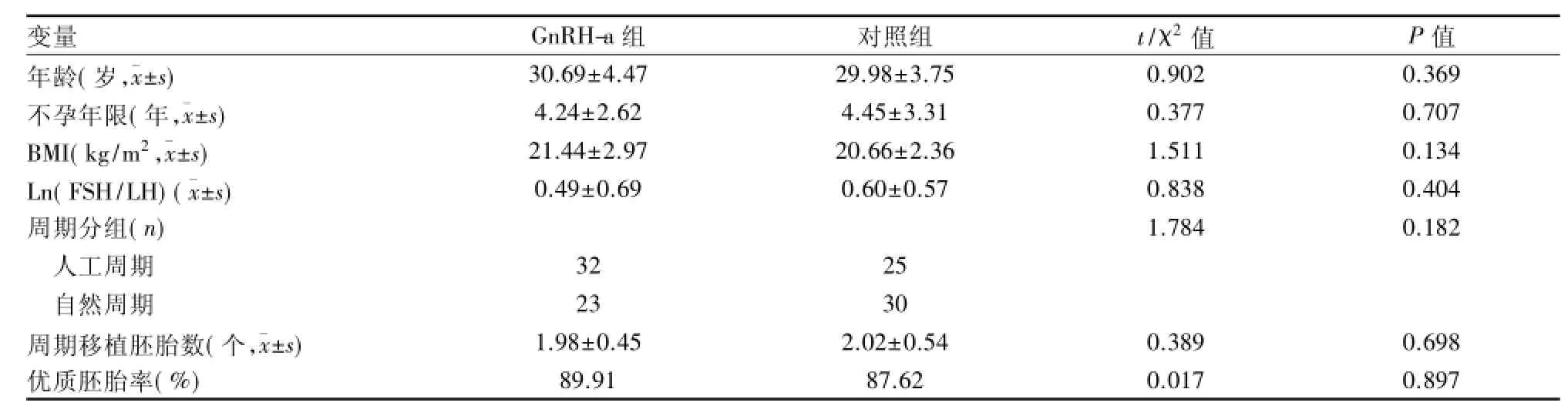
表1 基本情况比较

表2 妊娠指标以及超声和血清指标比较
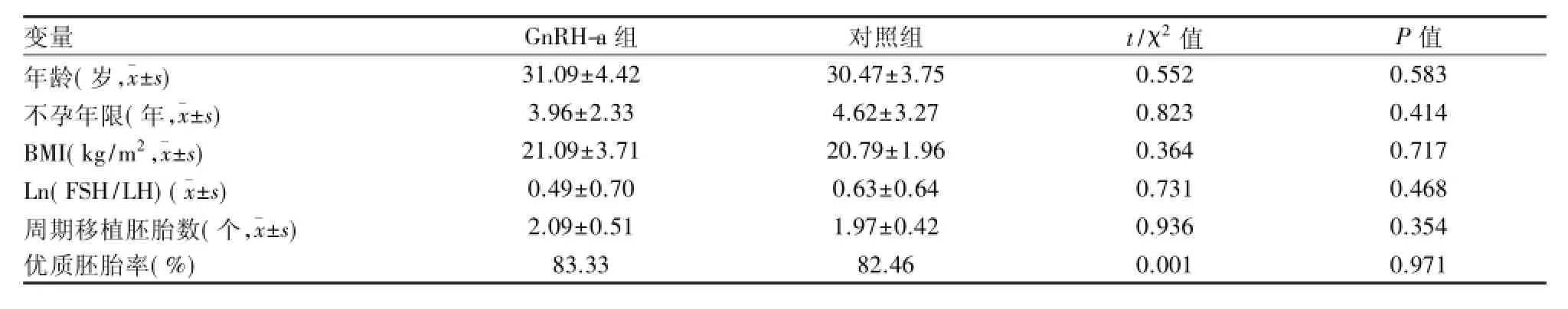
表3 自然周期中基本情况比较

表4 自然周期中妊娠指标以及超声和血清指标比较

表5 自然周期组妊娠结局的影响因素
2.4 妊娠结局的影响因素Logistic回归分析 将年龄、不孕年限、BMI、基础FSH/LH、是否GnRH-a预处理(处理组=1,未处理组=0)、移植日CA125浓度、E2、P、移植日内膜厚度及UPF作为自变量,妊娠结局作为因变量(妊娠组=1,非妊娠组=0),纳入Logistic回归方程,结果显示是否GnRH-a预处理是EMT因素不孕症患者FET结局的保护因素(OR= 3.112,95%CI:1.153~8.401,P=0.025)。周期分组的Logistic回归分析中所有指标差异无统计学意义。综合以上结果推测,GnRH-a预处理可能会提高EMT因素不孕症患者FET成功率。
3 讨论
EMT是一种常见的妇科疾病,是有活性的子宫内膜生长于子宫体以外的部位而导致的病变,临床主要表现为持续加重的盆腔黏连、疼痛与不孕。该病的发生主要取决于患者子宫内膜的组织病理学、生物化学、分子生物学等[4]。GnRH-a对体内GnRH受体有较高的亲和力,大部分GnRH受体被持续占据后,GnRH受体下调,导致垂体促性腺激素的分泌下降,从而降低机体甾体激素的水平。异位内膜组织因失去激素支持而萎缩,达到缓解症状、改善生育力的治疗效果,是目前公认的治疗子宫内膜异位症最有效的药物。研究[5-6]表明,盆腔输卵管因素、子宫腺肌症因素的不孕症患者予以GnRH-a预处理后的FET结局明显改善,但对于EMT因素不孕症的影响却鲜有报道。
本研究通过分析表明,GnRH-a组的临床妊娠率和胚胎种植率高于对照组,差异有统计学意义。研究[7-8]表明,EMT患者子宫内膜组织胞饮突、黏附分子、LIF以及整合素家族表达水平下降,导致种植窗期的子宫内膜容受性下降。而GnRH-a可改善盆腔微环境,提高子宫内膜容受性,利于胚胎的种植[9-10]。子宫腺肌症小鼠的动物实验[11]显示,经GnRH-a治疗后,子宫内膜胞饮突、整合素αvβ3以及LIF的表达均有显著改善。因此,GnRH-a可能通过改善EMT患者的内膜容受性,改善了FET结局。本研究进一步针对EMT因素不孕症患者,进行了亚组间的分析,表明自然周期FET前予以GnRH-a预处理,周期的临床妊娠率也有明显改善。
自然胚胎移植周期实验组与对照组血清学指标的分析比较中,实验组移植日血清CA125水平与对照组相比较低,差异有统计学意义。糖类抗原CA125是由内膜组织上皮细胞表达、分泌的糖蛋白,异位内膜对CA125有很强的分泌能力,研究[12]显示,EMT患者血清CA125浓度较正常升高,并与病情严重程度相关。因此推测,由于GnRH-a治疗使得内异灶萎缩,对CA125的分泌也随之减弱,所以进入外周血中可检测出血清CA125浓度随之下降。并且有学者[13]认为,血清高浓度CA125可能是盆腔异位病灶活动的反映,提示受精及妊娠囊着床可能受到影响。本研究在自然周期FET妊娠结局的相关因素分析中,显示妊娠结局与移植日血清CA125浓度有相关性,妊娠组的血清CA125水平低于非妊娠组,提示低浓度的血清CA125可能成为EMT患者FET周期结局良好的反映。但由于本实验在数据收集阶段缺少GnRH-a治疗前的血清标本的收集,未能分析出GnRH-a预处理与CA125下降的直接相关关系。
GnRH-a能够降低垂体促性腺激素的释放,从而减少卵巢对甾体激素的分泌。但在本研究中,血清E2和P浓度在两组间差异无统计学意义,其原因可能由于亚组的样本较少,数据在两组间波动的差异小。本研究中的两项超声学指标(子宫内膜厚度和内膜UPF)在两组间分布差异无统计学意义。对于上述血清和超声指标,可以进一步扩大样本量进行分析。
研究[14]表明,移植日适度低频的蠕动波可能预示良好的妊娠结局,种植窗期低频的蠕动波为胚胎着床提供相对安静的环境以及充分的养分。但本研究中子宫内膜蠕动波差异无统计学意义,可能由于子宫内膜蠕动波受到体内雌、孕激素水平以及患者心理紧张度等多种因素影响。Detti et al[15]认为子宫内膜厚度动态变化与胚胎移植的周期结局无关,本研究结果与之一致。研究[16]显示,有活性的雌激素可加重EMT的病理进程和临床症状,降低子宫内膜的胚胎容受性,从而影响胚胎种植率。也有学者认为,孕酮可以起到对抗雌激素的作用,上调内膜整合素的表达水平,从而改善内膜容受性,提高胚胎移植的妊娠率。但本研究中未见血清E2、P水平与妊娠结局间存在相关性。FET妊娠结局的相关因素进行分析中,也有学者认为年龄是主要的影响因素,因为本研究将患者年龄≤35岁作为纳入标准,所以年龄对妊娠结局的影响并不明显。
本研究同时进行了妊娠结局相关因素的多因素分析,经过校正后的结果显示GnRH-a预处理对EMT合并不孕症患者FET有保护因素。然而亚组分析没有得出一致的结果。关于两者的研究还需要良好的大型队列研究验证。
[1] 马晓娟,孙丽君,宋 娜,等.影响冻融胚胎移植妊娠结局的相关因素分析[J].生殖与避孕,2014,8(34):677-80.
[2] Streuli I,de Ziegler D,Santulli P,et al.An update on the pharmacological management of endometriosis[J].Expert Opin Pharmacother,2013,14(3):291-305.
[3] Ijland M M,Evers J L,Dunselman G A,et al.Endometrial wavelike movements during the menstrual cycle[J].Fertil Steril,1996,65 (4):746-9.
[4] Wang W,Li Y,Maitituoheti M,et al.Association of an oestrogen receptorgene polymorphis in Chinese Han women with endometriosis and endometriosis-related infertility[J].Reprod Biomed Online,2013,26(1):93-8.
[5] 李亚君,李玉艳,李 敏,等.GnRH-a预处理在冻融胚胎移植中的价值[J].第三军医大学学报,2014,15(36):1619-22.
[6] 冯 云.促性腺激素释放激素激动剂超长降调节改善子宫腺肌病冻融胚胎移植妊娠结局的作用[J].生殖医学杂志,2011,2 (1):32-5.
[7] Cakmak H,Taylor H S.Molecular mechanisms of treatment resistance in endometriosis:the role of progesterone-hox gene interactions[J].Semin Reprod Med,2010,28(1):69-74.
[8] Practice Committee of the American Society for Reproductive Medicine.Endometriosis and infertility:a committee opinion[J].Fertil Steril,2012,98(3):591-8.
[9] Fatemi H M,Kyrou D,Bourgain C,et al.Cryopreserved-thawed human embryo transfer:spontaneous natural cycle is superior to human chorionic gonadotropin-induced natural cycle[J].Fertil Steril,2010,94(6):2054-8.
[10]Al-Inany H,van Gelder P.Success of frozen embryo transfer:Does the type of gonadotropin influence the outcome[J].Int J Womens Health,2010,2:89-98.
[11]夏丽群,冯 云,刘建兵,等.GnRH-a对改善他莫昔芬诱发子宫腺肌病小鼠模型内膜容受性的作用[J].生殖与避孕,2011,31 (3):145-51.
[12]McBean J H,Brumsted J R.In vitro CA125 secretion by endometrium from women with advanced endometriosis[J].Fertil Steril,1993,59(1):89-92.
[13]骆丽华,刘雨生,季静娟,等.子宫内膜异位症血清CA125水平与体外受精结局[J].国际生殖健康/计划生育杂志,2008,6 (27):384-9.
[14]车海沙,朱 琳,肖 岚,等.子宫内膜蠕动波频率对冻融胚胎移植妊娠结局的影响[J].生殖与避孕,2014,10(34):824-9.
[15]Detti L,Yelian F D,Kruger M L,et al.Endometrial thickness dynamics and morphologic characteristics during pituitary downregulation with antagonists in assisted reproductive technology cycles [J].J Ultrasound Med,2008,27(11):1591-6.
[16]Bulun S E,Cheng Y H,Pacone M E,et al.Estrogen receptor-beta,estrogen receptor-alpha,and progesterone resistance inendometriosis[J].Semin Reprod Med,2010,28(1):36-43.
Influence of gonadotropin releasing hormone agonist on pregnancy outcomes in frozen-thawed embryo transfer cycles for patients with endometriosis
Zhu Hanlu,He Ye,Wu Huan,et al
(Dept of Reproductive Center,Dept of Obstetrics and Gynecology,The First
Affiliated Hospital of Anhui Medical University,Hefei 230022)
Objective To investigate the influence of gonadotropin releasing hormone agonist on pregnancy outcomes in frozen-thawed embryo transfer cycles for patients of endometriosis combined with infertility.Methods 110 frozen-thawed embryo transfer cycles of endometriosis patients combined with infertility were enrolled in the study. All transfer cycles were divided into 2 groups including GnRH-a group and control group.The outcomes and indexes were compared in the 2 groups.The influence factors of pregnancy outcomes were explored using univariate analysis and multivariate analysis.Results There were no significant differences in age,years of infertility,body mass index between two groups.The clinical pregnancy rate in the GnRH-a group was significantly higher than that in the control group.Univariate and multivariate analysis showed that GnRH-a was a protective factor of pregnancy outcome.Conclusion GnRH-a has a protective effect on pregnancy outcomes in frozen-thawed embryo transfer cycles for patients of endometriosis combined with infertility.
gonadotropin releasing hormone agonist;endometriosis;frozen-thawed embryo transfer;infertility;influence
R 711.71
A
1000-1492(2016)09-1303-05
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.030.html
2016-07-07接收
公益性行业科研专项经费项目(编号:201402004)
安徽医科大学第一附属医院妇产科生殖研究中心,合肥 230022
朱晗璐,女,硕士研究生;曹云霞,女,教授,主任医师,博士生导师,责任作者,E-mail:caoyunxia6@126.com

