丹参酮I对2型糖尿病ICR小鼠抗糖作用的研究
吴 胜,蔡双鹏,李小枫,黄 成,李 俊
◇药学研究◇
丹参酮I对2型糖尿病ICR小鼠抗糖作用的研究
吴 胜1,2,3,蔡双鹏1,2,3,李小枫1,2,3,黄 成1,2,3,李 俊1,2,3
目的 观察丹参酮I对高脂高糖饮食结合多次小剂量链脲佐菌素(STZ)注射诱导的2型糖尿病(T2DM)模型ICR小鼠肝脏的影响并分析其可能的作用机制。方法 制备小鼠T2DM模型,随机分为模型组、丹参酮I(高剂量、中剂量、低剂量)组、二甲双胍(Met)组和吡格列酮(Pio)组,随后这6组继续给于高脂高糖饲料喂养3周,每天注射相应浓度的药物,同时,对7组(包括正常组)小鼠每周测一次空腹血糖和体重。3周末,取小鼠肝脏,运用HE染色观察各组的病理变化,免疫组化法和Western blot法检测各组蛋白酪氨酸磷酸酶1B(PTP1B)、蛋白激酶B(Akt)、P-Akt蛋白表达水平。结果 丹参酮I高剂量组可以降低T2DM ICR小鼠的血糖(P<0.05),增加其体重(P<0.05)。丹参酮I 3个剂量组肝组织中未见明显细胞质肿胀和细胞核固缩现象,且组织中炎症较轻。免疫组化法结果显示,丹参酮I高剂量组可以降低T2DM ICR小鼠肝脏组织中PTP1B蛋白的表达(P<0.05)。Western blot法显示,丹参酮I中剂量组和高剂量组可以降低T2DM ICR小鼠肝脏组织中PTP1B蛋白的表达(P <0.05),各组中Akt的表达均无明显差异,丹参酮I高剂量组可以提高 T2DM小鼠肝脏中 P-Akt的蛋白表达(P<0.05)。结论 高剂量的丹参酮I可以降低 STZ诱导的T2DM小鼠的空腹血糖水平和肝损伤,同时降低肝脏PTP1B的表达,提高肝脏P-Akt的表达。
2型糖尿病;丹参酮I;链脲佐菌素;动物模型;PTP1B
丹参酮I是以丹参中所含的脂溶性成分丹参醌Ⅰ分离得到的单体,国内外对其的研究包括抗关节炎作用[1]、抗乳腺癌作用[2]、抑制线粒体凋亡[3]等等,目前很少有其在糖尿病方面作用的研究。而同样是丹参中脂溶性成分的丹参酮Πa则在抗糖尿病方面报道的文献比较多。肝脏及其外周组织是胰岛素作用的靶组织,也是糖脂代谢最重要的器官之一,以小鼠肝脏组织为受试对象,对抗糖尿病研究有重要意义。糖尿病是一种以高血糖为特征的代谢性疾病,常伴随着外周组织对胰岛素敏感性的降低和胰岛素信号通路的调控紊乱。对胰岛素受体,胰岛素受体底物以及其他下游分子的蛋白质酪氨酸磷酸化进行可逆调节,是胰岛素信号通路中一个重要的调控机制。蛋白酪氨酸磷酸酯酶1B(protein tyrosine phosphatase 1B,PTP1B)是PTP家族中早被纯化和确定生物学特性的蛋白酪氨酸磷酸酯酶,对胰岛素受体及其底物的磷酸化水平起着重要的负调控作用。该研究用小鼠模拟人类2型糖尿病(type 2 diabetes mellitus,T2DM)的发病过程[4],观察丹参酮I在抗糖尿病方面的作用,探讨其在动物体内可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级雄性ICR小鼠,18~22 g,购自安徽医科大学实验动物中心,实验动物饲养于安徽医科大学动物房,室温(25±2)℃,湿度(55±5)%,开始实验前,动物正常饮食饮水,适应环境1周,每天保持12 h的昼夜循环。所有实验操作符合安徽医科大学动物实验伦理委员会的要求。
1.1.2 试剂和药物 猪油、白糖、玉米油、蛋白粉(南通特洛菲饲料科技有限公司);普通饲料(安徽医科大学动物中心);柠檬酸和柠檬酸钠(上海生物工程有限公司);柠檬酸缓冲液(柠檬酸:称取2.1 g加入双蒸水100 ml配成A液,柠檬酸钠:称取2.94 g加入双蒸水100 ml配成B液。A液与B液以1∶1的比例混合,过滤,用pH计测定pH值,调节pH=4.2~4.5);链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);血糖仪及其试纸(美国强生公司);RIPA裂解液(强)、非变性PAGE蛋白上样缓冲液(5×)、HRP-羊抗兔IgG,BCA蛋白浓度测定试剂盒(上海碧云天生物技术研究所);PTP1B单克隆抗体,蛋白激酶B(protein kinase B,Akt)单克隆抗体和磷酸化的蛋白激酶B(phosphorylated protein kinase B,P-Akt)单克隆抗体(北京博奥森生物技术有限公司);丹参酮I(南京春秋生物工程有限公司);ECL发光试剂盒(美国Thermo公司);盐酸二甲双胍片(齐鲁制药有限公司);盐酸吡格列酮片(江苏德源药业)。
1.1.3 主要仪器 荧光正置显微镜(Nikon 80i,日本尼康公司);Western blot检测全套设备(美国Bio-Rad公司);GL-20A全自动冷冻高速离心机(湖南仪器仪表总厂离心机厂);超纯水机(美国Millipore公司);Leica 2135石蜡病理切片机(德国Leica公司)。
1.2 方法
1.2.1 T2DM小鼠模型的制备 普通雄性健康ICR小鼠80只随机分成两组:正常组10只,高脂高糖组70只,正常组给于普通饲料,高脂高糖组给于高脂高糖饲料饲养,时间为4周。第4周末,取已经配好的STZ溶液(取适量的STZ溶于柠檬酸缓冲液中,以1%的浓度配制,由于STZ不稳定,所以在快速称取后用锡箔纸包好置于冰上保存,现配现用,配好的溶液在30 min内注射完毕),对高脂高糖组小鼠按照40 mg/kg的剂量进行腹腔注射,每隔2 d注射1次,连续注射5次(每次注射前禁食禁水过夜)。2周后,测空腹血糖,将血糖值高于13.89 mmol/L的实验小鼠挑选出来。
1.2.2 动物分组及给药方法 共有54只小鼠造模成功,再随机分为6组,每组9只,分别是模型组、丹参酮I(高剂量、中剂量、低剂量)组、二甲双胍(Met)组和吡格列酮(Pio)组,随后继续给于高脂高糖饲料喂养,持续3周。丹参酮I组3个浓度分别是120、60、30 mg/kg(丹参酮I溶解在玉米油中,腹腔注射,现配现用),二甲双胍浓度是120 mg/kg,吡格列酮浓度是12 mg/kg(片剂研磨成粉末后,充分溶解于蒸馏水中,腹腔注射,现配现用),每天注射相应剂量的药物。同时,每周测1次体重和空腹血糖。第3周末,取肝脏。
1.2.3 肝脏组织中的蛋白提取 将50~100 mg肝组织剪碎至匀浆器内,加入1 ml裂解液和10 μl PMSF,匀浆20~40次,每隔5 min匀1次,成液裂解30 min,4℃、12 000 r/min离心30 min,上清液转移至新的EP管中。使用BCA试剂盒进行蛋白定量检测,各组上清液用裂解液调至相同蛋白浓度,于高压后的EP管加入5×SDS蛋白上样缓冲液(蛋白上清液 ∶蛋白上样缓冲液=4∶1,蛋白上样缓冲液要离心),混匀,100℃沸水煮10 min,放-20℃冻存。
1.2.4 免疫组化及病理形态学分析 各组的肝脏用4%多聚甲醛溶液固定24 h,常规石蜡包埋,Leica切片机切片,厚4 μm,利用组织芯片技术,将蜡片裱贴于载玻片上,并于65℃中干烤1 h,SP法[7]检测PTP1B蛋白表达。
1.2.5 检测肝脏组织中PTP1B、Akt和P-Akt蛋白水平 将提取的总蛋白进行SDS-PAGE电泳,使蛋白转移至PVDF膜上,转膜后用5%的脱脂奶粉室温下封闭3 h,分别加入β-actin(1∶300)、PTP1B(1∶100)、Akt(1∶100)、P-Akt(1∶100)一抗,4℃孵育过夜后TBST洗涤3次,每次15 min,然后加入辣根过氧化物酶(HRP)标记的二抗(1∶10 000),室温孵育1 h,TBST洗涤3次,每次15 min。最后用ECL发光液进行曝光显影,Bio-Rad照相系统拍照,并用Image-J软件分析蛋白的相对表达量。
1.3 统计学处理 采用SPSS 19.0软件进行分析,计量资料以表示,多个样本均数比较采用单因素方差分析。
2 结果
2.1 丹参酮I对STZ诱导的T2DM小鼠空腹血糖的影响 为了观察丹参酮I对小鼠血糖的影响,给药后,每周测定其空腹血糖,连续检测3周。结果显示,在给药之前,所有的T2DM小鼠的空腹血糖均高于正常组。从给药之后的第1周开始,模型组的空腹血糖与丹参酮I高剂量组、Met组、Pio组比较,差异有统计学意义[第1周:F=34.49,P<0.05;第2周:F=29.82,P<0.05;第3周:F=41.87,P<0.05],并且模型组的血糖在3周内保持稳定。提示制备的T2DM模型较稳定,并且一定浓度的丹参酮I可以降低T2DM ICR小鼠的血糖。见图1。
2.2 丹参酮I对STZ诱导的T2DM小鼠体重的影响 应用高脂高糖结合多次小剂量STZ诱导的方法建立T2DM模型,结果显示,第1周时,模型组小鼠体重明显高于丹参酮I(中剂量、低剂量)组、Met组和Pio组(F=4.03,P<0.05);模型组与丹参酮I高剂量组、正常组比较,差异均无统计学意义。从第2周开始,模型组小鼠毛发蓬松,缺乏光泽,活动度显著减小,体重明显降低,第3周,模型组小鼠体重明显低于正常组和丹参酮I高剂量组(F=11.69,P <0.05)。提示一定浓度的丹参酮I在一定程度上可以改善T2DM ICR小鼠的症状。见表1。
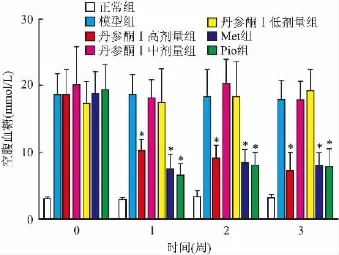
图1 ICR小鼠在3周内的空腹血糖变化
表1 ICR小鼠在3周内的体重变化(g,)

表1 ICR小鼠在3周内的体重变化(g,)
与模型组比较:*P<0.05;与正常组比较:#P<0.05
分组 第1周 第2周 第3周正常 40.58±4.03 41.40±2.70 41.25±1.31模型 41.14±3.54 37.88±2.24 30.53±3.81#丹参酮I高剂量 38.22±2.77 30.29±3.37 36.97±2.28*丹参酮I中剂量 36.25±2.97* 36.10±3.73 32.67±5.33丹参酮I低剂量 35.29±3.71* 34.17±3.40 28.23±4.72 Met 37.59±3.37* 36.48±4.25 37.00±3.00 Pio 36.16±1.62* 35.53±2.05 33.64±1.68
2.3 丹参酮I对STZ诱导的T2DM小鼠肝组织病理形态的影响 HE染色结果显示,模型组小鼠部分肝脏组织结构中可见细胞质肿胀,细胞核固缩,有局部的细胞坏死,组织中炎症较其他组严重。丹参酮I组肝组织中未见明显细胞质肿胀和细胞核固缩现象,且组织中炎症较轻。提示一定浓度的丹参酮I可以降低T2DM ICR小鼠肝脏的损伤。见图2。
2.4 免疫组化法检测各组小鼠肝脏组织PTP1B蛋白表达的变化 以PTP1B阳性反应部位积分光密度(integral optical density,IOD)为指标,结果显示,模型组肝脏组织PTP1B表达最多,其与丹参酮I高剂量组、Met组、Pio组比较,差异有统计学意义(F= 43.75,P<0.05),与丹参酮I中剂量组、低剂量组比较,差异无统计学意义。提示一定浓度的丹参酮I可以降低T2DM ICR小鼠肝脏组织中PTP1B蛋白的表达。见图3。

图2 小鼠肝脏组织形态学染色 HE× 100 A:正常组;B:模型组;C:丹参酮I高剂量组;D:丹参酮I中剂量组;E:丹参酮I低剂量组;F:Met组;G:Pio组
2.5 Western blot法检测肝脏组织中PTP1B蛋白水平 模型组PTP1B蛋白表达高于正常组、丹参酮I(中剂量、高剂量)组、Met组和Pio组,差异有统计学意义(F=19.94,P<0.05);模型组PTP1B蛋白的表达略高于丹参酮I低剂量组,差异无统计学意义。丹参酮I低剂量组PTP1B蛋白表达明显高于Met组和Pio组(F=19.94,P<0.05);丹参酮I中剂量组与Met组、Pio组比较,差异均无统计学意义;丹参酮I高剂量组与Met组、Pio组比较,差异均无统计学意义。提示一定浓度的丹参酮I可以降低T2DM ICR小鼠肝脏中PTP1B蛋白的表达。见图4。
2.6 Western blot法检测肝脏组织中Akt和P-Akt蛋白水平 各组中Akt的表达均无明显差异。模型组P-Akt的表达明显低于正常组、丹参酮I高剂量组、Pio组和Met组(F=14.09,P<0.05);模型组与丹参酮I(中剂量、低剂量)组比较,差异均无统计学意义。丹参酮I低剂量组P-Akt的蛋白表达明显低于Met组和Pio组(F=14.09,P<0.05);丹参酮I中剂量组P-Akt的蛋白表达低于Met组和Pio组(F= 14.09,P<0.05);丹参酮I高剂量组与Met组、Pio组比较,差异均无统计学意义。提示一定浓度的丹参酮I可以提高T2DM小鼠肝脏中P-Akt蛋白的表达。见图5。
3 讨论

图3 免疫组化法检测肝组织PTP1B蛋白的表达 SP×400
模型组小鼠注射STZ 3周后,毛发蓬松,色泽灰暗,活动度显著减小,体重明显降低。与之相比,丹参酮I高剂量组、Met组和Pio组的上述症状较轻。进一步测定各组小鼠的空腹血糖发现,虽然丹参酮I低剂量和中剂量组的空腹血糖未见明显变化,但高剂量组却见明显的降血糖作用,这为进一步研究丹参酮I抗糖尿病作用提供了线索。近年来,丹参酮Πa在糖尿病方面的研究也只是间接的反映其他问题,笔者查阅了大量文献,并未有其对抗糖尿病的直接探讨,例如对T2DM大鼠缺血再灌注损伤的保护作用[5],改善T2DM大鼠神经功能的损伤[6],改善糖尿病引起的早期肾病[7]等。药物的溶解度、给药方式和老鼠种系等都会影响药物和受试对象的量效关系。国内外在制备大鼠T2DM模型方面研究较为深入,以小鼠为研究对象的造模研究较少,本研究采用高脂高糖饮食再加上多次小剂量腹腔注射STZ的方法制备T2DM模型小鼠。以玉米油为溶剂[8],是因为丹参酮I是具有脂溶性的物理性质。以腹腔注射的方式给药,是因为腹膜面积大,密布血管和淋巴管,药物吸收能力特强,且腹腔补液时间短,速度快。而在造模过程中所用STZ的给药剂量、次数以及时间间隔[9]也会影响量效关系,因此,如何选择合适的条件,对实验结果都会有很大的影响。
由病理组织芯片[10]观察,模型组肝脏组织出现的炎症反应比给药组严重。目前TNF-α、IL-6等是研究的热点,两者既是促炎性介质,也是细胞因子,直接或间接激活肝星状细胞释放细胞外基质,最终导致肝纤维化,因此肝星状细胞在肝纤维化中起决定性作用。有文献[11]报道,IL-6在T2DM及其并发症的发生发展中起重要作用。而肝纤维化往往也会伴有炎症的出现,这为进一步研究丹参酮I是否可以抑制肝星状细胞的激活以及其对T2DM动物肝纤维化[12]发展过程的影响提供了线索。

图4 Western blot法检测肝脏PTP1B蛋白表达
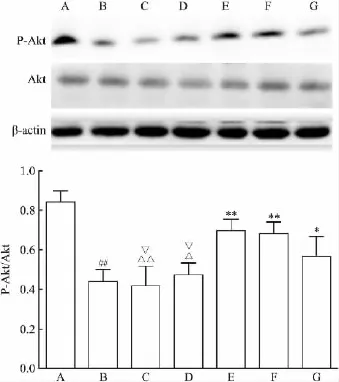
图5 Western blot法检测肝脏Akt和P-Akt蛋白表达
PTP1B和PI3K/Akt信号通路同时作为胰岛素信号通路中的影响因子,对胰岛素信号的增强或者减弱发挥着重要作用。PTP1B属于蛋白质酪氨酸磷酸酶家族,拮抗胰岛素信号,经免疫组化和Western blot检测显示,一定浓度的丹参酮I可以抑制PTP1B在肝脏组织中的表达。PI3K/Akt信号通路协同胰岛素信号通路,是作为胰岛素的主要信号通路参与体内糖脂代谢病理生理机制的[13]。本研究通过检测PTP1B下游所调节的P-Akt表达,观察丹参酮I对肝脏组织中Akt磷酸化水平的影响,Western blot结果显示,一定浓度的丹参酮I能够有效地提高肝脏组织中Akt的磷酸化水平,使P-Akt蛋白的表达升高。有文献[14]报道,PTP1B主要在肌肉和脂肪组织中表达,其过表达与胰岛素抵抗现象有相关性。PTP1B可以通过增加表达或提高活性使胰岛素受体及受体底物去磷酸化,而对胰岛素信号转导起负性调节作用,最终导致胰岛素抵抗[15]。胰岛素抵抗易导致2型糖尿病,而胰岛素摄取和利用葡萄糖的效率是反映胰岛素抵抗强弱的指标,因此,PTP1B抑制剂和胰岛素增敏剂成为近年来研究的热点,本研究探讨丹参酮 I对小鼠肝脏组织中PTP1B的表达有重要意义。对 PTP1B抑制剂的研究多是体外实验,而建立胰岛素抵抗模型细胞最经典的是HepG2细胞,其模型建立的方法日趋成熟,丹参酮I对胰岛素抵抗模型的HepG2细胞株中PTP1B表达的研究成为下一步的工作。
[1] Wang Y,Wang S,Li Y,et al.Therapeutic effect of Cryptotanshinone on collagen-induced arthritis in rats via inhibiting nuclear factor kappa B signaling pathway[J].Transl Res,2015,165(6):704-16.
[2] Li S,Wang H,Hong L,et al.Cryptotanshinone inhibits breast cancer cell growth by suppressing estrogen receptor signaling[J]. Cancer Biol Ther,2015,16(1):176-84.
[3] Sun P P,Yuan F,Xu J,et al.Cryptotanshinone ameliorates hepatic normothermic ischemia and reperfusion injury in rats by antimitochondrial apoptosis[J].Biol Pharm Bull,2014,37(11):1758-65.
[4] 曾位森,黄源坚,邵聪文,等.高脂饮食诱导的2型糖尿病模型小鼠的生化及病理分析[J].南方医科大学学报,2014,34 (8):1115-20.
[5] Zhang Y,Wei L,Sun D,et al.Tanshinone IIA pretreatment protects myocardium against ischaemia/reperfusion injury through the phosphatidylinositol 3-kinase/Akt-dependent pathway in diabetic rats[J].Diabetes Obes Metab,2010,12(4):316-22.
[6] Liu Y,Wang L,Li X,et al.Tanshinone IIA improves impaired nerve functions in experimental diabetic rats[J].Biochem Biophys Res Commun,2010,399(1):49-54.
[7] Kim S K,Jung K H,Lee B C.Protective effect of Tanshinone IIA on the early stage of experimental diabetic nephropath[J].Biol Pharm Bull,2009,32(2):220-4.
[8] 邵志滨,谢海龙.组织芯片技术及其在胃癌研究中的应用[J].国际病理科学与临床杂志,2007,27(3):235-8.
[9] Tao S,Zheng Y,Lau A,et al.Tanshinone I activates the Nrf2-de-pendent antioxidant response and protects against As(III)-induced lung inflammation in vitro and in vivo[J].Antioxid Redox Signal,2013,19(14):1647-61.
[10]Thomas J,Garg M L,Smith D W.Dietary resveratrol supplementation normalizes gene expression in the hippocampus of streptozotocin-induced diabetic C57Bl/6 mice[J].J Nutr Biochem,2014,25(3):313-8.
[11]崔思远,李 芳.IL-6与2型糖尿病关系的研究进展[J].中国微生态学杂志,2012,24(11):1051-5.
[12]房彩霞,周 红,李贵芝,等.RhoA/Rho激酶在2型糖尿病大鼠肝脏纤维化中的作用[J].基础医学与临床,2014,34(3):332-8.
[13]Fick L J,Cai F,Belsham D D.Hypothalamic preproghrelin gene expression is repressed by insulin via both PI3-K/Akt and ERK1/ 2 MAPK pathways in immortalized,hypothalamic neurons[J]. Neuroendocrinology,2009,89(3):267-75.
[14]Zhao Y,Tang Z,Shen A,et al.The Role of PTP1B O-GlcNAcylation in hepatic insulin resistance[J].Int J Mol Sci,2015,16 (9):22856-69.
[15]Zabolotny J M,Haj F G,Kim Y B,et al.Transgenic overexpression of protein-tyrosine phosphatase 1B in muscle causes insulin resistance,but overexpression with leukoeyte antigen-related phosphatase dose not additively impair insulin action[J].J Biol Chem,2004,279(23):24844-51.
Anti-diabetic effect of tanshinone I on ICR mice with type 2 diabetes mellitus
Wu Sheng1,2,3,Cai Shuangpeng1,2,3,Li Xiaofeng1,2,3,et al
(1School of Pharmacy,2Institute for Liver Diseases,Anhui Medical University,
3Anhui Institute of Innovative Drugs,Hefei230032)
Objective To observe the effect of tanshinoneⅠon the liver of ICR mice with type 2 diabetes mellitus (T2DM),induced by high-fat diet combined with several low-dose streptozotocin(STZ)injections and to explore its potential mechanism.Methods Establish the mouse model of T2DM and mice would be divided randomly into the model group,high-dose tanshinoneⅠgroup,medial-dose tanshinoneⅠgroup,low-dose tanshinoneⅠ group,the metformin(Met)group and the pioglitazone(Pio)group.The groups above were fed with high-fat diet and received daily injections of various-dose drugs as previously described for a period of three weeks.Livers were extracted at the end of the third week.Pathological changes by means of hematoxylin and eosin(HE)staining were observed.The protein expression levels of protein tyrosine phosphatase-1B(PTP1B),Akt and P-Akt were detected by the immunohistochemical experiment and Western blot.Results High-dose tanshinoneⅠ could decrease FBG of mice with type 2 diabetes mellitus(P<0.05)and increase their body weight(P<0.05).Cells with cytoplasm tumefied and nucleus pyknosed,necrocytosis and inflammation in tanshinoneⅠgroups could be seen less compared to the modle group.Immunohistochemistry showed that high-dose tanshinoneⅠcould decrease the protein expression of PTP1B in mice with type 2 diabetes mellitus(P<0.05).Analysis of Western blot revealed that medial-dose and high-dose tanshinoneⅠcould decrease the protein expression levels of PTP1B in mice with T2DM(P<0.05).At the same time,there was no significant difference in the protein expression levels of Akt between the model group and tanshinoneⅠgroups.High-dose tanshinoneⅠcould increase the protein expression levels of P-Akt compared to the modle group(P<0.05).Conclusion TanshinoneⅠin high concentration could decrease FBG and relieve the injury of liver in T2DM ICR mice,induced by high-fat diet combined with several low-dose STZ injections.At the same time,it could also decrease their protein expression levels of PTP1B and increase P-Akt expressions.
type 2 diabetes mellitus;tanshinoneⅠ;streptozotocin;animal model;protein tyrosine phosphatase-1B
R 587.1
A
1000-1492(2016)09-1286-06
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.024.html
2016-05-04接收
国家自然科学基金(编号:81473268、81273526);高等学校博士学科点专项科研基金(编号:20123420120001);安徽省自然科学基金(编号:1408085MKL31);安徽省科技攻关计划项目(编号:1301042212)
安徽医科大学1药学院、2肝病研究所,3安徽省创新药物 产业共性研究院,合肥 230032
吴 胜,男,硕士研究生; 李 俊,男,教授,博士生导师,责任作者,E-mail:lj@ahmu.edu.cn

