双酚A对小鼠3T3-L1前脂肪细胞分化的影响
冷银芝,李应配,罗时猛,蒋建华,朱启星,沈 彤,
◇预防医学研究◇
双酚A对小鼠3T3-L1前脂肪细胞分化的影响
冷银芝1,李应配1,罗时猛1,蒋建华2,朱启星3,沈 彤1,3
目的 探讨双酚A(BPA)对小鼠3T3-L1前脂肪细胞分化及细胞因子分泌的影响。方法 用不同剂量(10、100、1 000 nmol/L)BPA体外处理诱导分化过程中的小鼠3T3-L1前脂肪细胞,在第2、4、8天时,用CCK-8检测细胞存活率,油红O染色检测细胞内脂质含量,ELISA法测定上清液中脂联素和瘦素的含量,实时荧光定量PCR检测细胞内瘦素和脂联素mRNA表达水平。结果 第2天时,1 000 nmol/L BPA组细胞存活率较对照组明显升高(P<0.05),第8天时,10、100和1 000 nmol/L BPA组细胞存活率较对照组均显著下降(P<0.05,P<0.01);油红O染色显示细胞内脂滴随BPA剂量和时间的增加且变大;第4天时,1 000 nmol/L BPA组瘦素含量和mRNA水平均增高(P<0.05),第8天时,100、1 000 nmol/L BPA组瘦素含量和mRNA水平均明显增加(P <0.01);第8天时,100、1 000 nmol/L BPA组脂联素含量和mRNA水平均下降(P<0.01)。结论 BPA促进了小鼠3T3-L1前脂肪细胞向脂肪细胞分化,增加细胞瘦素分泌,抑制细胞脂联素的分泌。
双酚A;小鼠3T3-L1前脂肪细胞;分化;瘦素;脂联素
近几十年里,肥胖患病率呈全球持续升高的状态[1],“环境致肥胖因子”备受关注[2]。研究[3]表明环境中双酚A(bisphenol A,BPA)是一种环境致肥胖因子。人群流行病学研究报告环境BPA暴露会增加肥胖症、心血管疾病和糖尿病的风险[4],动物实验显示BPA与脂肪细胞分化和炎症状态相关[5]。但是BPA引起肥胖的具体分子机制尚未完全阐明。该研究采用低剂量BPA处理体外诱导分化的小鼠3T3-L1前脂肪细胞,在不同时间点检测细胞脂质沉积、脂联素和瘦素表达水平,探讨低剂量BPA暴露对小鼠3T3-L1前脂肪细胞分化的影响,为阐明BPA暴露导致肥胖等代谢性疾病的发病机制提供实验依据。
1 材料与方法
1.1 主要试剂和仪器 BPA(99.9%分析纯,天津市大茂化学试剂厂);BPA用DMSO助溶(终浓度不超过0.1%);DMEM高糖培养基(美国Gibco公司);青霉素和链霉素(华北制药华胜公司);胰酶(江苏海门市碧云天公司);胎牛血清(杭州四季青生物工程材料有限公司);二甲基亚砜(dimethyl sulfoxide,DMSO)、地塞米松、CCK-8试剂盒、3-异丁基-1-甲基黄嘌呤(1-methyl-3-isobutylxanthine,IBMX)(美国Sigma公司);胰岛素(江苏万邦生化医药股份有限公司);油红O(美国Promega公司);酶联免疫吸附剂测定试剂盒(enzyme-linked immunosorbent assay,ELISA,苏州卡尔文生物科技有限司);RNA提取纯化试剂盒RNeasy Mini Kit(德国QIAGEN公司);逆转录试剂盒(美国Thermo公司);LightCycler 480 SYBR Green I Master、LightCycler 480 PCR仪(瑞士Roche公司);瘦素、脂联素和 β-actin引物(大连宝生物有限公司合成);CO2培养箱(美国SHELL/JB公司);μQuant酶标仪(美国Bio-Tek公司);倒置显微镜(德国OLYMPUS公司)。
1.2 小鼠3T3-L1前脂肪细胞培养、诱导分化及BPA处理 小鼠3T3-L1前脂肪细胞(美国Sigma公司)用基础培养基(10%灭活胎牛血清、高糖DMEM/F12液体培养基,1%青链霉素混合液)在37℃、5%CO2下培养,2~3 d换液1次,细胞90%融合后用于试验。细胞用诱导分化培养基Ⅰ(高糖DMEM,10%灭活胎牛血清、10 mg/L牛胰岛素,1 μmol/L地塞米松,0.5 mmol/L IBMX,1%双抗)诱导分化,同时加入10、100、1 000 nmol/L BPA处理,第2天时撤去IBMX和地塞米松,换用诱导分化培养基Ⅱ(高糖DMEM,10%灭活胎牛血清、10 mg/L牛胰岛素、1%双抗)继续培养至第8天,每2 d换液1次。
1.3 CCK-8测定细胞增殖 将1×104个细胞接种到96孔培养板,在诱导分化和BPA处理后,分别在第2、4、8天时每孔加入10 μl CCK-8溶液,培养1.5 ~4.0 h,用酶标仪在450 nm处测吸光度。细胞存活率(%)=[(实验孔-空白孔)/(对照孔-空白孔)]× 100%。
1.4 油红O染色检测细胞内脂质沉积 将1×105个细胞接种于48孔板,诱导分化和BPA处理,分别在第2、4、8天时,细胞用PBS洗3次,10%甲醛固定5 min,PBS再洗3次,用0.5%油红O染色15 min,苏木精复染1 min,PBS冲洗至变蓝,显微镜拍照。
1.5 ELISA法检测细胞上清液中瘦素和脂联素含量 诱导分化第2、4、8天时收集细胞上清液,3 187 r/min离心20 min后-20℃保存。用ELISA试剂盒检测上清液中瘦素和脂联素的含量,按照试剂盒说明书进行操作。
1.6 实时定量PCR(qRT-PCR)检测细胞中瘦素和脂联素mRNA表达 诱导分化第2、4、8天时收集细胞,用RNeasy Minin Kit试剂盒提取总RNA,逆转录试剂盒合成cDNA,在LightCycler480 PCR仪上用SYBR®Premix Ex TaqTM II试剂盒进行扩增,扩增条件:94℃预变性4 min,95℃变性15 s,60℃退火15 s,72℃延伸30 s,共45个循环反应,引物序列见表1。用β-actin作内对照,2-ΔΔCt法分析基因相对表达水平。

表1 小鼠基因的引物序列
1.7 统计学处理 采用SPSS 16.0统计软件进行分析,所有实验独立重复至少3次,数据均以表示。多组间比较采用One-Way ANOVA,组间比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 不同剂量BPA对诱导分化的小鼠3T3-L1前脂肪细胞增殖的影响 CCK8检测结果显示,在同一时间点,空白对照组与DMSO组细胞存活率差异无统计学意义;第2天时,与空白对照组比较,1 000 nmol/L BPA组细胞存活率明显升高(F=2.54,P<0.05)。第4天时,各组间细胞存活率差异无统计学意义。第8天时,与空白对照组比较,100 nmol/L BPA组和1 000 nmol/L BPA组细胞存活率显著下降(F=5.15,P<0.05,P<0.01)。见图1。
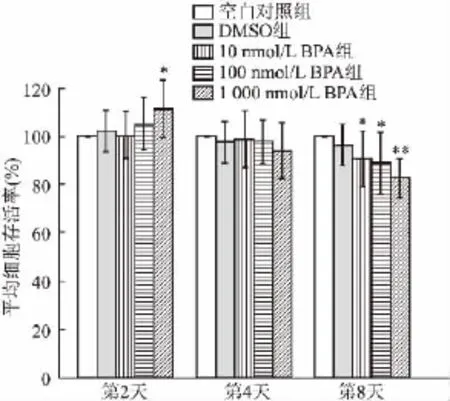
图1 不同剂量BPA对诱导分化的3T3-L1细胞存活率的影响(n=4)
2.2 不同剂量BPA对诱导分化的小鼠3T3-L1前脂肪细胞分化的影响 诱导分化前小鼠3T3-L1前脂肪细胞贴壁,呈梭形,透亮,胞质少且内无脂滴。空白对照组细胞,诱导分化第2天时,细胞形态变化不明显;第4天时细胞变圆变大,胞质增多,油红O染色显示有较小脂滴;第8天时细胞变得更圆更大,胞浆更丰富,油红O染色显示脂滴增多变大,密集于核周,形成“指环样”结构。与空白对照组相比,不同剂量BPA组细胞形状更大更圆,油红O染色显示细胞内脂滴随BPA剂量和时间的增加而增多变大,见图2。
2.3 不同剂量BPA对诱导分化小鼠3T3-L1前脂肪细胞中瘦素和脂联素含量的影响 第0天的瘦素基础值是5.68 ng/ml,与诱导分化第2天的空白对照组的脂联素水平比较,差异无统计学意义。诱导分化到第4天时,与空白对照组比较,BPA组瘦素含量升高,1 000 nmol/L BPA组差异有统计学意义(F=2.09,P<0.05);第8天时,与空白对照组相比,BPA组瘦素含量升高更明显,100 nmol/L和1 000 nmol/L BPA组差异均有统计学意义(F= 11.00,P<0.01),见图3。第0天的脂联素基础水平是1 497.84 pg/ml,与诱导分化第2天的空白对照组的脂联素水平比较,差异无统计学意义。第4天时,与空白对照组相比,BPA组脂联素含量下降,但各组差异无统计学意义;第8天时,与空白对照组相比,BPA组脂联素含量进一步下降,100 nmol/L 和1 000 nmol/L BPA组差异均有统计学意义(F= 10.53,P<0.01,P<0.01),见图4。
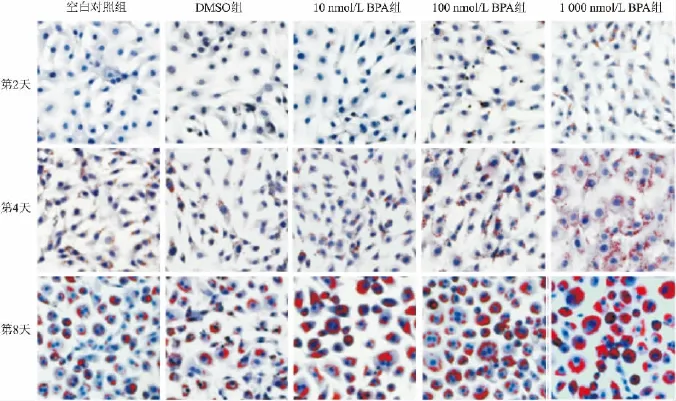
图2 油红O染色观察BPA对小鼠3T3-L1前脂肪细胞诱导分化的影响 ×200
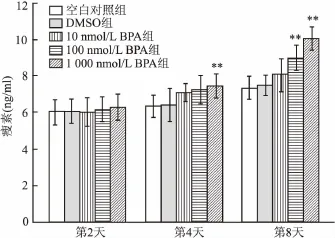
图3 不同剂量BPA对诱导分化小鼠3T3-L1前脂肪细胞中瘦素含量的影响(n=3)
2.4 不同剂量BPA对诱导分化小鼠3T3-L1前脂肪细胞中瘦素和脂联素mRNA水平的影响 诱导分化2天,与空白对照组相比,各BPA组细胞中瘦素mRNA水平差异无统计学意义;第4天时,与空白对照组比较,BPA组瘦素mRNA水平上调,1 000 nmol/L BPA组差异有统计学意义(F=4.03,P<0.05);第8天时,与空白对照组相比,BPA组瘦素mRNA水平进一步上调,100 nmol/L BPA组和1 000 nmol/L BPA组差异均有统计学意义(F=11.24,P<0.01),见图5。诱导分化第2天,与空白对照组相比,各BPA组细胞中脂联素mRNA水平差异无统计学意义;第4天时,与空白对照组比较,BPA组脂联素mRNA水平下调,1 000 nmol/L BPA组差异有统计学意义(F=0.71,P<0.05);第8天时,与空白对照组相比,BPA组脂联素mRNA水平进一步下调,10、100、1 000 nmol/L BPA组差异均有统计学意义(F=54.40,P<0.01),见图6。

图4 BPA对诱导分化小鼠3T3-L1前脂肪细胞中脂联素含量的影响(n=3)
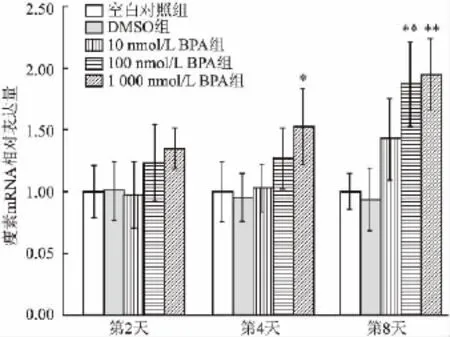
图5BPA对诱导分化小鼠3T3-L1前脂肪细胞瘦素mRNA水平的影响(n=3)

图6 BPA对诱导分化小鼠3T3-L1前脂肪细胞脂联素mRNA水平的影响(n=3)
3 讨论
日常生活中人类广泛接触的BPA可以通过多种暴露途径进入人体,其在体内以结合或单体的形式存在,尿液浓度范围为0.4~44 nmol/L[6]。近年来对体内生理相关剂量BPA(≤1×10-7mol/L)的暴露与肥胖关系研究已成为人们关注的热点[7]。
肥胖是体内脂肪过度合成、体重增加为重要特征的一种代谢异常,主要为前脂肪细胞数量异常增加和分化。前脂肪细胞分化过程首先是前脂肪细胞融合后的克隆性增殖,接着是增殖终止并开始分化,最终分化为成熟的脂肪细胞[4]。体外研究[8]显示人前脂肪细胞在暴露50 μmol/L BPA 48 h后开始向脂肪细胞分化,小鼠3T3-L1前脂肪细胞在诱导分化条件下100 nmol/L BPA组的脂肪细胞的分化程度更大,且分化程度与BPA暴露浓度和时间呈正相关性[5]。本研究结果显示,诱导分化第2天时1 000 nmol/L BPA组显著增加细胞存活率,表明诱导分化早期较高剂量BPA促进细胞增殖;第4天时各组细胞存活率差异不明显,表明诱导中期BPA诱导的细胞增殖减少,而细胞开始分化;第8天时100和1 000 nmol/L BPA组细胞存活率明显抑制,表明诱导晚期BPA促进细胞向脂肪细胞分化。油红O染色检测也显示BPA能促进细胞内脂滴的沉积增多,也表明BPA促进前脂肪细胞向成熟脂肪细胞分化。以上结果表明BPA促进小鼠前脂肪细胞向脂肪细胞分化。
肥胖的病理基础是全身慢性低度炎症状态,主要表现为脂肪组织中促炎因子维持较高水平和抗炎因子被抑制,其中炎性因子如瘦素,抗炎因子如脂联素都是由脂肪细胞分泌的重要的脂肪因子。人群资料显示孕期暴露高水平BPA可致子代体内瘦素水平升高[9]。体外研究[10]表明微摩尔级浓度BPA引起前脂肪细胞瘦素等脂肪因子分泌增加趋势呈现时间剂量依赖关系。研究[11]证实肥胖个体内脂联素水平比瘦体低,不同种族的肥胖、2型糖尿病等与低血浆脂联素水平相关;体外研究[12]环境相当剂量BPA能够抑制人体脂肪组织及脂肪细胞的脂联素合成。本研究结果显示,瘦素含量和mRNA水平随BPA剂量的递增和诱导时间的延长而增加;脂联素含量和mRNA水平则随BPA剂量的递增和诱导时间的增长而下降,表明低剂量BPA促进诱导分化小鼠前脂肪细胞中瘦素分泌,抑制其中脂联素的分泌。以上表明环境BPA暴露诱导肥胖可能与其干扰脂肪因子瘦素和脂联素的分泌有关。
本研究表明低剂量BPA可促进诱导分化的小鼠3T3-L1前脂肪细胞向成熟脂肪细胞分化,并通过增加瘦素分泌和抑制脂联素的分泌发挥作用。这为阐明BPA促进肥胖及相关的代谢综合征发病机制提供了实验资料,但BPA促进脂肪细胞分化的分子机制还需深入研究。
[1] Ng M,Fleming T,Robinson M,et al.Global,regional,and na-tional prevalence of overweight and obesity in children and adults during 1980-2013:a systematic analysis for the Global Burden of Disease Study 2013[J].The Lancet,2014.
[2] Hectors T L,Vanparys C,Van Gaal L F,et al.Insulin resistance and environmental pollutants:experimental evidence and future perspectives[J].Environ Health Perspect,2013,121(11-12):1273-81.
[3] Decherf S,Demeneix B A.The obesogen hypothesis:a shift of focus from the periphery to the hypothalamus[J].J Toxicol Environ Health B Crit Rev,2011,14(5-7):423-48.
[4] LaKind J S,Goodman M,Mattison D R.Bisphenol A and indicators of obesity,glucose metabolism/type 2 diabetes and cardiovascular disease:a systematic review of epidemiologic research[J]. Crit Rev Toxicol,2014,44(2):121-50.
[5] Naciff J M,Khambatta Z S,Reichling T D,et al.The genomic response of Ishikawa cells to bisphenol A exposure is dose-and timedependent[J].Toxicology,2010,270(2-3):137-49.
[6] Vandenberg L N,Chahoud I,Heindel J J,et al.Urinary,circulating,and tissue biomonitoring studies indicate widespread exposure to bisphenol A[J].Cien Saude colet,2012,17(2):407-34.
[7] Benachour N,Aris A.Toxic effects of low doses of Bisphenol-A on human placental cells[J].Toxicol Appl Pharmacol,2009,241 (3):322-8.
[8] Boucher J G,Husain M,Rowan-Carroll A,et al.Identification of mechanisms of action of bisphenol a-induced human preadipocyte differentiation by transcriptional profiling[J].Obesity,2014,22 (11):2333-43.
[9] Nowak J Z.Anti-inflammatory pro-resolving derivatives of omega-3 and omega-6 polyunsaturated fatty acids[J].Postepy Hig Med Dosw(Online),2009,64:115-32.
[10]Valentino R,D'Esposito V,Passaretti F,et al.Bisphenol-A impairs insulinaction and up-regulates inflammatory pathways in human subcutaneous adipocytes and 3T3-L1 cells[J].PLoS One,2013,8(12):e82099.
[11]Weyer C,Funahashi T,Tanaka S,et al.Hypoadiponectinemia in obesity and type 2 diabetes:close association with insulin resistance and hyperinsulinemia[J].J Clin Endocrinol Metab,2001,86 (5):1930-5.
[12]Ben-Jonathan N,Hugo E R,Brandebourg T D.Effects of bisphenol A onadipokine release from human adipose tissue:Implications for the metabolic syndrome[J].Mol Cell Endocrinol,2009,304 (1-2):49-54.
Effects of bisphenol A on differentiation of mice 3T3-L1 preadipocytes
Leng Yinzhi,Li Yingpei,Luo Shimeng,et al
(Dept of Health Toxicology,School of Public Health,Anhui Medical University,Hefei230032)
Objective To explore the effect of bisphenol A(BPA)on the differentiation of mice 3T3-L1 preadipocytes in vitro.Methods Mice 3T3-L1 preadipocytes were stimulated for differentiation of mature adipocytes in vitro.Meanwhile cells were treated with 10,100 and 1 000 nmol/L BPA,blank control groups and vehicle control groups were established at the same time.On 2nd,4th and 8th day,the cell viability was measured by CCK8 assay. On 4th and 8th day,the lipid content of mice 3T3-L1 preadipocytes was determined by oil red O staining.On 2nd,4th and 8th day,the levels of leptin and adiponectin were analyzed by ELISA assay,the leptin and adiponectin mRNA in mice 3T3-L1 preadipocytes were measured by RT-PCR.Results On 2nd day,compared with the blank control,the cell viability was significantly increased in 1 000 nmol/L BPA groups(P<0.05);on 8th day,the cell viability was significantly inhibited in 10,100 and 1 000 nmol/L BPA groups(P<0.05,P<0.05,P<0.01).Red oil O staining showed that lipid droplets in intracellular was increased and became increasingly larger in dose and time dependent manner.On 4th day,leptin factor and leptin mRNA levels in 1 000 nmol/L BPA groups were elevated (P<0.05);on 8th day,leptin factor and leptin mRNA levels were all significantly elevated(P<0.01,P<0.01)in 100 and 1 000 nmol/L BPA groups.On 8th day,adiponectin factor and adiponectin mRNA were all suppressed (P<0.01,P<0.01)in 100 and 1 000 nmol/L BPA groups.Conclusion BPA accelerates differentiation of mice 3T3-L1 preadipocytes and interferes with the secretion of adipokines.
bisphenol A;mice 3T3-L1 preadipocytes;differentiation;leptin;adiponectin
R 114
A
1000-1492(2016)09-1281-05
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.022.html
2016-05-04接收
国家自然科学基金(编号:81473015)
安徽医科大学公共卫生学院1卫生毒理学系、3职业卫生 与环境卫生学系,合肥 2300322安徽医科大学第一附属医院临床营养科,合肥 230022
冷银芝,女,硕士研究生;沈 彤,男,副教授,硕士生导师,责任作者,E-mail:ahmusht@163.com

