IgG、IgM抗体在自身免疫性肝病的表达研究
方静怡 朱正鹏 李凯 罗锦 马建波 张睿 申丽娟
IgG、IgM抗体在自身免疫性肝病的表达研究
方静怡朱正鹏李凯罗锦马建波张睿申丽娟
目的研究原发性胆汁性肝硬化(PBC)及自身免疫性肝炎(AIH)的病理特点,寻找有效的病理诊断指标。方法选择2006年-2012年昆明医科大学病理教研室肝穿刺活检病例,从中筛选病理诊断为原发性胆汁性肝硬化(PBC)血清检测AMA-M2阳性病例30例、AMA-M2阴性病例17例和自身免疫性肝炎病例20例。采用免疫组化方法检测肝组织内IgG、IgM的表达情况。结果免疫组化检测显示IgM、IgG阳性颗粒主要分布于肝脏门管区浆细胞胞浆内,PBC AMA-M2阳性组、PBC AMA-M2阴性组、AIH组3组内IgM、IgG阳性细胞数相比差异均有统计学意义(P均<0.05)。PBC患者肝脏门管区浆细胞内主要表达IgM,AIH患者肝脏门管区浆细胞内主要表达IgG;PBC AMA-M2阳性组与AMA-M2阴性组相比,AMA-M2阳性的PBC患者肝脏门管区IgM、IgG表达阳性细胞数比AMA-M2阴性的PBC患者高,IgM、IgG阳性细胞数差异有统计学意义(P<0.05)。结论PBC患者肝脏门管区浆细胞内主要表达IgM,AIH患者肝脏门管区浆细胞内主要表达IgG,肝组织中IgM和IgG的检测及分析有助于PBC和AIH的诊断,且AMA-M2阳性的PBC患者肝脏门管区IgM、IgG阳性表达比AMA-M2阴性的PBC患者高。
PBC;AIH;IgG;IgM;病理
自身免疫性肝病(AILD)是一类以肝功能异常和肝脏病理损害为主要表现的非传染性肝病,包括AIH、PBC和原发性硬化性胆管炎(PSC)。随着医学科技的进步,诊断自身免疫性肝病的血清学、免疫学和影像学技术取得了显著进展,但大量实践证明,这些技术尚不能完全取代肝活体组织病理学技术,肝活体组织病理检查仍是诊断各种慢性肝损伤的重要依据。
资料和方法
一、病例资料
筛选2006年-2012年云南省昆明医科大学病理教研室肝穿刺活检病例,经昆明医科大学病理教研室2位教授统一阅片,病理确诊为PBC且血清检测AMA-M2阳性病例30例、AMA-M2阴性病例17例及AIH病例20例。
二、方法
免疫组化染色采用福州迈新公司MaxVisionTM法。具体参照说明书,石蜡切片脱蜡和水化后,PBS冲洗,抗原修复,孵育,DAB显色,中性树胶封固。鼠抗人IgG单克隆抗体、羊抗人IgM单克隆抗体购自北京中杉金桥生物制剂公司,其他免疫组化试剂均购自福州迈新公司。
计数肝组织门管区IgG、IgM阳性细胞数。
三、统计学处理

结 果
一、IgG、IgM免疫组化表达结果
免疫组化检测显示IgG和IgM 阳性均表达于浆细胞胞浆内,呈棕黄色。阳性表达细胞评估标准:肝组织中IgM、IgG的免疫组化检测结果按Daniels 等的计数法; 采用两台显微镜,分别对两组免疫组化显色的盲编切片同一区域选定的4 个完整门管区,高倍镜 (×400 )下对所有门管区内阳性表达浆细胞计数。PBC组门管区IgM阳性细胞数较多,AIH组门管区IgG阳性细胞数较多,3组内IgM、IgG的阳性细胞数详见表1。

图2 PBC AMA- M2阳性组 门管区浆细胞胞浆内IgM表达,呈棕褐色颗粒 MaxVisionTM法×400

图3 PBC AMA- M2阴性组 门管区浆细胞胞浆内IgG表达,呈棕褐色颗粒 MaxVisionTM法×400

图4 PBC AMA- M2阴性组 门管区浆细胞胞浆内IgM表达,呈棕褐色颗粒 MaxVisionTM法×400

图5 AIH组 门管区浆细胞胞浆内IgG表达,呈棕褐色颗粒MaxVisionTM法×400

图6 AIH组 门管区浆细胞胞浆内IgM表达,呈棕褐色颗粒MaxVisionTM法×400
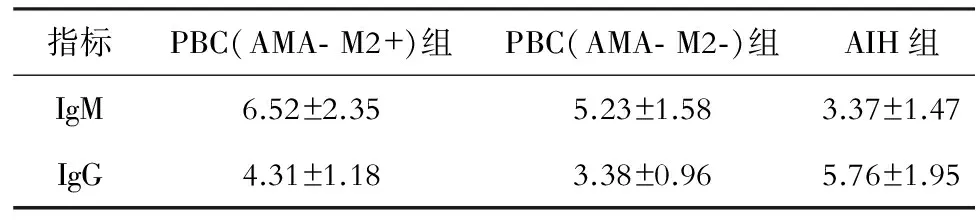
指标PBC(AMA⁃M2+)组PBC(AMA⁃M2⁃)组AIH组IgM6.52±2.355.23±1.583.37±1.47IgG4.31±1.183.38±0.965.76±1.95
注:PBC AMA- M2阳性组、AMA- M2阴性组及AIH组肝脏门管区IgG、IgM阳性细胞数两两比较,检验水准α=0.05,P<0.05,差异有统计学意义
讨 论
PBC与AIH同属自身免疫性肝病(AILD),AILD诊断通常需排除其他病毒感染,药物、酒精性肝病,非酒精性脂肪性肝病,遗传代谢障碍性疾病导致的肝脏损害,并结合临床表现及实验室检查进行综合判断。PBC是一种免疫介导,进展缓慢的胆汁淤积性肝病,常起病隐匿,晚期出现肝硬化症状后才能被识别,从而错过了最佳诊断及治疗时机[1-2]。PBC患者的血清生化学指标是以碱性磷酸酶(ALP)及谷氨酰转肽酶(GGT)升高为主的肝功能异常。PBC患者的血清免疫球蛋白中IgG和IgM升高,尤其IgM显著升高,提示有体液免疫参与。PBC病理改变主要以肝内细小胆管的慢性非化脓性破坏、门管区炎症、慢性胆汁淤积、肝纤维化为特征,最终发展为肝硬化和肝衰竭,甚至死亡[3]。临床及病理工作中,上述PBC的临床表现、实验室指标及病理特点并不总是显而易见,常常需要与其他因素所引起的肝病相鉴别,其中最重要的就是AIH。AIH是遗传易感性、机体自身免疫紊乱和环境因素共同作用的结果[4],起病方式呈多样性,多数隐匿起病,病程进展缓慢,若得不到及时有效的治疗,多数发展为肝硬化[5]。免疫学指标中以IgG及γ-球蛋白升高最常见,两者可作为诊断AIH的重要参考依据。AIH特征性的组织学改变是肝脏小叶界面炎症,汇管区有较明显的淋巴细胞及浆细胞浸润,损害一般不累及胆管系统[6]。PBC和AIH往往起病隐匿,临床表现不明显,病理特点不典型,比如PBC门管区的上皮性肉芽肿不是总能看到,而AIH的淋巴细胞性界面炎也是较晚期才能见到,因此容易延误最佳治疗时机,导致患者不可逆转的肝脏组织学损害。面临这两种疾病诊断和鉴别诊断所遇到的困难,促使一些学者对其他新检测技术进行了探讨。Moreira等[7]采用免疫组化方法对20例AIH病例肝组织中浆细胞内IgG及IgM的表达状况进行了研究,并与13例PBC的检测结果比较,通过对每例活检标本中IgG和IgM阳性浆细胞分别计数(个/mm2),发现92.3%的PBC主要为IgM,而90%的AIH患者肝组织门管区内浆细胞主要表达IgG。根据阳性表达细胞的计数比值(IgM/IgG<1或≥1),可以准确鉴别PBC和AIH,敏感性达到92.3%,特异性为90%,认为肝组织中IgM和IgG的检测及分析有助于PBC的诊断。本试验结果与Moreira等的试验结果较一致。无论是AMA-M2阳性的PBC患者还是AMA-M2阴性的PBC患者,肝脏门管区表达IgM的阳性细胞数较多,而AIH患者肝脏门管区表达IgG的阳性细胞数较多。因此可应用免疫组化法检测肝组织中IgM和IgG的阳性细胞数,对病理特点不典型或早期PBC和AIH加以鉴别,从而更早的选择正确的治疗方法,防止延误最佳治疗时机。
[1]Medina J,Jones EA, Garcia Monzon C, et al. Immunopathogenesis of cholestatic autoimmune liver diseases. Eur J Clin Invest, 2001, 31: 64-71.
[2]Heathcote EJ. Evidence-based therapy of primary biliary cirrhosis. Eur J Gastroenterol Hepatol, 1999, 11: 607-615.
[3]Kim KA, Jeong SH. The diagnosis and treatment of primary biliary cirrhosis. Korean J Hepatol,2011,17: 173-179.
[4]Muratori P, Muratori L, Gershw in ME, et al.True antimitochondrial antibody- negative primary biliary cirrhosis, low sensitivity of the routine assays, or both. Clin Exp Immunol, 2004, 135: 154-158.
[5]Nishio A, Van de Water J, Leung PS, et al. Comparative studies of antimitochondrial autoantibodies in sera and bile in primary biliary cirrhosis. Hepatology, 1997, 25: 1085 - 1089.
[6]潘敏鸿, 周晓军. 自身免疫性肝病的病理诊断.中华病理学杂志, 2007, 36: 772.
[7]Moreira RK,Revetta F,Koehler E,et al.Diagnostic utility of IgG and IgM immunohisto-chemistry in autoimmune liver disease .World J Gastroenterol,2010,16:453-457.
(本文编辑:易玲)
云南省科技厅—昆明医学院联合专项(2011FB242)
442008十堰湖北医药学院附属东风医院病理科(方静怡,朱正鹏,李凯,罗锦,马建波,张睿);昆明医科大学病理学与病理生理学教研室(申丽娟)
申丽娟,Email:shenljkm@163.com
2015-12-23)