一次性使用鼻饲管的生物相容性研究
高勇 李强 赵小磊 张娟丽
1 河南省食品药品审评查验中心 (郑州 450004) 2 河南省医疗器械检验所 (郑州 450003)
一次性使用鼻饲管的生物相容性研究
高勇1李强1赵小磊1张娟丽2
1 河南省食品药品审评查验中心(郑州450004)2 河南省医疗器械检验所(郑州450003)
内容提要: 一次性使用鼻饲管已经广泛应用于医疗机构,特别是对危重、昏迷病人维持生命、配合临床治疗起到了非常重要的作用。本研究参照“GB/T16886.1-2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》”,对一次性使用鼻饲管进行了体内外生物学评价。试验结果表明,一次性使用鼻饲管具有良好的生物相容性。
鼻饲管细胞毒性试验迟发型超敏反应试验
一次性使用鼻饲管在临床上的应用相当广泛,特别是对危重、昏迷、外科手术后病人,对维持病人营养、延长生命、配合临床治疗起到了至关重要的作用。因此,鼻饲管是否具有良好的生物相容性,对病人的生命安全会产生直接的影响。为了系统评估鼻饲管的生物相容性,我们参照了GB/T16886.1-2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》的要求[1~2],同时考虑了其制造材料聚氨酯本身的特点,以及与人体接触的时间和方式等特点,选取了体外细胞毒性试验、皮内反应和迟发型超敏反应试验等体内外生物学试验,对鼻饲管进行了系统的生物学评价。
1.试验材料
1.1试验样品
一次性使用鼻饲管以聚氨酯为原材料,分别来自厂家A和厂家B。
1.2试验试剂
小鼠成纤维细胞L-929(购自中国科学院上海生命科学研究院细胞库),胎牛血清(赛默飞世尔生物化学制品有限公司),胰蛋白酶(Thermo),MTT溶液(Sigma公司),RPMI1640培养基(赛默飞世尔生物化学制品有限公司),完全弗氏佐剂(Sigma公司),植物油(天津嘉里粮油工业有限公司),雄性豚鼠(山东鲁抗医药股份有限公司,合格证号:0021950),日本大耳白(山东鲁抗医药股份有限公司,合格证号:37005400000006)。
2.样品制备[3]
2.1细胞毒性试验
在无菌条件下,以0.2g/mL的浸提比例,称取鼻饲管4g,然后加入含10%胎牛血清的RPMI1640培养液20mL,放置于37°C的CO2细胞培养箱中孵育24h。阳性对照用5%二甲基亚砜(DMSO),阴性对照材料用高密度聚乙烯,称取高密度聚乙烯4g,按0.2g/mL的浸提比例加入含10%胎牛血清的RPMI1640培养基20mL,置于37°C培养箱孵育24 h。
2.2皮内反应试验
参考国标GB/T16886.12-2005的要求,浸提介质为0.9%的氯化钠注射液,以0.2g/mL的浸提比例,称取鼻饲管4g,然后加入0.9%的氯化钠注射液20mL,密封后,放入70°C恒温箱中浸提24h。植物油浸提液制备方法与0.9%的氯化钠注射液浸提液的制备方法相同。分别取对照液0.9%氯化钠注射液和植物油10mL,70°C恒温箱中放置24h。
2.3迟发型超敏反应最大剂量试验
浸提方法同皮内反应试验,皮内诱导阶段试剂的配置,注射弗氏完全佐剂与生理盐水以50:50(体积比)比例混合的稳定性乳化剂,试验样品液以50:50的体积比例与稳定性乳化剂混合后进行皮内注射。
3.试验方法
3.1细胞毒性试验
将生长旺盛的小鼠成纤维细胞L929,用胰蛋白酶消化成细胞悬液后,调节细胞密度至1×104个细胞/mL,将配置好的细胞悬液接种于96孔培养板,分别设空白对照组、阴性对照组、阳性对照组和供试品组。每组各设6孔,每孔接种100µL细胞悬液,然后将96孔板放置于37°C5%CO2培养箱中培养24h,弃去原培养液。空白对照组加入新鲜的RPMI1640培养液,阴性对照组加入高密度聚乙烯(HDPE)浸提液,阳性对照组用5%DMSO溶液。供试品组加入样品浸提液,每孔100μL,置于37°C5%CO2培养箱中继续培养72h。更换培养液72h后,将96孔板放置于倒置显微镜下观察细胞形态,然后每孔加入质量浓度为5g/L的MTT溶液20µL,然后放入37°C5%CO2培养箱继续培养4h后,弃去孔内液体,每孔加入150µLDMSO,置振荡器上振荡10min,在酶标仪570nm和630nm波长下测定吸光度OD值,计算相对增殖率(relative growth rate,RGR,RGR=实验组OD值/空白对照组OD值×100%)[4]。
3.2皮内反应试验
日本大耳白兔6只,试验前4h~18h的,彻底除去动物背部脊柱两侧被毛,然后用75%的酒精消毒皮肤暴露区域,在每只兔脊柱一侧的5个点皮内注射0.2mL生理盐水制备的样品浸提液,每注射点间隔2cm,后5个点注射生理盐水对照液。在每只兔的脊柱另一侧注射植物油制备的样品浸提液和植物油对照液,操作步骤同上。注射后在24h、48h、72h观察记录各注射部位状况,按标准给出的记分系统对每一观察期各注射部位的红斑和水肿的组织反应评分,并记录试验结果。在72h评分后,分别将每一试验样品和溶剂对照的全部红斑与水肿记分相加,再除以18[3(动物数)×3(观察期)×2(记分类型)],计算出每一试验样品和每一对应溶剂对照的综合平均记分[5]。
3.3迟发型超敏反应最大剂量试验
取豚鼠25只,分成三组,分别是试验样品组A、B和对照组,试验样品组A、B各10只豚鼠,对照组5只豚鼠。皮内诱导阶段:每只豚鼠在约2 cm×4 cm剪毛区内注射3排(每排注射2个点)。第1排皮内注射弗氏完全佐剂与生理盐水以50:50(体积比)比例混合的稳定性乳化剂。第2排皮内注射试验样品浸提液,对照组只注射生理盐水。第3排样品浸提液以50:50的体积比例与弗氏完全佐剂和生理盐水配制成的稳定性乳化剂混合后进行皮内注射,对照组注射生理盐水与佐剂配制成的乳化剂。局部诱导阶段后7d,试验区用10%的十二烷基硫酸钠进行预处理,按摩导入皮肤,采用面积约8cm2的敷贴片浸透样品浸提液后,局部贴敷于每只动物的肩胛骨内侧部位,覆盖诱导注射点。用封闭式包扎带固定滤纸片,并于48h±2h后除去包扎带和敷贴片。对照组使用生理盐水同法操作。激发阶段:局部诱导阶段后14 d(±1d),用试验样品激发全部试验动物和对照动物,将适宜的敷贴片置于试验样品或生理盐水中浸透,局部贴敷于诱导阶段未试验的每只动物的上腹部。用封闭式包扎带固定,并于24h±2h后除去包扎带和敷贴片。除去敷贴片后24h和48h后,观察试验组和对照组动物激发部位皮肤情况。按Magnusson和Kligman分级标准对每一激发部位和每一观察时间皮肤红斑和水肿反应进行描述并分级[5]。
3.4统计学处理
实验组数据以x±s表示,组间比较采用t检验。
4.试验结果
4.1细胞毒性试验(MTT比色法)
在倒置显微镜下观察,空白对照组、阴性对照组及试验样品组A、B的细胞贴壁生长良好,细胞呈梭形或不规则三角形;而阳性对照组细胞贴壁很少,死亡细胞较多。试验结果显示来自厂家A和B的鼻饲管的细胞毒性均为1级。见表1。
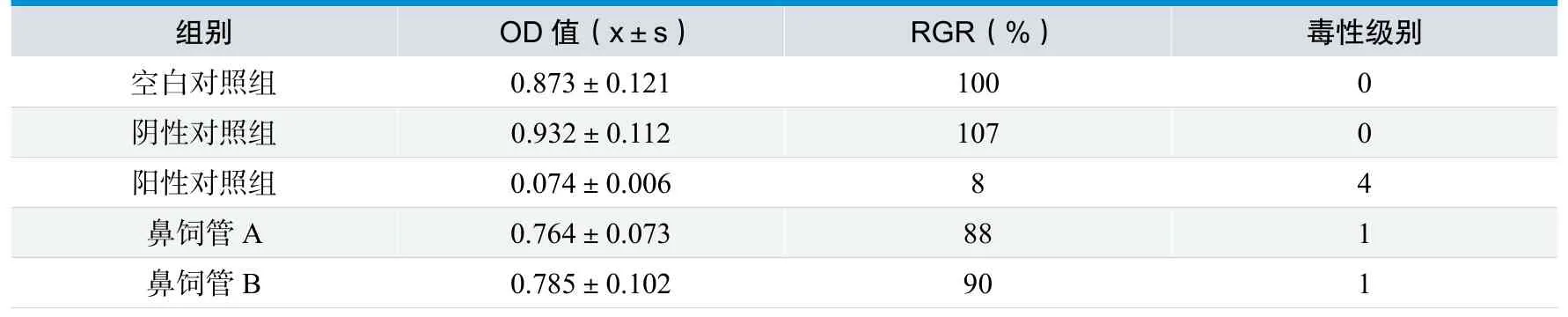
表1.试验样品的细胞相对增值率
4.2皮内反应试验
试验样品A、B组:生理盐水浸提液与生理盐水对照平均记分之差均为0;植物油浸提液与植物油对照平均记分之差也均<1.0(A为0.2,B为0)。所以在本试验条件下,试验样品浸提液A、B对皮肤无刺激作用。
4.3迟发型超敏反应试验
对照组动物记分均为0,试验组A、B动物记分均为0,所以,在本试验条件下,试验样品浸提液A、B对豚鼠无迟发型致敏作用。
5.讨论
一次性使用鼻饲管在临床使用中直接与鼻腔粘膜、食管粘膜以及胃粘膜直接接触,因此,细胞形态和数量的变化能够最直接地反应鼻饲管材料对细胞增值及代谢功能的影响。实验结果表明,鼻饲管A、B的细胞毒性均为1级,皮内反应试验、迟发性超敏反应试验未发现异常,通过生物学评价试验(体外细胞毒性试验、刺激以及迟发型致敏试验)的结果分析,以聚氨酯为原材料的鼻饲管具有良好的生物相容性。
[1]国家药品监督管理局.GB/T16886.1-2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》[S].北京:中国标准出版出,2011.
[2]奚廷斐.医疗器械生物学评价[J].中国医疗器械信息,1999,5(3):4-9.
[3]国家药品监督管理局.GB/T16886.12-2005《医疗器械生物学评价第12部分:样品制备与参照样品》[S].北京:中国标准出版社,2005.
[4]国家药品监督管理局.GB/T14233.2-2005《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》[S].北京:中国标准出版社,2005.
[5]国家药品监督管理局.GB/T16886.10-2005《医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验》[S].北京:中国标准出版社,2005.
Study of Biocompatibility of Sterile Disposable Nasal Feeding Tubes
GAO Yong1LI Qiang1ZHAO Xiao-lei1ZHANG Juan-li2
1 Henan Provincial Food and Drug Evaluation and Inspection Center(Zhengzhou450004)2 Medical Instrument Testing Institute of Henan(Zhengzhou450003)
Sterile disposable nasal feeding tubes are widely used in medical institutions, so it is very important to sustain life and support clinical treatment for critical and narcose patients especially. In the study,according to GB/T16886.1-2011 Biological evaluation of medical devices-Part 1:Evaluation and testing within a risk management process, we evaluate its biological evaluation in vitro and vivo. The results show that sterile disposable nasal feeding tubes have good biocompatibility.
nasal feeding tube, cytotoxicity,delayed-type hypersensitivity
1006-6586(2016)10-0065-03
R318.08
A
2016-09-01
高勇,工程师,研究方向:医疗器械检测、技术审评。

