胶原和壳聚糖复合材料在组织工程支架中的应用
林红赛 黄永富 岳卫华 王春仁
1 北京市医疗器械检验所 (北京 101111) 2 中国食品药品检定研究院 (北京 100050)
胶原和壳聚糖复合材料在组织工程支架中的应用
林红赛1黄永富1岳卫华1王春仁2
1 北京市医疗器械检验所(北京101111)2 中国食品药品检定研究院(北京100050)
内容提要: 本文综述了胶原和壳聚糖复合材料作为组织工程支架在皮肤修复、角膜修复和骨修复等方面的应用进展,表明胶原和壳聚糖复合材料已经成为上述各个组织工程领域支架材料的研究热点,但是胶原蛋白-壳聚糖复合材料不是万能的,根据不同的用途,可能要加入一些其他的材料与其共混,以更好的符合不同目标组织的需求。
组织工程支架胶原壳聚糖复合材料
0.引言
组织工程是指应用生命科学与工程的原理及方法构建一个生物装置来维护和增进人体细胞和组织的生长,以恢复、维持或提高受损组织或器官的功能[1]。组织工程研究包括种子细胞、组织工程支架和生长因子微环境三方面,其中组织工程支架是组织工程研究的重点之一,它为细胞的粘附和生长提供空间和有效的物理支撑,并决定着目标组织或器官的结构和形状。构成组织工程支架的材料种类繁多,包括天然材料和合成材料两大类,其中壳聚糖和胶原属于应用非常广泛的两种天然材料,壳聚糖和胶原在创伤科、角膜修复科和骨科等领域广为应用。本文就胶原和壳聚糖在组织工程中应用的优缺点和两种材料复合后在组织工程支架中的应用进展作一综述。
1.胶原和壳聚糖复合材料
胶原是一种天然纤维蛋白,占人体或其他动物总蛋白含量的25%~33%,广泛存在于动物的皮肤、骨、肌腱韧带和角膜等组织中,是动物体内含量最丰富的蛋白质。由于胶原具有低免疫原性、可生物降解性以及良好的生物相容性等特点使得其作为构建活性组织工程支架的应用十分广泛。但是,胶原机械性能和抗水性能差,在体内降解时受局部因素的影响大,降解速度可控性不如人工合成多聚物,单独用作基质材料尚难以达到理想的要求[2]。
壳聚糖是甲壳素的部分或全部脱乙酰基的产物,为自然界中唯一的碱性多糖。这种天然高分子化合物,因其低抗原性、可生物降解性、良好的生物相容性及降解产物安全无毒,具有广泛的抗菌、止血、止痛作用。同时还具有选择性促进表皮细胞生长的独特的生物活性,在生物材料方面的应用受到广泛关注[3~5]。但是,目前壳聚糖支架材料也存在缺点,如溶解性不好、降解速率与新生组织的生成速率匹配性不佳,材料缺乏表面特异性等。
因此,单一的胶原和壳聚糖由于各自的缺点限制了其在组织工程领域的应用。有研究表明,充分利用两种材料的优缺点,将胶原与壳聚糖复合后能产生协同效应。早在2001年,tan等[6]对复合胶原-壳聚糖基质做了物理和细胞学的相关实验检测,表明复合胶原和壳聚糖基质就其生物学和机械特性,有作为一种细胞支架的潜力。不少学者发现,胶原和壳聚糖在分子级都是相容的,两者之间具有较强的相互作用,不同比例的胶原和壳聚糖复合可以得到不同应用的组织工程支架材料,且该复合材料具有良好的生物安全性,对机体无毒,不致突变,对细胞有较强的亲和作用,利于细胞生长和分化[7~9]。近年来有报道以胶原-壳聚糖共混膜为基质用于上皮细胞的体外培养[10],或将胶原-壳聚糖加工成多孔支架材料用于真皮成纤维细胞的体外培养[11],亦有对胶原-壳聚糖共混物相互作用的机理及性能方面的研究报道[12~14]。因此,胶原-壳聚糖复合材料在组织工程各个领域应用研究备受学者青睐。
2.在组织工程中的应用进展
2.1组织工程皮肤修复材料
组织工程皮肤是利用组织工程技术,在组织工程支架材料上复合种子细胞,从而构建出用于修复、维护和改善损伤皮肤组织、功能和形态的皮肤替代物。理想的组织工程支架材料不仅要有利于种子细胞的增殖、分化,而且也能与机体很好的结合并发挥相应的功能作用。胶原蛋白-壳聚糖复合材料由于具有适宜的三维多孔结构,有利于细胞的增殖分化等,在组织工程皮肤支架材料方面已得到了广泛的应用。
余丕军[15]等发现,胶原蛋白-壳聚糖(80:20)复合纳米纤维膜具有优异的生物力学性能、生物相容性和生物可降解性。用胶原蛋白-壳聚糖(80:20)复合纳米纤维膜覆盖SD大鼠背部全层皮肤缺损创面后并打包固定,修复14天后创面已基本对合、干痂,且与普通纱布敷料覆盖创面实验组相比,胶原蛋白-壳聚糖复合纳米纤维膜能更好的促进创伤修复、愈合。黄爱宾等[16]研制了一种胶原-磺化羧甲基壳聚糖/硅橡胶皮肤再生材料,并以小型猪为模型,考察了其对烫伤全层皮肤缺损的修复性能,结果发现,该皮肤再生材料具有更快的血管化性能,且经该材料处理的创面能有效支持薄自体皮片的移植成活,实现深度烫伤创面的全层修复。王新刚等[17]构建一种含有PLGA编织网/胶原-壳聚糖复合支架(PCCS)的连续性真皮再生模板,植入大鼠皮下观察,结果发现,连续性真皮再生模板具有优良的机械性能,合适的三维多孔结构和快速诱导组织、细胞及血管长入的潜能,作为真皮替代物具有一定的应用前景。Gingras等[18]将人成纤维细胞和角质形成细胞接种于胶原-壳聚糖海绵上,体外培养31天后植入裸鼠背部,移植60天后可观察到皮肤神经的生长,表明三维结构的胶原-壳聚糖海绵可促进皮肤神经的生长,有望成为组织工程皮肤支架材料。Ma等[11]采用冷冻干燥法制备得到胶原和壳聚糖支架,并经过戊二醛交联,体外培养人皮肤成纤维细胞的实验和体内动物实验都表明,胶原和壳聚糖支架可以保持胶原蛋白原有良好的细胞相容性,并有效地促进细胞的浸润和增殖,可作为真皮替代物研究。
2.2组织工程角膜修复材料
近年来,角膜组织工程的兴起为组织工程人角膜和组织工程人角膜基质的体外重建以及患者通过临床角膜移植重建光明带来了新的希望[19~20]。在运用组织工程技术构建组织工程角膜时,支架材料的选择成了制约组织工程角膜构建的重要环节。目前,用于构建组织工程角膜的支架材料主要有胶原、壳聚糖、异种角膜基质等天然材料,此外,还包括一些人工合成材料和复合材料等。复合的胶原和壳聚糖支架与其他组织工程支架材料相比,在可降解性、免疫原性、安全性、生物相容性等方面具有较明显的优势。
贾卉等[21]探讨以胶原-壳聚糖为生物支架构建角膜基质细胞复合膜及其生物相容性,采用活体前节OCT、Cs-4检查和离体组织学及免疫组化观察结果显示,兔和人角膜基质细胞在胶原-壳聚糖共混膜上生长良好,移植后复合膜逐渐发生降解,角膜组织未发生坏死和溶解,角膜上皮、基质和内皮细胞形态结构正常,认为胶原-壳聚糖可作为角膜基质构建的生物支架。王迎军等[22]发现,人角膜缘上皮细胞能在支架上较好地粘附和增殖分化,显示复合膜支架具有良好的细胞亲和性,认为壳聚糖-胶原复合膜有望成为一种性能良好的角膜组织工程支架。丁勇等[23]探讨了壳聚糖-胶原共混膜作为载体体外培养兔角膜基质细胞的可行性,结果发现传代细胞具有角膜基质细胞的生物特性,壳聚糖-胶原共混膜适合角膜基质细胞传代培养。侯江平等[24]研究了壳聚糖-胶原复合膜植入角膜内不同部位的生物相容性,分别在兔角膜周边基质层和中央基质层间植入,不同时间取出做组织切片观察,植入兔角膜中央基质层的早期眼表稳定,但是两周过后伴随着材料的缓慢降解,材料周边变得不透明,伴随着炎症细胞浸润,最终完全溶解;植入角膜周边基质层间后在短时间内能完全降解,适宜作为角膜修复材料,特别是作为角膜缘干细胞的载体,可以用来修复角膜缘干细胞损伤引起的角膜疾病。
2.3组织工程骨修复材料
自体骨移植被认为是骨缺损修复的金标准,但由于来源有限而受到限制,近年来,组织工程学的兴起使得骨缺损修复有了新的治疗可能。如羟基磷灰石和生物陶瓷灯无机成分等可以作为骨的替代物,但这些无机成分与人体组织有一定的差别,故不少学者将目光转向了与人体组织更接近的胶原和壳聚糖等有机成分的材料。很多研究表明,胶原和壳聚糖复合支架材料可为细胞提供吸附和生长的空间,有望成为骨修复的新型材料[25~26]。
单程等[27]采用先后于-20°C和液氮中冷冻的预冻方式,冷冻干燥法制备胶原-壳聚糖双层仿生支架,对比了纯壳聚糖支架、纯胶原支架、胶原壳聚糖复合材料单层支架和仿生多层支架的力学性能。结果胶原和壳聚糖的复合存在化学反应,复合材料可以形成更好的多孔结构,仿生多层支架从上至下分别具有致密层结构,圆形孔结构和垂直孔结构,仿生多层软骨支架的结构接近于天然关节软骨多层结构,有望更好地维持软骨细胞表型和提高软骨损伤修复效果。初殿伟等[28]构建兔骨髓间充质干细胞/壳聚糖-胶原支架复合体,探讨该支架作为软骨组织工程支架的可行性。将第3代兔骨髓间充质干细胞接种于支架内,构建细胞/支架复合体,细胞/支架共培养24h、48和72 h后,骨髓间充质干细胞可渗入支架多孔结构内,并黏附在支架上成簇生长,部分细胞已与支架融合,证明壳聚糖-胶原支架基本符合软骨组织工程支架要求,能够作为种子细胞的承载体。于洪宇等[29]建立了壳聚糖-胶原蛋白支架材料结合干细胞诱导分化移植给动物模型,观察了壳聚糖-胶原凝胶复合骨髓间充质干细胞修复兔关节软骨缺损的组织学变化,结果发现,大部分软骨缺损区被新生软骨修复,提示应用骨髓间充质干细胞结合壳聚糖-胶原蛋白复合物可以修复关节软骨缺损。Shi等[30]采用冻干法,将Ⅰ型胶原蛋白和脱乙酰度为88%的壳聚糖制备成海绵状多孔三维支架,该支架具有良好的孔洞结构,交联后力学强度也得到了明显的提高。皮下种植试验证明其生物相容性和可降解性良好,体外培养软骨细胞和支架复合物,发现支架促进了软骨细胞的增殖、分化并维持其表型。
2.4其他应用
胶原-壳聚糖复合支架在组织工程支架领域还有很多其他方面的应用,如有诸多在心脏瓣膜、周围神经、牙周组织工程等领域[31~33]的应用研究。付建华等[34]探讨应用骨髓基质干细胞诱导分化的内皮细胞为种子细胞,胶原-壳聚糖复合物为支架材料,运用组织工程学的原理和方法体外构建组织工程心脏瓣膜的可行性,结果表明,以兔主动脉壁体外分离、培养、传代的平滑肌细胞、成纤维细胞和BMSCs诱导分化的内皮细胞为种子细胞,依次种植在胶原-壳聚糖复合支架上,可以构建组织工程心脏瓣膜。Sang等[35]采用制备了含肉桂酸酯海藻酸钠的胶原-壳聚糖神经导管,植入大鼠12周后,神经导管可连接大鼠坐骨神经的间隙,可用于周围神经再生。Shi等[36]研制了壳聚糖-胶原复合TGF-β微球的复合支架,体外细胞培养后,通过MTT检测细胞增殖,共聚焦显微镜观察细胞三维生长,发现支架可以促进细胞的生长,对促进牙周组织再生具有可行性。何晓宁等[37]将体外培养牙周韧带细胞接种于壳聚糖胶原支架上,结果发现该支架可以作为牙周韧带细胞的载体,对牙周韧带细胞的粘附、增殖及细胞外基质的合成均有较好地促进作用。
3.面临的问题
尽管胶原-壳聚糖支架材料在组织工程中的应用非常广泛,但大部分还处于研究阶段,且对用于组织工程的胶原-壳聚糖支架材料的研究仍不够全面,支架材料仍然存在许多缺点。如力学强度有限、降解速率与新生组织的生成速率匹配性不佳、材料与宿主的整合性差、材料缺乏表面特异性等。因此,胶原蛋白-壳聚糖复合材料不是万能的,根据不同的用途,可能要加入一些其他的材料与其共混,以更好的符合不同目标组织的需求。此外,就两者共混比例而言,不同的用途其混合比例也有差别,且多数研究结果离临床应用尚有一定的距离,这仍然需要更多的组织工程研究者共同努力来解决。
[1] R Langer. Tissue engineering [J]. Science, 1993, 260(5110): 920-926
[2] Darko Bosnakovski, M Mizuno, G Kim, et al. Chondrogenic differentiation of bovine bone marrow mesenchymal stem cells (MSCs) in different hydrogels: Influence of collagen type II extracellular matrix on MSC chondrogenesis [J].Biotechnology & Bioengineering, 2006, 93(6):1152-1163
[3] S Dhivya, S Saravanan, TP Sastry, et al. Nanohydroxyapatite-reinforced chitosan composite hydrogel for bone tissue repair in vitro and in vivo [J]. Journal of Nanobiotechnology, 2015, 13(1):1-13
[4] F Oprenyeszk, C Sanchez, JE Dubuc, et al. Chitosan enriched three-dimensional matrix reduces inflammatory and catabolic mediators production by human chondrocytes [J]. Plos On, 2015, 10(5): e0128362
[5] HE Ying, X Liu, XY Tang, et al. In vitro study of electrospun polycaprolactone/chitosan nano fiber membrane guided bone regeneration [J]. Shanghai journal of stomatology, 2015, 24(2):129-134
[6] Tan W, Krishnaraj R, Desai TA. Evaluation of nanostructured composite collagen--chitosan matrices for tissue engineering[J].Tissue Engineering, 2001, 7(2):203-210
[7] 王九辉,未东兴,张震. 不同比例壳聚糖胶原复合骨、软骨缺损支架材料的制备及性状比较 [J].中国组织工程研究与临床康复, 2010, 14(42):7811-7814
[8] 龚忠诚,龙星,魏丽丽等. 壳聚糖/Ⅰ型胶原复合支架与滑膜成纤维样细胞构建颞下颌关节盘的研究[J].中华实验外科杂志, 2010, 27(8):1165-1168
[9]邱长虹,翟弘峰,姜华等. 胶原-壳聚糖复合材料的制备及生物安全性检测[J].中国组织工程研究与临床康复,2007, 11(18):3532-3535
[10] N Shanmugasundaram, P Ravichandran, PN Reddy, et al. Collagen-chitosan polymeric scaffolds for the in vitro culture of human epidermoid carcinoma cells [J]. Biomaterials, 2001, 22(14):1943-1951
[11] L Ma, C Gao, Z Mao, J Zhou. Collagen/chitosan porous scaffolds with improved biostability for skin tissue engineering [J]. Biomaterials, 2003, 24(26):4833-4841
[12] A Sionkowska, M Wisniewski, J Skopinska, et al.. Molecular interactions in collagen and chitosan blends [J]. Biomaterials,2004, 25(5):795-801
[13] MN Taravel, A Domard. Collagen and its interactions with chitosan: III. Some biological and mechanical properties [J]. Biomaterials, 1996, 17(4):451-455
[14] CA Acevedo, P Díazcalderón, D López, et al. Assessment of gelatin-chitosan interactions in films by a chemometrics approach [J]. CyTA - Journal of Food, 2015, 13(2):227-234
[15] 余丕军,王露萍,郭妤等. 胶原蛋白-壳聚糖复合纳米纤维膜用于皮肤缺损的修复[J].中国组织工程研究与临床康复, 2011年51期
[16] 黄爱宾, 郭瑞, 徐少骏等. 胶原-磺化羧甲基壳聚糖/硅橡胶皮肤再生材料的制备及其对小型猪烫伤创面全层皮肤缺损的修复研究[J].高分子学报, 2009, 1(2):111-117
[17] 王新刚, 有传刚, 孙华凤等. 聚乳酸-羟基乙酸编织网/胶原-壳聚糖真皮替代物的设计及生物学性能初步评价[J].中华烧伤杂志, 2011, 27(1):16-20
[18] M Gingras, I Paradis, F Berthod. Nerve regeneration in a collagen-chitosan tissue-engineered skin transplanted on nude mice [J]. Biomaterials, 2003, 24(9):1653-1661
[19] X Li, Y Yang, Q Li, et al. Morphologic characteristics and proliferation of rabbit corneal stromal cells onto complexes of collagen-chitosan-sodium hyaluronate under simulatedmicrogravity [J].Investigative Ophthalmology & Visual Science,2013, 54(10):6877-6888
[20] H Jia, J Wang, HU Yuan, et al. Construction of compound membrane with corneal stromal cells and collagen-chitosan and its biocompatibility [J]. Journal of Jilin University, 2009, 35(3):440-443
[21] 贾卉, 王娇, 胡源. 胶原-壳聚糖和角膜基质细胞复合膜的构建及其生物相容性 [J].吉林大学学报:医学版, 2009,35(3):440-443
[22] 王迎军, 赵晓飞, 卢玲等.角膜组织工程支架壳聚糖-胶原复合膜的性能.华南理工大学学报:自然科学版, 2006,34(8):1-5
[23] 丁勇, 徐锦堂, 陈建苏等.兔角膜基质细胞在壳聚糖胶原共混膜体外培养研究.眼科新进展, 2004, 24(2):88-90
[24] 侯江平, 李国星, 李玉莉等. 角膜内不同部位植入壳聚糖-胶原复合膜的生物相容性[J].中国组织工程研究与临床康复, 2010, 14(34):6319-6322
[25] MV Zugravu, RA Smith, BT Reves, et al. Physical properties and in vitro evaluation of collagen-chitosan-calcium phosphate microparticle-based scaffolds for bone tissue regeneration [J]. Journal of Biomaterials Applications, 2013,28(4):566-579
[26] XL Wang, XD Li, XM Wang, et al. Investigation of a Collagen-Chitosan-Hydroxyapatite System for Novel Bone Substitutes [J]. Key Engineering Materials, 2007, 330-332:415-418
[27] 单程, 孙晓丹, 战景林. 胶原-壳聚糖制备仿生多层结构软骨支架 [J]. 医用生物力学, 2010, 25(1):26-31
[28] 初殿伟, 王玮, 陈立军等. 兔骨髓间充质干细胞/壳聚糖-胶原支架复合体构建软骨组织工程支架[J].中国组织工程研究与临床康复, 2009, 13(42):8248-8252
[29] 于洪宇, 马春雨. 壳聚糖-胶原凝胶复合骨髓间充质干细胞修复兔关节软骨缺损的组织学变化[J].中国组织工程研究与临床康复, 2010, 14(25):4581-4584
[30] DH Shi, DZ Cai, CR Zhou, et al. Development and potential of a biomimetic chitosan/type Ⅱcollagen scaffold for cartilage tissue engineering [J].Chinese Medical Journal, 2005, 118(17):1436-1443
[31] Steinhoff G, Stock U, Karim N, et al. Tissue engineering of pulmonary heart valves on allogenic acellular matrix conduits: in vivo restoration of valve tissue [J]. Circulation, 2000, 102(3):50-55
[32] M Patel, PJ Vandevord, HW Matthew, et al. Collagen-chitosan nerve guides for peripheral nerve repair: a histomorphometric study [J].Journal of Biomaterials Applications, 2008, 23(2):101-121
[33] A Shrestha, S Friedman, A Kishen. Photodynamically crosslinked and chitosan-incorporated dentin collagen [J].Journal of Dental Research, 2011, 90(11):1346-1351
[34] 付建华, 赵曼, 杜桂英等. 应用骨髓干细胞和自制胶原-壳聚糖构建组织工程心瓣膜[J].第三军医大学学报, 2011,33(2):152-155
[35] WK Sang, KB Hong, HS Nam, et al. Peripheral Nerve Regeneration Through Nerve Conduit Composed of Alginate-Collagen-Chitosan [J].Macromolecular Research, 2006, 14(6):673-673
[36] SS Shi, JW Yao, DO Prosthodontics, et al. Preparation of TGF-βMicrospheres Loaded Chitosan/collagen Scaffold and a Pilot Study for the Scaffold Application to Periodontal Ligament Regeneration [J]. Journal of Oral Science Research, 2014
[37] 何晓宁, 程祥荣, 彭琳等. 人牙周韧带细胞与壳聚糖-胶原支架体外培养的实验研究[J].口腔医学研究,2008,24(4):399-401
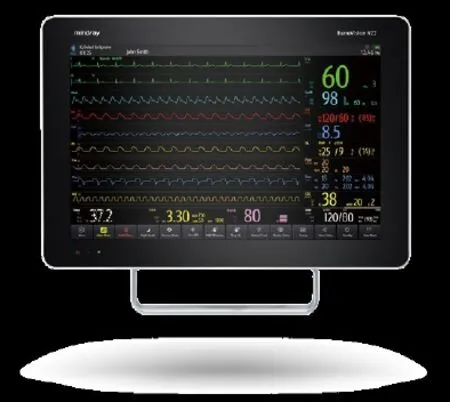
迈瑞BeneVision N22/19
迈瑞N系列为世界第一台可旋转屏幕的新一代“智”监护工作站,既能满足竖屏下较大的监测值显示,又兼顾了横屏下展现更长的波形,医生可根据临床需要纵横选择,观察便捷;具有屏幕大、参数多,“瑞智库、瑞智简、瑞智联”的高端技术特色,引领信息时代监护仪的发展潮流。
瑞智库:汇聚全球顶尖专家的临床经验的智慧库,能够将ECG、SPO2、IBP等同源信号融汇起来,模仿人的思考方法进行智能分析,从而大幅提升监测准确度,减少误报警。 可实时关注病人病情变化,早期识别临床风险,给予临床诊断的决策支持。监测参数多,除基本全命体征参数监测外,N 系列在血流动力学、氧供氧耗、镇静与意识、气体等方面都提供了完善的监测解决方案,通过这些先进的监测技术,使诊疗更加准确、可靠。
瑞智简:可以根据临床场景,自动识别显示参数,尽而减少医护人员的干预;人机交互设计直观便捷,易学易用,图形化指引,90% 的操作可2 步完成。另外,还可自动分配界面空间,让参数和波形充满,参数显示更清晰。当有故障出现时,图形化提示可让护士很快找到问题点,并指引解决。同时,还集成了一套指引系统,查询方便快捷。
瑞智联:集成IT 先进技术,N 系列监护仪可实现智能化的无限联接。可智联TM80 穿戴式监护仪、并且智联T1监护仪可轻易实现无线遥测和转运功能,方便患者自由行走监测;可整合各种床旁设备,实现中央监护集中管理。
迈瑞CAL 8000 2.0
相比1.0 版血液分析流水线, 2.0 版血液分析流水线发生了由内而外、脱胎换骨的变化。CAL 8000 2.0 新增流水线专属高速CRP 模块CRP-M100、糖化血红蛋白分析模块H50,其中CRP 与血球流水线的结合为国内外首创。迈瑞立足中国市场,在成功推出BC- 5390CRP 这款血常规+CRP 一体机之后,迅速响应高端客户高速CRP 检测的需求,CRP-M100 将CRP 的检测速度提升到了100 样本/ 小时;糖化血红蛋白分析仪H50 的检测速度也达到了50 样本/ 小时,因此,使用迈瑞CAL 8000 2.0 血液分析流水线只需一管血就可以实现血常规+CRP+ 糖化血红蛋白的检测,对客户来说获得了更高效的解决方案。

迈瑞Resona 7
Resona 7是迈瑞基于域扫描成像技术的创新思想,联合ZONARE 的顶尖科学家和工程技术专家,历时两年多倾力打造的高端彩超。
Resona 7全新的域光平台,突破了传统超声成像平台的技术限制,通过创新性的四大成像技术,实现了同步提高空间、时间、组织均匀性的超声图像需求。在增强医生诊断信心的同时提高了工作效率,代表了超声成像技术未来的发展方向。高端功能为临床医生带来全新的诊断体验, 如迈瑞为产科筛查而独创的产科自动容积导航Smart Planes 专利技术,首次推出了“一键式胎儿颅脑自动筛查解决方 案”,为超声在颅脑的筛查带来了全新的诊断工具。 同时Resona 7 创新的超宽带非线性基波造影成像、V Flow 向量血流、STE 弹性成像技术等,给临床提供更多的定量信息, 呈现出卓越的图像表现。

迈瑞化学发光骨代谢免疫检测套餐
迈瑞化学发光骨代谢免疫检测套餐,覆盖维生素D,PTH,CT,以国际溯源参考方法为量值基础,实现18分钟高速结果回报,第二代PTH抗体设计,最长56天在机稳定性满足各级临床终端的使用需求,骨代谢三项对高低钙血症,骨质疏松、佝偻病、软骨病、慢性肾病、甲状旁腺疾病、骨髓瘤、甲状腺癌等具备高度特异性。迈瑞化学发光传染病免疫检测套餐,覆盖术前八项测试,以国际溯源参考体系为量值基础,实现乙肝定量跟踪,覆盖灰区样本研究,重点关注突变株和变异株检测,通过德国法兰克福血站CE标准检测满足临床检测需求,HIV第四代试剂全国CDC考评,灵敏度和特异性获得最佳结果。
Application of Collagen and Chitosan Composites in Tissue Engineering Scaffold
LIN hong-sai1HUANG yong-fu1YUE wei-hua1WANG chun-ren2
1 Beijing institute of medical device testing(Beijing101111)2 National institutes for food and drug control(Beijing100050)
A review about application of collagen and chitosan composite as a tissue engineering scaffold in the field of skin repair, cornea repair and bone repair. It indicated that collagen and chitosan composites had become a research hotspot in the each field of tissue engineering scaffold material. While the collagen and chitosan composite was not a panacea, according to different purposes,blending other material to meet the demand of different organizational goals is superable.
tissue engineering scaffold, collagen, chitosan, composite material
1006-6586(2016)10-0012-05
R318
A
2016-05-23