胃癌及癌前病变黏膜组织中环氧化酶-2、p53的表达及其与幽门螺杆菌感染的相关性
路敏敏,刘京运,金世禄,屈冬冬
(1.滨州医学院临床学院,山东 滨州 256603;2.山东省滨州市人民医院消化科,山东 滨州 256610)
胃癌及癌前病变黏膜组织中环氧化酶-2、p53的表达及其与幽门螺杆菌感染的相关性
路敏敏1,刘京运1,金世禄2,屈冬冬1
(1.滨州医学院临床学院,山东 滨州256603;2.山东省滨州市人民医院消化科,山东 滨州256610)
目的:探讨胃癌及癌前病变组织中环氧化酶-2(COX-2)、p53的表达情况,分析其与幽门螺杆菌(Hp)感染的相关性。方法:选取慢性浅表性胃炎(CSG)、慢性萎缩性胃炎(CAG)、肠上皮化生(IM)、上皮内瘤变(IN)、胃癌患者各30例,采用免疫组化法检测COX-2、p53的表达,组织学改良Giemsa染色联合快速尿素酶试验(HPUT)检测Hp,分析各病变组COX-2、p53的表达情况及其与Hp感染的关系。结果:各组黏膜组织中COX-2、p53阳性表达率及Hp感染率差异显著(P=0.000),其中胃癌组各指标的阳性率均显著高于其他各组(P<0.05)。Hp感染阳性组织中COX-2、p53阳性表达率分别为80.8%、60.3%,Hp感染阴性组织中COX-2、p53阳性表达率分别为13.9%、15.3%,差异有统计学意义(P<0.01)。Hp感染伴COX-2和/或p53表达阳性均为胃癌发病的危险因素(OR=12.366,25.394,22.516,P<0.05)。结论:Hp感染,COX-2、p53阳性表达等因素的相互作用可能在胃癌发生发展过程中发挥重要作用,临床可对高危人群进行相关指标的联合检测。
胃癌;环氧化酶-2;p53;幽门螺杆菌
胃癌的发生通常经历慢性浅表性胃炎(chronic superficial gastritis,CSG)、慢性萎缩性胃炎(chronic atrophic gastritis,CAG)、肠上皮化生(intestinal metaplasia,IM)、上皮内瘤变(intraepithelial neoplasia,IN)等多阶段过程[1]。幽门螺杆菌(helicobacter pylori,Hp)感染是慢性胃炎的主要病因,与胃癌的发生发展有密切关系。环氧化酶-2(cyclooxygenase -2,COX-2)参与多种病理生理过程,其表达与炎症及肿瘤的发生发展有关[2]。p53是一种抑癌基因,它的突变可导致细胞恶性转化,进一步促进肿瘤的发展[3]。本研究通过检测胃癌及癌前病变黏膜组织中Hp、COX-2和p53的表达,分析其相关性,现报告如下。
1 资料与方法
1.1一般资料
选取2013年2月至2015年6月山东省滨州市人民医院消化内科收治的CSG、CGA、IM、IN、胃癌患者各30例,分别设为CSG组、CGA组、IM组、IN组及胃癌组,所有患者均经胃镜检查和病理诊断确诊。
1.2方法
1.2.1COX-2、p53检测方法取胃窦距幽门约5 cm区域黏膜组织为标本,制成切片,运用链酶亲和素-生物素-过氧化物酶复合物技术(SABC)免疫组化染色[4]。PBS代替一抗作阴性对照,已知阳性切片作阳性对照,阳性反应判定以细胞浆中呈现颗粒状棕黄色染色者为COX-2、p53阳性细胞,阳性细胞在切片中的所占百分比超过10%为阳性(+)表达,其余为阴性(-)表达。
1.2.2胃黏膜Hp感染检测方法[5]采用组织学改良Giemsa染色联合快速尿素酶试验(HPUT)检测Hp,2项检测方法均显示阳性判为Hp阳性(+),均显示阴性判为Hp阴性(-),2项结果不一致者不纳入研究对象。
1.3统计学分析
采用SPSS 15.0软件,计数资料以百分比表示,比较采用χ2检验,采用Spearman等级相关分析COX-2、p53表达与Hp感染的关系。P≤0.05为差异有统计学意义。
2 结果
2.1各组基线资料比较
各组性别、年龄等基线资料比较,差异无统计学意义(P>0.05)。见表1。

表1 各组基线资料比较(n=30)
2.2各组黏膜组织中COX-2、p53表达及Hp感染的情况
各组COX-2、p53阳性表达率及Hp感染率差异有统计学意义(P=0.000),其中胃癌组表达率显著高于其他各组(P<0.05);COX-2、p53阳性表达率随病变程度的加重呈逐渐增高的趋势(P=0.000,应用趋势性卡方检验)。见表2。

表2 各组黏膜组织中COX-2、p53表达及Hp感染的情况[n(%)]
*P<0.05,**P<0.01,与胃癌组比较。
2.3各组黏膜组织中COX-2、p53表达与Hp感染的关系
Hp感染阳性组织中COX-2、p53阳性表达率分别为80.8%、60.3%,Hp感染阴性组织中COX-2、p53阳性表达率分别为13.9%、15.3%,差异有统计学意义(P<0.01)。各组表达详情见表3。
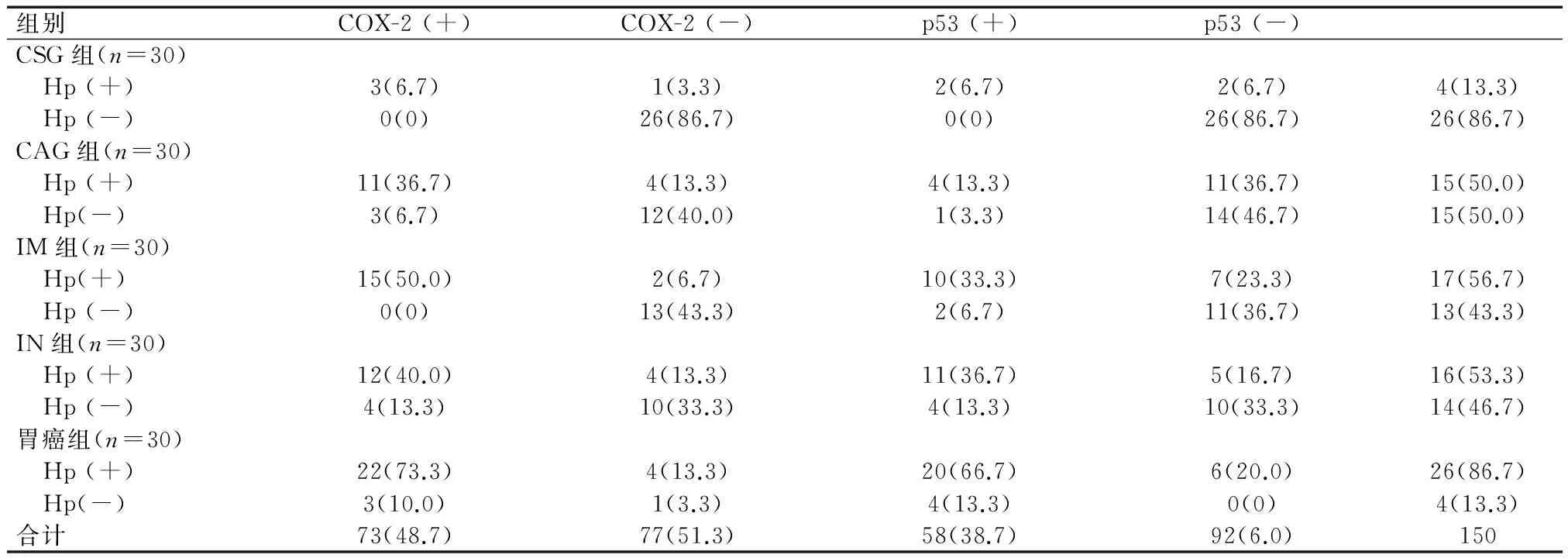
表3 各组黏膜组织中COX-2、p53的表达与Hp感染的相关性[n(%)]
2.4COX-2、p53表达及Hp感染与胃癌发病的关系
对各组患者进行病理因素logistic回归分析,结果表明,Hp感染伴COX-2和/或p53表达阳性均为胃癌发病的危险因素(OR=12.366,25.394,22.516,P<0.05)。
3 讨论
胃癌的发生是一个多因素、多阶段的复杂过程,其中Hp感染是胃癌发生过程中的主要生物因素。Hp主要寄居在胃窦部胃黏膜的黏液层和胃小凹内,此部位也是肠上皮化生和异型增生以及胃癌发生率最高的部位,持续Hp感染可导致胃黏膜萎缩和肠化生,最终发展为癌变[6-7]。本研究显示,胃癌组Hp阳性率显著高于其他各组(P<0.01),可见Hp感染与胃癌的发生发展有着密切的关系。环氧酶(COX)是前列腺素(PGs)合成中关键性限速酶,COX-2是其诱导型异构体。研究[8-9]表明,在巨噬细胞、成纤维细胞、内皮细胞和单核细胞中COX-2均可被诱导表达,在炎症、肿瘤等病理状态下受物质刺激呈高表达趋势,其催化出的PGs可能通过某种传导途径作用于邻近上皮细胞,进而在上皮细胞恶变中发挥作用。本研究中胃癌组COX-2阳性率显著高于其他各组。p53基因是一种抑癌基因,其突变和缺失可导致细胞增殖加速和凋亡受阻,促进肿瘤的发生[10]。研究[11]显示,p53基因的突变是胃癌发生发展过程中最常见的变异基因,可刺激和促进恶性肿瘤细胞的生长。本研究结果显示,胃癌中p53阳性率显著高于其它病变组,同时,COX-2与p53阳性表达率随病变程度的加重呈逐渐增高的趋势,表明COX-2、p53的表达在胃癌的发生发展过程中起着重要作用。
研究[12-13]发现,Hp可诱导COX-2的表达,其原理可能是:一方面,胃黏膜受Hp感染的刺激表现出一种自我保护机制;另一方面,Hp的侵袭激活了某些细胞因子和生长因子,诱导了COX-2表达。本研究显示,Hp表达阳性的胃黏膜病变组织中COX-2的阳性表达率显著高于Hp表达阴性的胃黏膜病变组织,亦说明COX-2的表达与Hp有关。近年来研究[14-15]表明,Hp感染与p53的过度表达有关,可能是由于Hp感染使野生型p53转变为突变体p53,导致p53丧失抑癌活性,进而促进细胞的恶性转化。本研究结果显示,Hp感染阳性的胃黏膜病变组织中p53的阳性表达率显著高于Hp感染阴性的胃黏膜病变,提示Hp感染可能通过刺激p53突变降低其抑癌作用,增加了细胞恶性转化的风险。此外,对30例胃癌患者的临床病理因素进行Logistic回归分析发现,Hp感染伴COX-2和/或p53表达阳性均为胃癌发病的危险因素,表明COX-2、p53阳性表达与Hp感染之间可能存在交互作用,增加胃癌发病风险,而COX-2、p53阳性表达,Hp感染阴性不是胃癌发病的独立危险因素,也证实了Hp感染在胃癌发病中的关键作用。
综上所述,Hp感染,COX-2、p53阳性表达等因素的相互作用可能在胃癌发生发展过程中发挥重要作用,在临床中对高危人群进行相关指标的联合检测,对及早发现胃癌前病变及胃癌具有一定的意义。但本研究对Hp感染具体通过哪些途径影响COX-2、p53的表达没有阐述,这有待临床进一步研究证实。
[1]俞敏,严晓梅.蛋白激酶受体2与胃癌、幽门螺杆菌感染的关系研究[J].实用癌症杂志,2015,30(10):1426-1429.
[2]Kiraly AJ,Soliman E,Jenkins A,etal.Apigenin inhibits COX-2, PGE2,and EP1 and also initiates terminal differentiation in the epidermis of tumor bearing mice[J].Prostaglandins Leukot Essent Fatty Acids,2016,104:44-53.
[3]Liu S,Chen P,Hu M,etal.Randomized, controlled phase II study of post-surgery radiotherapy combined with recombinant adenoviral human p53 gene therapy in treatment of oral cancer[J].Cancer Gene Ther,2013,20(6):375-378.
[4]谢洋均,王昌雄,林维勤,等.胃癌和癌前病变中幽门螺杆菌及环氧化酶-2和p53的表达及相关性研究[J].中国中西医结合消化杂志,2014,22(3):122-125.
[5]张丽,张建中.中国检验幽门螺杆菌感染方法诊断效能的分析[J].世界华人消化杂志,2007,15(6):649-654.
[6]Park CH,Cho SY,Ha JD,etal.Novel c-Met inhibitor suppresses the growth of c-Met-addicted gastric cancer cells[J].BMC cancer,2016,16(1):35.
[7]Figura N,Marano L,Moretti E,etal.Helicobacter pylori infection and gastric carcinoma:Not all the strains and patients are alike[J].World J Gastrointest Oncol,2016,8(1):40-54.
[8]李三党,李正凯,张轶,等.靶向沉默胃癌ACS细胞β-catemim给予表达对COX-2的影响[J].现代肿瘤医学,2015,23(15):2108-2111.
[9]Su HJ,Zhang Y,Zhang L,etal.Methylation status of COX-2 in blood leukocyte DNA and risk of gastric cancer in a high-risk Chinese population[J].BMC Cancer,2015,15:979.
[10]Ji FJ,Tian XF,Liu XW,etal.Dihydromyricetin induces cell apoptosis via a p53-related pathway in AGS human gastric cancer cells[J].Genet Mol Res,2015,14(4):15564-15571.
[11]王昌雄,麻妙群,林维勤,等.幽门螺旋杆菌根除前后胃黏膜环氧化酶-2、p53表达的变化[J].现代实用医学,2012,24(8):869-870.
[12]钱铖,刘明东,邹晓平.幽门螺杆菌感染与胃癌及癌前病变环氧化酶-2表达的研究[J].实用医学杂志,2010,26(3):401-403.
[13]宋红勇.胃癌和癌前病变中环氧化酶2及幽门螺杆菌感染相关性研究[J].中国现代药物应用,2013,7(6):27-28.
[14]Zaika AI.Erratum to:Bacterial Pathogen Helicobacter pylori:A Bad AKTor Inhibits p53 Protein Activity[J].Dig Dis Sci,2015,60(4):822-823.
[15]詹颖瑛,王武玲,钱江虹,等.幽门螺杆菌感染与胃组织中p53的表达及微血管密度形成关系研究[J].中华医院感染学杂志,2015,25(22):5131-5133.
(学术编辑:赵妍丽)
Expression of cyclooxygenase-2 and p53 in mucous tissues of gastric cancer and precancerous lesion and its relationship with helicobacter pylori infection
LU Min-min1,LIU Jing-yun1,JIN Shi-lu2,QU Dong-dong1
(1.SchoolofClinicalMedicine,BinzhouMedicalCollege,Binzhou256603;2.DepartmentofGastroenterology,BinzhouPeople′sHospital,Binzhou256610,Shandong,China)
Objective:To explore the expression of cyclooxygenase-2 (COX-2) and p53 in mucous tissues of gastric cancer and precancerous lesion,and to analyze its relationship with helicobacter pylori (Hp) infection.Methods:30 patients with chronic superficial gastritis (CSG),30 patients with chronic atrophic gastritis (CAG),30 patients with intestinal metaplasia (IM),30 patients with intraepithelial neoplasia (IN) and 30 with gastric cancer were selected as study subjects.The expression of COX-2 and p53 was detected by immunohistochemical method while Hp by histological modified Giemsa staining combined with rapid urease test (HPUT),and the relationship between the expression of COX-2 and p53 and Hp infection was analyzed.Results:There were significant differences among groups in the positive expression rates of COX-2 and p53 as well as Hp infection rate (P=0.000),and gastric cancer group was markedly higher than other groups in the positive expression rates of above indexes(P<0.05).The positive expression rates of COX-2 and p53 were 80.8% and 60.3% in tissues with positive Hp infection,and were 13.9% and 15.3% in tissues with negative Hp infection,respectively,and the differences were significant (P<0.01).Hp infection complicated with positive expression of COX-2 and/or p53 were the risk factors for the development of gastric cancer (OR=12.366,25.394,22.516,P<0.05).Conclusion:The interaction of Hp infection and positive expression of COX-2 and p53 plays an important role in the development and progression of gastric cancer,so the combined detection of corresponding indexes can be clinically conducted to the population with high risk.
Gastric cancer;Cyclooxygenase-2;p53;Helicobacter pylori
10.3969/j.issn.1005-3697.2016.03.035
2016-01-21
路敏敏(1990-),女,硕士研究生。通讯作者:刘京运,E-mail:1367323868@qq.com
时间:2016-6-1617∶46
http://www.cnki.net/kcms/detail/51.1254.R.20160616.1746.070.html
1005-3697(2016)03-0410-03
R735.2
A

