自噬在内质网应激诱导的肝星状细胞凋亡中的作用研究
汪应红,王 欢,左龙泉,王亚飞,黄 涛,范宇哲,李凡杰,王旭东,黄 艳
自噬在内质网应激诱导的肝星状细胞凋亡中的作用研究
汪应红1,王 欢1,左龙泉1,王亚飞2,黄 涛2,范宇哲2,李凡杰2,王旭东2,黄 艳1
目的 研究内质网应激诱导HSC凋亡的过程中自噬的发生与否及其作用,为肝纤维化的逆转提供新的思路。方法 采用血小板衍生生长因子(PDGF-BB)诱导大鼠肝星状细胞系HSC-T6活化模型,在此基础上,给予ERS诱导剂毒胡萝卜素(TG)刺激24 h,Western blot法检测自噬相关蛋白LC3B的表达,MDC染色法观察自噬小体的生成,观察TG对HSC自噬的影响,进一步采用3-MA阻断自噬,流式细胞术检测各组细胞凋亡率,观察自噬在内质网应激诱导的肝星状细胞凋亡中的作用。结果 TG可以诱导HSC凋亡,伴随着自噬的发生,用3-MA阻断自噬可以增强TG诱导的HSC凋亡。结论 内质网应激诱导HSC凋亡的过程伴发自噬,阻断自噬可以增强内质网应激诱导的HSC凋亡。
内质网应激;自噬;肝星状细胞;肝纤维化;凋亡
肝纤维化是肝脏对各种慢性损伤的修复反应,是受到各种致病因子的侵袭所致的慢性炎症性疾病,本质是Collagen I等细胞外基质(extracellular matrix,ECM)相关主要成分的大量累积[1]。研究[2]表明静止的肝星状细胞(hepatic stellate cell,HSC)活化增殖、大量过度分泌ECM是导致肝纤维化发生的主要原因。因此,促进活化的HSC发生凋亡是一种有效的肝纤维化防治方法。内质网应激(endoplasmic reticulum stress,ERS)是内质网功能紊乱导致的内质网未折叠和错误折叠蛋白的累积、细胞内钙离子平衡失调[3-4]。内质网应激所诱导的细胞凋亡是最近几年才被了解的一种新的凋亡途径,与经典的线粒体和死亡受体介导的细胞凋亡明显不同。目前已知由ERS激活凋亡的路径有三条:①通过PERK/eIF2α路径激活CHOP基因的转录,下调抗凋亡基因Bcl-2的表达,促进细胞凋亡;②通过IRE1激活JNK信号通路下调抗凋亡基因Bcl-2的表达,激活线粒体凋亡级联反应、上调促凋亡基因Bim;③ERS特有的Caspase-12的激活,进一步激活凋亡启动因子Caspase-9及凋亡执行因子Caspase-3[5]。ERS通过减少未折叠或错误折叠蛋白沉积,激活促凋亡信号通路,被证实与许多疾病密切关联[6],前期研究[7]显示ERS能够抑制活化的HSC分泌α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和I型胶原(CollagenⅠ,Col-Ⅰ),促进活化的HSC凋亡。自噬是一个细胞吞噬自身细胞质蛋白或细胞器,使其进入囊泡,并与溶酶体融合后形成自噬溶酶体的过程,通过自噬溶酶体降解其所包裹的内容物,从而实现细胞自身的代谢需求和某些细胞器的更新[8]。自噬是广泛存在于真核细胞内的一种自我保护机制,在调节细胞幸存、死亡的过程中扮演着重要的角色。然而自噬相关基因如ATG5、Beclin1等过度上调亦能引起细胞死亡[9]。内质网应激可以诱导自噬[10-11],该研究旨在探讨内质网应激诱导HSC凋亡的过程中自噬的发生与否及其作用,为肝纤维化的恢复、逆转提供新的研究方向。
1 材料与方法
1.1 细胞株HSC-T6 细胞株购自中国科学院上海细胞库,为永生化大鼠HSC。
1.2 主要材料与试剂 DMEM培养液(南京凯基生物科技发展有限公司);胎牛血清(杭州四季青生物工程材料有限公司);重组小鼠血小板衍生生长因子(PDGF-BB)(英国PEPROTECH公司);毒胡萝卜素(thapsigargin,TG)、3-methyl adenine(3-MA)、MDC染料、DMSO(美国Sigma公司);细胞组织裂解液RIPA、蛋白酶抑制剂PMSF(上海碧云天公司);山羊抗兔、山羊抗小鼠二抗(北京中杉金桥生物技术有限公司)、α-SMA、Col-I、GRP78、CHOP、β-actin一抗(北京博奥森生物技术有限公司);LC3B一抗(武汉伊莱特公司);Caspase-12一抗(美国CST公司);Annexin V-FITC凋亡检测试剂盒(中国BestBio公司)。
1.3 主要仪器 NAPCO-6100型细胞培养箱(美国SHELLAB公司);SW-CJ-IF型超净工作台(江苏苏净集团苏州安泰空气技术有限公司);Western blot设备(美国Biorad公司);Sigma3-16K高速离心机(美国Sigma公司);荧光倒置显微镜(日本Olympus公司);FA2004型电子天平(上海精天天平厂);4℃、-20℃低温冰箱(日本三洋公司);GSG2000Ⅱ型凝胶成像系统(珠海黑马公司);流式细胞仪(美国贝克曼公司)。
1.4 方法
1.4.1 HSC-T6细胞培养和传代 HSC-T6细胞使用含有10%四季青胎牛血清及100 IU/ml青霉素和100 mg/L链霉素的低糖培养基(1 000 mg/L),置于37℃、5%CO2培养箱中培养。当细胞生长融合达到约80%时,用0.25%胰蛋白酶消化传代,或接种于培养瓶、6孔板。
1.4.2 Western blot法检测HSC中GRP78、CHOP、Caspase-12、LC3B、α-SMA和Col-I蛋白表达 课题组前期研究[6]选出最适PDGF浓度(20 ng/ml)和TG浓度(1 μmol/L)、3-MA浓度(5 mmol/L)和作用时间(24 h),分为对照组、PDGF组、PDGF+TG组、PDGF+TG+3-MA组,同时给药刺激24 h后,收集细胞蛋白检测GRP78、CHOP、Caspase-12、LC3B、α-SMA和Col-I的表达;具体步骤如下:收集各组细胞,加蛋白裂解液(RIPA∶PMSF=100∶1配成),冰上摇晃裂解,每隔10 min晃动下培养瓶或6孔板,使裂解液充分铺满,裂解30 min。吸取裂解液于1.5 ml EP管中,4℃、12 000 r/min离心30 min,取上清液。用定量仪对蛋白样品定量,调整各组蛋白浓度一致,后加入5×SDS蛋白上样缓冲液,100℃加热10 min使蛋白变性。胶配好后,每孔上样20 μl总蛋白,进行SDS-PAGE电泳,采用湿转法将胶上蛋白转至PVDF膜上,膜置于室温下用5%脱脂奶粉(TBST新鲜配制)封闭3 h,后用TBST清洗3遍,每遍15 min,用待检测蛋白的一抗孵育,放于4℃冰箱过夜。次日,膜用TBST清洗后,用与一抗种属相匹配的的二抗室温孵育1 h,TBST清洗3遍,每遍15 min,ECL发光试剂盒显影,以β-actin为内参,Image J软件分析条带的灰度值。
1.4.3 MDC染色法检测HSC-T6细胞自噬水平
细胞分组及处理同1.4.2,染色前接种于含盖玻片的6孔板内。处理时间完成后,弃培养基,用1× PBS缓冲液轻轻洗涤细胞3遍,每遍5 min,再往每孔分别加入1 ml 1×PBS缓冲液及1 μl配置好的100 mmol/L MDC储存液,形成100 μmol/L的MDC工作液,锡箔纸包裹6孔板,置于培养箱中避光孵育30 min。最后吸干含MDC的PBS溶液,用干净的1 ×PBS缓冲液洗涤细胞2遍,每遍5 mim,然后将盖玻片置于荧光显微镜下进行自噬小体的观察。
1.4.4 流式细胞术检测细胞凋亡率 细胞分组及处理同1.4.2,消化收集各组细胞,以2 000 r/min的转速离心5 min,弃去培养基,用冷的PBS溶液洗涤细胞2次,用400 μl 1×Binding Buffer悬浮HSC-T6细胞,浓度大致为1×106个/ml,在细胞悬浮液中加入5 μl Annexin V-FITC,轻柔混匀后于2~8℃条件下避光孵育15 min,后加入10 μl PI后轻轻混匀于2~8℃条件下避光孵育5 min,处理完成后在1 h内用流式细胞仪检测。
1.5 统计学处理 采用SPSS 17.0软件进行分析,数据以±s表示,组间均数比较采用方差分析。所有检验为双侧检验。
2 结果
2.1 TG对PDGF活化的HSC内内质网应激相关蛋白表达的影响 Western blot结果见图1,GRP78、CHOP、c-Caspase-12蛋白的表达4组总体比较差异均有统计学意义(F=129.483,P<0.001;F= 95.739,P<0.001;F=120.624,P<0.001)。TG能增加PDGF活化的HSC内GRP78、CHOP、c-Caspase-12的表达,促进HSC凋亡,与PDGF组比较差异具有统计学意义(P<0.01);与PDGF+TG组比较,3-MA能减少GRP78的表达,增强内质网应激相关凋亡蛋白CHOP、c-Caspase-12的表达,差异具有统计学意义(P<0.01)。
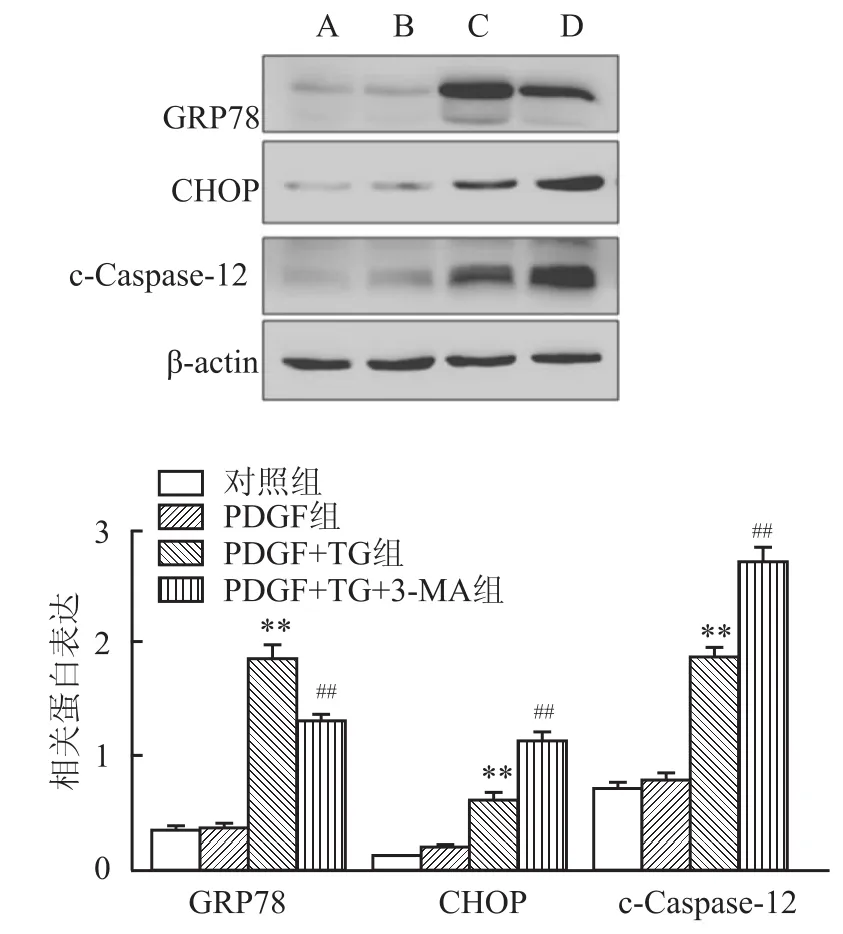
图1 Western blot法检测ERS相关蛋白的表达
2.2 HSC自噬相关蛋白表达的变化 Western blot结果见图2,LC3B的表达4组总体比较差异均有统计学意义(F=10.148,P=0.004)。TG能显著增强HSC自噬的强度,与PDGF组比较,LC3BⅡ的表达明显增多,差异具有统计学意义(P<0.05);而3-MA能阻断自噬,与PDGF+TG组比较,相应的蛋白LC3BⅡ表达降低,差异具有统计学意义(P<0.05)。
2.3 α-SMA和Col-Ⅰ蛋白表达的变化 Western blot结果见图3,α-SMA和Col-Ⅰ蛋白的表达4组总体比较差异均有统计学意义(F=44.889,P<0.001;F=30.223,P<0.001)。PDGF能明显活化HSC,PDGF组α-SMA和Col-Ⅰ蛋白的表达较对照组增多,差异具有统计学意义(P<0.05);TG能显著降低HSC内α-SMA和Col-Ⅰ蛋白的表达,与PDGF组比较差异具有统计学意义(P<0.01);而3-MA能进一步抑制α-SMA和Col-Ⅰ蛋白的表达,与PDG+TGF组比较差异具有统计学意义(P<0.01)。

图2 Western blot法检测自噬相关蛋白的表达

图3 Western blot法检测α-SMA和Col-Ⅰ的表达
2.4 MDC染色观察HSC自噬小体的生成 MDC染色结果见图4,对照组和PDGF组荧光强度较弱,表明自噬程度较低,而PDGF+TG组较PDGF组荧光强度较高且在细胞质可见明显聚集的荧光颗粒,在加3-MA阻断自噬后,PDGF+TG+3-MA组荧光强度减弱。以上结果提示:TG可诱发HSC自噬,而3-MA能阻断TG诱发的HSC自噬。

图4 荧光显微镜观察MDC染色后HSC中自噬泡分布情况×400
2.5 流式细胞术检测各组细胞凋亡率 流式细胞术检测各组细胞的凋亡率见图5,4组凋亡率总体比较差异均有统计学意义(F=234.251,P<0.001)。对照组和PDGF组凋亡率较低,PDGF+TG组凋亡率较PDGF组明显升高,与PDGF组比较差异具有统计学意义(P<0.01),而PDGF+TG+3-MA组凋亡率较PDGF+TG组进一步升高,差异具有统计学意义(P<0.01),结果表明TG可以促进HSC凋亡,而3-MA可增强TG诱导的HSC凋亡。
3 讨论

图5 流式细胞术检测细胞凋亡率
TG是Ca2+-ATP酶选择性抑制剂,通过激活内质网Ca2+通道促进Ca2+进入细胞质,使细胞质内Ca2+浓度持续升高而诱导ERS,TG是一种诱导内质网应激的特异性经典工具药[12]。课题组前期研究[7]表明TG可以促进HSC凋亡,有利于肝纤维化的逆转。本研究显示在TG诱导HSC凋亡的过程中伴随着自噬的发生,可能通过Ca2+激活钙调蛋白依赖激酶-β,进而使5′-磷酸腺苷激活蛋白激酶磷酸化增多,从而抑制雷帕霉素靶蛋白的表达,最终导致自噬上调[13]。具体机制有待于下一步实验证实。自噬参与体内各种病理生理过程,对机体反应具有双向调节作用[14],就肝纤维化而言,自噬可以通过激活肝星状细胞促进肝纤维化,通过保护肝细胞减少细胞外基质的产生减轻肝纤维化,自噬可降解受损的蛋白以及减少DNA的损伤等途径来保护细胞免于发生凋亡[15],本研究结果显示:自噬对于在ERS诱导的HSC凋亡过程中起着保护作用,自噬可以抑制内质网应激诱导的HSC凋亡,ERS诱导的自噬可减轻内质网膨胀,清除聚集过多的蛋白质,缓解内质网遭受的强烈而持久的刺激,保护细胞,可以抑制毒胡萝卜素或衣霉素引起的细胞死亡。3-MA是自噬的抑制剂,通过抑制Ⅲ型PI3K,干扰自噬隔离膜的形成,本研究结果表明,在内质网应激细胞模型基础上用3-MA阻断自噬,内质网应激相关凋亡蛋白CHOP和Caspase-12表达增多,HSC活化增殖相关蛋白α-SMA、Col-Ⅰ表达减少,HSC凋亡明显增强,流式细胞术结果进一步证实了3-MA增强内质网应激诱导的HSC凋亡。综上所述,本研究表明,自噬可以抑制内质网应激诱导的HSC凋亡,在肝纤维化恢复期,如果能通过阻断自噬而靶向诱导HSC凋亡,将能为抗肝纤维化提供新的靶点,为新药研发提供新的思路。
[1] Pellicoro A,Ramachandran P,Iredale J P,et al.Liver fibrosis and repair:immune regulation of wound healing in a solid organ[J].Nat Rev Immunol,2014,14(3):181-94.
[2] Safadi R,Friedman S L.Hepatic fibrosis-role of hepatic stellate cell activation[J].Med Gen Med,2002,4(3):27.
[3] Bravo R,Parra V,Gatica D,et al.Endoplasmic reticulum and the unfolded protein response:dynamics and metabolic integration[J].Int Rev Cell Mol Biol,2013,301(10):215-90.
[4] 刘宝琴,王华芹.内质网应激与未折叠蛋白反应的研究进展[J].中华肿瘤防治杂志,2010,17(11):869-72.
[5] 付裕,李滢,杨方万,等.内质网应激诱导自噬的分子机制及意义[J].现代生物医学进展,2013,13(12):2393-7.
[6] De Minicis S,Candelaresi C,Agostinelli L,et al.Endoplasmic reticulum stress induces hepatic stellate cell apoptosis and contributes to fibrosis resolution[J].Liver Int,2012,32(10):1574-84.
[7] Huang Y,Li X,Wang Y,et al.Endoplasmic reticulum stress-induced hepatic stellate cell apoptosis through calcium-mediated JNK/p38 MAPK and Calpain/Caspase-12 pathways[J].Mol Cell Biochem,2014,394(1-2):1-12.
[8] Glick D,Barth S,Macleod K F.Autophagy:cellular and molecular mechanisms[J].J Pathol,2010,221(1):3-12.
[9] Mizushima N,Ohsumi Y,Yoshimori T.Autophagosome formation in mammalian cells[J].Cell Struct Funct,2002,27(6):421-9.
[10]Yang X,Srivastava R,Howell S H,et al.Activation of autophagy by unfolded proteins during endoplasmic reticulum stress[J].Plant J,2016,85(1):83-95.
[11]Rashid H O,Yadav R K,Kim H R,et al.ER stress:Autophagy induction,inhibition and selection[J].Autophagy,2015,11(11):1956-77.
[12]Ganley I G,Wong P M,Gammoh N,et al.Distinct autophagosomal-lysosomal fusion mechanism revealed by thapsigargin-induced autophagy arrest[J].Mol Cell,2011,42(6):731-43.
[13]Høyer-Hansen M,Bastholm L,Szyniarowski P,et al.Control of macroautophagy by calcium,calmodulin-dependent kinase kinasebeta,and Bcl-2[J].Mol Cell,2007,25(2):193-205.
[14]Mehrpour M,Esclatine A,Beau I,et al.Autophagy in health and disease.1.Regulation and significance of autophagy:an overview[J].Am J Physiol Cell Physiol,2010,298(4):776-85.
[15]Bernales S,McDonald K L,Walter P.Autophagy counterbalances endoplasmic reticulum expansion during the unfolded protein response[J].PLoS Biol,2006,4(12):e423.
Role of autophagy in hepatic stellate cell apoptosis induced by endoplasmic reticulum stress
Wang Yinghong,Wang Huan,Zuo Longquan,et al
(School of Pharmacy,Anhui Medical University,Hefei 230032)
Objective To explore whether autophagy occurs or not and its effect during endoplasmic rediculum stress induced by TG,provides new train of thought for reversal of hepatic fibrosis.Methods Platelet-derived growth factor(PDGF-BB)was used to induce rat hepatic stellate cell(HSC-T6)activation model,on this basis,ERS inducer poison carotene(TG)was given to stimulate cells for 24 h.The autophagy related LC3B protein expression was detected by Western blot and the formation of autophagosome was detected by the MDC staining so as to observe the effect of TG on HSC autophagy.The 3-MA was used to block autophagy,each cell apoptosis rate was detected by flow cytometry,the role of autophagy in hepatic stellate cell apoptosis induced by endoplasmic reticulum stress was observed.Results HSC apoptosis was induced by TG,accompanied by the occurrence of autophagy,while 3-MA blocked autophagy and enhanced the HSC apoptosis induced by TG.Conclusion HSC apoptosis can be induced by TG with the occurrence of autophagy.3-MA can enhance the HSC apoptosis induced by endoplasmic reticulum stress.
ERS;autophagy;hepatic stellate cells;liver fibrosis;apoptosis
R 966
A
1000-1492(2016)08-1115-05
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.018.html
2016-04-19 接收
安徽省学术技术带头人后备人选课题(编号:2015H040);安徽省高校优秀青年人才支持计划重点项目(编号:gxyqZD2016049);安徽医科大学“青年拔尖人才支持计划”;安徽医科大学临床医学(“5+3”一体化)专业学生“早期接触科研”训练计划项目(编号:2015-ZQKY-46)
安徽医科大学1药学院基础与临床药理教研室、2第二临
床医学院,合肥 230032
汪应红,男,硕士研究生;黄 艳,女,硕士生导师,责任作者,E-mail:aydhy@126. com
——疾病防治的新靶标

