猴头菇多糖对小鼠脾淋巴细胞体外NO分泌及iNOS mRNA表达的影响
郑乃珍,郑小香,檀新珠,任喆,马玉芳,黄一帆
(福建农林大学动物科学学院中西兽医结合与动物保健福建省高校重点实验室,福建福州350002)
猴头菇多糖对小鼠脾淋巴细胞体外NO分泌及iNOS mRNA表达的影响
郑乃珍,郑小香,檀新珠,任喆,马玉芳,黄一帆
(福建农林大学动物科学学院中西兽医结合与动物保健福建省高校重点实验室,福建福州350002)
为了研究猴头菇多糖(Hericium erinaceus polysaccharide,HEP)对小鼠脾淋巴细胞NO生成及iNOS mRNA表达的影响。采用Griess法测定HEP单独或协同ConA诱导脾淋巴细胞分泌NO含量;RT-PCR法检测脾淋巴细胞iNOS mRNA表达量。结果与细胞对照组比较,HEP在25~400 μg/mL的浓度范围内能单独诱导脾淋巴细胞NO分泌及iNOS mRNA表达(P<0.05);与ConA对照组比较,HEP在100~400 μg/mL浓度范围内能协同ConA诱导脾淋巴细胞NO分泌及iNOS mRNA表达(P<0.05)。表明HEP能单独或协同ConA诱导小鼠脾淋巴细胞分泌NO,此作用可能是通过促进iNOS mRNA表达而实现。
猴头菇多糖;脾淋巴细胞;一氧化氮;诱导型一氧化氮合酶
猴头菇是一种大型真菌,具有助消化、利五脏、润六肺的功能。猴头菇多糖(Hericium erinaceus polysaccharide,HEP)的药理作用研究是近年来研究热点。目前国内外研究表明,HEP具有抗肿瘤[1]、抗病毒[2]、抗氧化和保肝护肝[3]、促进树突状细胞的免疫调节[4]、促进巨噬细胞的免疫调节[5]、促进体内脾淋巴细胞的免疫调节[6]等药理作用。
前期研究发现,HEP能单独或协同ConA促进脾淋巴细胞增值、诱导淋巴细胞DNA从G0/G1期进入S期[7]。NO是细胞间信息传递的重要调节分子,是杀灭病原微生物的主要效应分子,介导细胞免疫和炎症毒性的功能[8]。但关于HEP对体外脾淋巴细胞分泌NO及iNOS mRNA的表达鲜见报道。为进一步研究HEP的免疫调节作用机制,本研究通过检测HEP单独或协同ConA对小鼠脾淋巴细胞分泌NO量及iNOS mRNA表达量,旨在探讨HEP的调节免疫作用机理进一步丰富HEP的免疫药理学内容。
1材料与方法
1.1材料与试剂胎牛血清,杭州四季青生物工程材料有限公司;刀豆蛋白(ConA),美国Sigma公司;RPMI-1640培养液,美国Hyclone公司;磷酸盐缓冲液(PBS)、红细胞裂解液均为北京索莱宝科技有限公司;RNAiso Plus、RNA反转试剂盒、SYBR Rremic EX TaqTM均为Japan TaKaRa公司产品;青霉素、链霉素、Griess试剂盒均为上海碧云天生物技术有限公司;猴头菇多糖由上海朝翔技术有限公司提供,经本校中西兽医结合与实验动物保健实验室纯化,多糖含量为76.7%。
1.2实验动物健康昆明系小鼠,雄性,体重20± 2 g,福建医科大学实验动物中心提供。
1.3试验仪器CO2培养箱(美国Thermo Electron公司);PCR仪(美国BIO-RAD公司Thermal Cycler型号C1000);Real-time PCR系统(美国BIORAD公司CFX96TMReal-time System);台式冷冻离心机(美国Beckman coulter公司ALLEGRA X-22R);酶标仪(美国BIO-RAD公司)。
1.4试验方法
1.4.1小鼠脾淋巴细胞悬液的制备颈椎脱臼法处死小鼠,75%乙醇浸泡5 min,取出脾脏后用PBS清洗脾脏,玻璃针芯研磨脾脏并挤压过200目筛网,收集细胞悬液,1 500 r/min(4℃)离心3 min,弃上清液后加入2 mL红细胞裂解液,静置5 min,离心,弃上清液,RPMI-1640培养液重复洗涤两遍,RPMI-1640培养液(含10%血清)重悬细胞,静置培养6 h,取悬浮细胞,台盼蓝染色,镜检计数,RPMI-1640完全培养液调整细胞浓度至5×106个/mL。
1.4.2HEP单独或协同ConA对脾淋巴细胞释放NO的影响取1.4.1制备的细胞悬液,接种到24孔板,每孔500 μL;试验设计组如下:HEP单独组(每孔加入500 μL HEP,HEP终质量浓度分别为0、25、50、100、200、400 μg/mL);HEP协同ConA组(每孔加入500 μL HEP和ConA,HEP终质量浓度分别为0、25、50、100、200、400 μg/mL,ConA终质量浓度为1 μg/mL);每组均设4个复孔。培养24 h后,收集各组上清液,Griess法检测NO的含量,具体操作按照试剂盒说明书要求进行。
1.4.3HEP单独或协同ConA对小鼠脾淋巴细胞iNOS mRNA表达量的影响取1.4.1制备的细胞悬液,接种到6孔板,每孔2 mL;试验组设计如下:HEP单独作用组(每孔加入2 mL HEP,HEP终质量浓度分别为0、25、50、100、200、400 μg/mL);HEP协同ConA组(每孔加入2 mL HEP和ConA,HEP终质量浓度分别为0、25、50、100、200、400 μg/mL,ConA终质量浓度为1 μg/mL)。培养24 h后,收集脾淋巴细胞,按RNAiso Plus法推荐步骤提取细胞总RNA。应用RT-PCR试剂盒,按其操作程序反转成cDNA。RT-PCR反应体系为6.25 μL ddH2O,1 μL cDNA,上游和下游引物各1 μL,6.25 μL SYBR Rremic EX TaqTM,混匀,离心,扩增。扩增程序:95℃预变性30 s,95℃变性5 s,退火至63℃,延伸30 s,40个循环;65℃延伸5 s。引物的序列及扩增长度见表1。
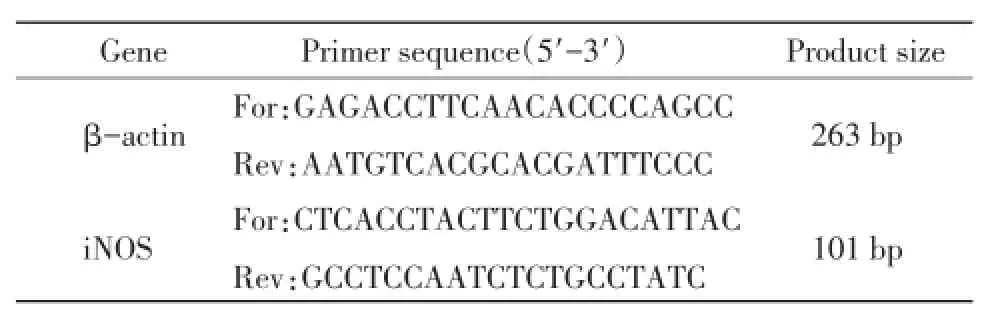
表1引物序列及扩增长度
1.5数据分析各组数据应用SPSS17.0软件统计处理。采用one-way ANOVA方法分析比较各试验组间差异显著性。
2结果与分析
2.1HEP对小鼠脾淋巴细胞分泌NO的影响由图1可知,在HEP浓度为25~400 μg/mL范围内,其OD值均显著高于细胞对照组(P<0.05)。

图1HEP对脾淋巴细胞分泌NO的影响
2.2HEP协同ConA对小鼠脾淋巴细胞分泌NO的影响由图2可知,在HEP浓度为100~400 μg/mL范围内,与ConA具有协同作用,其OD值均显著高于ConA对照组(P<0.05)。
2.3HEP对小鼠脾淋巴细胞iNOS mRNA表达量的影响由图3可知,在HEP浓度为25~400 μg/mL范围内,其OD值均显著高于细胞对照组(P<0.05)。
2.4HEP协同ConA对小鼠脾淋巴细胞iNOS mRNA表达量的影响由图4可知,在HEP浓度为200~400 μg/mL范围内,与ConA具有协同作用,其OD值均显著高于ConA对照组(P<0.05)。
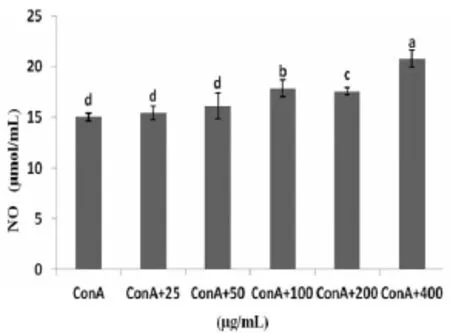
图2HEP协同ConA对脾淋巴细胞分泌NO的影响
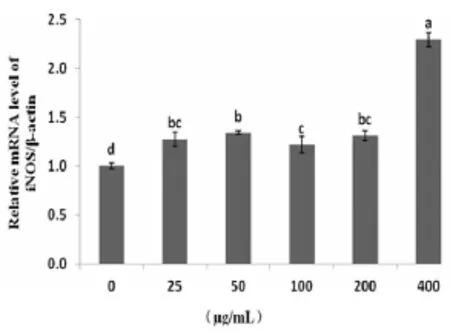
图3HEP对脾淋巴细胞iNOS mRNA表达的影响
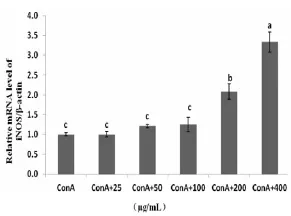
图4HEP协同ConA对脾淋巴细胞iNOS mRNA表达的影响
3讨论
一氧化氮(NO)是一种具有生物活性的气体分子,具有生物信使分子和细胞毒分子的双重作用。少量NO具有抗肿瘤[9]、提高免疫力[10]等多种免疫作用。山豆根多糖可以促进小鼠脾淋巴细胞分泌NO[11];黄芪多糖可以通过促进小鼠淋巴细胞中NO-cGMP信号系统的效应,提高信息传递[12];硒化乳酸菌胞外多糖可以协同ConA刺激小鼠脾淋巴细胞分泌NO[13]。本研究结果表明,HEP可以单独或协同ConA促进小鼠脾淋巴细胞释放NO,说明HEP可以通过促进NO的释放,增强机体的免疫力。
NO是由L-精氨酸在一氧化氮合酶作用下生成,其含量与NOS的活性呈正相关[1]。因此测定NOS是研究NO生理病理作用的重要环节。NOS可分为神经型(nNOS)、诱导型(iNOS)、内皮型(eNOS)3种类型。研究表明,金樱子多糖通过提高小鼠脾淋巴细胞中NOS活性,促进NO的产生[24]。本研究结果表明,HEP可以单独或协同ConA促进iNOS mRNA的表达,说明HEP可以通过促进iNOS mRNA的表达,刺激小鼠脾淋巴细胞释放NO。
[1]Zan X Y,Cui F J,Li Y H,et al.Hericium erinaceus polysaccharide-protein HEG-5 inhibits SGC-7901 cell growth via cell cycle arrest and apoptosis[J].Interbational Journal of Biological Macromolecules,2015(76):242-253.
[2]陈艺娟,吴异健,黄一帆,等.猴头菇多糖对呼肠孤病毒感染番鸭组织病变及细胞凋亡的影响[J].中国预防兽医学报,2010,32(1):14-18.
[3]Zhang Z F,Lv G Y,Pan H J,et al.Antioxidant and hepatoprotective potential of endo-polysaccharides from Hericium erinaceus grown on tofu whey[J].Interbational Journal of Biological Macromolecules,2012,51(5):1140-1146.
[4]Sheu S C,Lyu Y,Lee M S,et al.Immunomodulatory effects of polysaccharides isolated from Hericium erinaceus on dendritic cells[J].Process Biochemistry,2013,48(9):1402-1408.
[5]Lee J,Cho J,Hong J C.Study on macrophage activation and structural characteristics of purified polysaccharides from the liquid culture broth of Hericium erinaceus[J].Carbohydrate Polymers,2009,78(1):162-168.
[6]柳璐.猴头菇多糖对小鼠免疫调节作用的实验研究[D].广州:广州中医药大学,2012.
[7]郑乃珍,郑小香,李萍,等.猴头菇多糖对小鼠脾淋巴细胞体外增殖及细胞周期的影响[J].中国兽医科学,2015,45(8):837-842.
[8]Coleman J W.Nitric oxide in immunity and inflammation[J].International Immunopharmacology,2001,1(8):1397-1406.
[9]Cheng H W,Wang L,Mollica M,et al.Nitric oxide in cancer metastasis[J].Cancer Letters,2014,353(1):1-7.
[10]Sun Z B,Jiang Q F,Wang L P,et al.The comparative proteomics analysis revealed the modulation of inducible nitric oxide on the immune response of scallop chlamys farreri[J].Fish and Shelfish Immunology,2014,40(2):584-594.
[11]胡庭俊,康乐,帅学宏,等.山豆根多糖对小鼠脾脏淋巴细胞体外增殖及分泌一氧化氮的影响[J].中国药理与临床2009(5):70-72.
[12]高建峰,胡庭俊,高艳艳.黄芪多糖对小鼠免疫细胞NO-cGMP信号系统的效应[J].畜牧与兽医,2008,40(5):65-67.
[13]刘鹭,潘道东,曾小群,等.硒化乳酸菌胞外多糖对体外培养小鼠脾淋巴细胞分泌NO,IL-4及IL-12的影响[J].中国食品学报,2014,14(3):17-21.
[14]王崇甫,尹逊河,邱建华,等.血塞通及L-硝基精氨酸对脑纹状体出血家兔一氧化氮合酶活性,一氧化氮含量的影响[J].畜牧兽医学报,2012,43(12):1957-1962.
[15]皮建辉,谭娟,胡朝暾.金樱子多糖的体外免疫活性研究[J].华西药学杂志,2014,29(2):149-151.
Effect ofHericium erinaceuspolysaccharideon theproduction of NO and the expression of iNOS mRNA of murinesplenic lymphocytein vitro
ZHENG Nai-zhen,ZHENG Xiao-xiang,TAN Xin-zhu,REN Zhe,MA Yu-fang,HUANG Yi-fan
(Fujian Agriculture and Forestry University,Key Laboratory for Combination with Chinese and Western Veterinary and Animal Health of Fujian Province University,Fuzhou 350002,China)
To investigate the regulating effects of polysaccharides from Hericium erinaceum on nitric oxide(NO)releasing and inducible nitric oxide synthase(iNOS)expression in murine splenic lymphocyte.The production of NO treated with the single stimulation of HEP or the synergistical stimulation of HEP with ConA was determined by Griess,and the expression of iNOS mRNA was detelcted by RT-PCR.HEP at a concentration ranging from 25~400 μg/mL could elevate the production of NO and the expression of iNOS mRNA(P<0.05).HEP at a concentration ranging from 100~400 μg/mL could elevate the production of NO and the expression of iNOS mRNA after sensitization with ConA(P<0.05).The single stimulation of HEP or the synergistical stimulation of HEP with ConA could significantly increase NO production through elevating inducible NO synthase(iNOS)expression.
Hericium erinaceus polysaccharide;Spleen lymphocyte;NO;iNOS
s:MA Yu-fang;HUANG Yi-fan
R 285.5
A
0529-6005(2016)08-0032-03
2015-05-20
国家自然科学基金面上项目(31372474)
郑乃珍(1989-),女,硕士生,研究方向为天然药物的研究与应用,E-mail:821535711@qq.com
马玉芳,E-mail:myfau850@sohu.com;黄一帆,E-mail:zjhyfang@163.com

