ClassⅠ新城疫病毒BJ 1株微基因组的构建及功能鉴定
程晋龙,刘蒙蒙,胡楠,张国中
(1.中国农业大学动物医学院,北京海淀100193;2.北京市畜牧总站,北京朝阳100107)
ClassⅠ新城疫病毒BJ 1株微基因组的构建及功能鉴定
程晋龙1,刘蒙蒙1,胡楠2,张国中1
(1.中国农业大学动物医学院,北京海淀100193;2.北京市畜牧总站,北京朝阳100107)
将以绿色荧光蛋白(EGFP)为报告基因的ClassⅠ类新城疫病毒(NDV)BJ1株微基因组质粒pOK-M和3个辅助蛋白表达质粒pCI-NP、pCI-P、pCI-L共转染BSR T7/5细胞,转染24 h即可见到明显的绿色荧光,表明微基因组及其3种辅助质粒均获得了表达,并具有各自的生物学功能,为进一步建立该毒株的反向遗传操作系统奠定了基础。
新城疫病毒;ClassⅠ;微基因组;反向遗传;辅助质粒
新城疫病毒(NDV)为副黏病毒科(Paramyxoviridae)、副黏病毒亚科(Paramyxovirinae)、禽腮腺炎病毒属(Rubulavirus)成员,是禽Ⅰ型副黏病毒的代表株。病毒核酸为单股负链RNA,根据基因组长度NDV分为ClassⅠ和ClassⅡ两类[1],其中ClassⅠ型NDV基因组长15 198 nt[2],广泛存在于野鸟和家禽中,多为无致病性或致病性较弱的毒株;ClassⅡ类NDV基因组包括两种长度:15 186 nt或15 192 nt[3],其中既包括强毒株也包括弱毒株。因为鸡群暴发的致死性新城疫通常是由ClassⅡNDV中的强毒株引起[4-5],所以人们对ClassⅡNDV研究较早。ClassⅠ类NDV因其通常没有致病性所以研究较少,但该类病毒在各种鸟类中广泛存在。有研究表明,ClassⅠ类NDV在传代过程中毒力有增强的可能性[6],因此该类NDV对养禽业有潜在的威胁。
NDV的微基因组是包含了病毒全长基因组3′和5′末端UTR(非编码区)序列,并用反向互补的EGFP(绿色荧光蛋白)替代其间的编码区序列所构成的一种缺损病毒,因其需要辅助蛋白的帮助才能完成编码区蛋白(EGFP)的表达,所以人们往往把其作为检测辅助质粒的重要工具。本研究构建了ClassⅠ类NDV BJ1株的微基因组及其3种辅助质粒,并对他们的功能进行了验证,为建立该毒株全基因组反向遗传操作系统和开展功能基因组研究奠定了基础。
1材料与方法
1.1毒株本研究所用ClassⅠNDV毒株系本实验室于2014年从北京某活禽市场分离获得,通过接种SPF鸡胚进行病毒传代。
1.2质粒和细胞真核表达载体pCI-neo,购自英潍捷基(上海)贸易有限公司;表达T7 RNA聚合酶的BSR T7/5细胞由本实验室保存。含有增强型绿色荧光蛋白(EGFP)基因的质粒pEGFPN1,购自北京六合通经贸有限公司。
1.3分子生物学试剂M-MLV反转录酶、T4连接酶,购自Promega公司;dNTP,购自TaKaRa公司;Lipofectamine 2000、限制性内切酶以及TRIZol抽提试剂,购自Invitrogen公司;Plasmid Mini Kit,购自天根生化科技(北京)有限公司;DMEM细胞培养基,购自Gibco公司。
1.4微型基因组的构建微基因组包括4部分:T7启动子和cDNA的3′UTR、EGFP、cDNA的5′UTR、核酶序列和T7终止子,分别命名为M1、M2、M3、M4。大小分别为211 bp、720 bp、121 bp和136 bp。设计引物(表1)PCR扩增得到4个目的片段,再使用融合PCR的方法得到完整的微基因组片段。用限制性内切酶EcoRⅠ和PstⅠ对微基因组和pOK进行酶切,电泳鉴定后进行胶回收纯化,然后进行连接转化,挑取菌落做菌液PCR鉴定,将阳性克隆送北京擎科新业生物技术有限公司测序鉴定,得到阳性质粒pOK-M。

表1用于扩增微基因组片段的引物
1.5辅助质粒的构建设计引物(表2)利用PCR方法获得3种辅助蛋白NP、P、L的目的片段,用特定的限制性内切酶对目的片段和表达载体pCI-neo进行酶切,酶切后对目的片段进行胶回收纯化,然后将相应的目的片段与载体进行连接转化,挑取菌落做菌液PCR鉴定,将阳性克隆进行测序鉴定。其中对NP、P和pCI-neo载体用XholⅠ和EcoRⅠ进行酶切。由于L基因组较长,采用了分段克隆的方式进行拼接并转移到pCI载体中。将得到阳性质粒分别命名为pCI-NP、pCI-P和 pCI-L。
1.6辅助质粒功能的鉴定采用Lipofectamine 2 000转染试剂盒说明书方法,将pOK-M、pCINP、pCI-P和pCI-L 4种质粒共2 μg按照2∶2∶1∶1转染培养于6孔板的BSR T7/5细胞,设置缺少pCI-L转染的阴性对照,37℃下作用5 h,更换含有10%胎牛血清的DMEM。37℃、5%CO2条件下继续培养24 h,在荧光显微镜下观察报告基因的表达情况。

表2用于扩增NP、P、L的引物
2结果
2.1微型基因组的构建NDV的微基因组分为四部分,其中M1片段包括EcoRⅠ酶切位点、T7启动子和cDNA的3′UTR,M2为反向互补的EGFP,M3为cDNA的5′UTR,M4包含核酶序列、T7终止子和PstⅠ酶切位点,M为上述4个片段经融合PCR后的产物,PCR产物经胶回收测序比对后,序列正确,PCR扩增结果如图1所示。
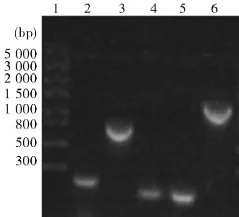
图1微基因组4部分及融合PCR产物的电泳鉴定
2.2辅助质粒的构建PCR扩增得到的NP、P、L1、L2、L3基因片段大小分别为1.5 kb、1.2 kb、1.5 kb、2.2 kb和2.8 kb,PCR产物胶回收后测序,与原测序结果比对,序列正确,无突变,电泳鉴定结果如图2所示。采用常规连接转化的方法克隆到pCI-neo载体中,经测序鉴定后得到3种辅助质粒,命名为pCI-NP、pCI-P、pCI-L。

图2NP、P和L基因PCR产物的电泳鉴定
2.3辅助质粒功能的鉴定pOK-M、pCI-NP、pCIP和pCI-L 4种质粒共转染BSR T7/5细胞24 h后,通过倒置荧光显微镜观察,在转染的细胞中可观察到明显的特异性绿色荧光(图3A),表明报告基因EGFP得到表达,说明辅助质粒的表达产物具有功能活性,可以启动微基因组的复制和转录。而在阴性对照组中未观察到荧光(图3B)。

图3转染BSR T7/5细胞24 h后特异性荧光的观察结果
3讨论
ClassⅠ型NDV毒株多是弱毒株或无致病性的毒株,主要存在于野生鸟或水禽中。近年来,在我国大陆、香港、台湾等活禽市场中均能分离到ClassⅠ型NDV毒株,而Yu等的研究证明,某些ClassⅠ型弱毒株在鸡体内经过传代会发生毒力增强的现象[7],可能造成ND的流行。由于该类病毒在各种鸟类中广泛存在,不同毒株混合感染还可能会造成不同毒株的重组,使得ND的防治变得更加复杂。
反向遗传技术已经成为NDV研究不可或缺的技术平台,也被称为“病毒拯救”[7]。NDV的拯救首先要构建3种辅助质粒,分别为表达NP、P、L蛋白的质粒,这3种质粒对NDV的复制、转录起着重要作用,而微基因组一般作为检测辅助质粒生物活性的工具。本研究通过PCR技术扩增出NP、P、L基因,并分别成功克隆到pCI-neo载体上,经测序鉴定,扩增的目的片段序列正确。其中L片段分3段进行克隆。为了检测这3种辅助质粒的活性,本研究又构建了NDV的微基因组。NDV的微基因组是包含了病毒全长基因组3′和5′末端UTR(非编码区)序列,并用反向互补的EGFP(绿色荧光蛋白)替代其间的编码区序列所构成的一种缺损病毒,需要辅助蛋白的帮助才能完成编码区蛋白(EGFP)的表达。因此,微基因组中EGFP的表达可以说明构建的辅助质粒具有表达活性。
本研究利用构建的微基因组质粒pOK-M对构建的3个辅助质粒活性进行鉴定。结果表明,共转染的BSR T7/5细胞中可观察到特异性荧光,说明3个辅助质粒均有表达活性,为进一步建立该病毒的反向遗传操作平台奠定了基础。
[1]Czegledi A,Ujvari D,Somogyi E,et al.Third genome size category of avian paramyxovirus serotype 1(Newcastle disease virus)and evolutionary implications[J].Virus Res,2006,120:36-48.
[2]Locke D P,Sellers H S,Crawford J M,et al.Newcastle disease virus phosphoprotein gene analysis and transcriptional editing in avian cells[J].Virus Res,2000,69:55-68.
[3]Krishnamurthy S,Samal S K.Nucleotide sequences of the trailer: nucleocapsid protein gene and intergenic regions of NDV strain Beaudette C and completion of the entire genome sequence[J].J GenVirol,1998,79:2419-2424.
[4]Ganar K,Das M,Sinha S,et al.Newcastle disease virus:current status and our understanding[J].Virus Res,2014,184:71-81.
[5]Alexander D J,Wilson G W C,Russell P H,et al.Newcastle disease outbreaks in fowl in Great Britain during 1984[J].Vet Rec,1985,117:429-434.
[6]Shengqing Y,Kishida N,Ito H,et al.Generation of velogenic Newcastle disease viruses from a nonpathogenic waterfowl isolate by passaging in chickens[J].Virology,2002,301(2):206-211.
[7]赵长光,宋松林,赵继勋,等.新城疫病毒反向遗传技术研究进展[J].中国兽医杂志,2011,47(10):56-59.
Construction and Identification of Mini-genomeof ClassⅠNewcastleDiseaseVirus Strain BJ 1
CHENG Jin-long1,LIU Meng-meng1,HU Nan2,ZHANG Guo-zhong1
(1.College of Veterinary Medicine,China Agricultural University,Beijing 100193,China;2.Beijing Animal Husbandry Station,Beijing 100107,China)
To examine the efficiency of the mini-genome rescue system,BSR-T7/5 cells were co-transfected with pOK-M,pCI-NP,pCI-P,pCI-L.The results showed that the green fluorescence was observed in the co-transfected group,but there was no green fluorescence in the control groups in 24 h.The result indicated that the NP,P and L proteins were all expressed.In conclusion,we established a mini-genome system that could be applied to the recovery of NDV BJ1 strain.
NDV;ClassⅠ;Mini-genome;Reverse genetics;Helper plasmids
ZHANG Guo-zhong
S852.65+9.5
A
0529-6005(2016)08-0009-03
2015-05-05
现代农业产业技术体系北京市家禽创新团队专项资金(CARS-PSTP)
程晋龙(1993-),男,本科生,就读于预防兽医学专业,E-mail:15611528256@163.com
张国中,E-mail:zhanggz@cau.edu.cn

