碳酸钠的制备与含量测定实验的改进
孙雨丽, 李 珺, 石 晨
(首都医科大学 化学生物学与药学院, 北京 100069)
碳酸钠的制备与含量测定实验的改进
孙雨丽, 李珺, 石晨
(首都医科大学 化学生物学与药学院, 北京100069)
以“侯氏制碱法”为原理,用碳酸氢铵和氯化钠制备了碳酸钠,并测定其含量,以传统方法为基础,对碳酸钠的制备和含量的测定步骤做了进一步的改进。探索了制备碳酸钠的条件和产率,比较了双指示剂法和电位滴定法等测定碳酸钠含量的方法。通过无机化学和分析化学实验中碳酸钠的制备与含量的测定实验,促进了学生实验技能的培养。
碳酸钠制备; 双指示剂法; 电位滴定法
1 碳酸钠制备法简介
碳酸钠是一种重要的无机原料,可以用于合成银纳米颗粒的控制剂[1]、测定血红蛋白的稀释液[2]和提高铁矿的回收率[3]等,碳酸钠的制备也得到广泛的重视。1861年,索尔维发明了氨碱法制备碳酸钠,原理如下:
CaCO3CaO+CO2↑
NaCl+NH3+CO2+H2ONaHCO3+NH4Cl
2NaHCO3Na2CO3+H2O+CO2↑
CaO+H2O=Ca(OH)2
2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O
这种方法可使制备过程中的二氧化碳和氨气循环利用,不造成过多的浪费,但是副产物氯化钙废料的产出比重过大,原子利用率仅48.8%。1941年,侯德榜在索尔维制碱法的基础上进行了改进,发明了侯氏制碱法,即把碱厂和氨厂联合在一起,利用生产氨的产物二氧化碳为原料,制备出最终产物纯碱和氯化铵,氯化铵直接作为肥料,原子利用率提高到了100%[4],且提高了食盐的利用率,高达96%以上[5],其原理为:
NaCl+NH3+CO2+H2ONaHCO3+NH4Cl
2NaHCO3Na2CO3+H2O+CO2↑
本实验模拟侯氏制碱法,直接采用其本质进行实验室制碱[6],并测定其含量,反应方程式如下:
NH4HCO3+NaClNaHCO3+NH4Cl
2NaHCO3Na2CO3+CO2↑+H2O
通过对实验内容进行改进和优化,帮助学生进一步理解侯氏制碱法原理,学习通过本质简化复杂实验,练习无机化学实验中物质的制备;在此基础上,测定混合碱的含量、比较传统化学分析中酸碱滴定法的双指示剂法和仪器分析中的电位滴定法的操作。
2 传统方法的不足及本实验的改进
2.1传统方法的不足
(1) 碳酸钠的工业制法是将氨气和二氧化碳通入饱和食盐水中,但在实验室中制备氨气和二氧化碳步骤繁琐。因为氨气由浓氨水和氢氧化钠反应而成,而浓氨水有强挥发性和刺激性,为避免空气污染,氨气发生装置的气密性必须非常良好,且需要尾气处理装置。为避免原料二氧化碳的流出,也需要装置具有严格的气密性,这在实验过程中并不能完全保证,也影响了实验效果。
(2) 碳酸氢钠加热生成碳酸钠中,传统方法用到了马弗炉或可调电炉[7],仪器要求较高,且在学生实验中,马弗炉或电炉具有一定的危险性。
(3) 在测定制备出的碳酸钠产品纯度时,双指示剂法第二步继续滴加盐酸到溶液呈橙色的时候,直接记录了V2体积,容易造成极大的误差。
(4) 测定纯度使用的指示剂法,由于操作者对实验中的颜色变化不能准确把握,容易造成误差。
2.2本实验的改进
针对以上不足作出了如下改进:
(1) 直接采用碳酸氢氨与饱和食盐水反应,避免了气体漏出和污染空气的问题,同时也体现了实验的本质。
(2) 用酒精灯代替马弗炉或电炉,酒精灯在实验中比较常见,而且可以达到制碱的要求,减少了学生实验的难度,避免了使用马弗炉高温操作而导致的安全隐患。
(3) 针对双指示剂法造成的误差做了对比试验,改进方案是在第二步滴定指示剂变色后,将锥形瓶放入水浴锅中加热1~2 min,若颜色变回黄色,需补加盐酸,重新记录V2。
(4) 与双指示剂法比较,可使用电位滴定的方法[8]。电位滴定法在工业生产上具有用时短、操作简便等优点[9],实验室测定含量时可以避免因为颜色变化不明显导致的误差。
3 实验内容
3.1碳酸钠的制备
(1) 称取25 g氯化钠于200 mL烧杯中,量取100 mL蒸馏水倒入烧杯,不断搅拌使氯化钠溶解,制备出饱和食盐水(此步可调pH为11以上,除去杂质离子,提高产率)。再称取8.5 g碳酸氢氨,分5~8次(有利于提高产率)加入饱和食盐水中,溶解后放在水浴锅中加热,保持30~35 ℃,不断搅拌(此步可盖住部分瓶口,减少水分蒸发[10]),30 min后取出静置。
(2) 将静置的溶液用布氏漏斗减压过滤,吸去母液,抽滤至干,洗涤3~4次,得到白色固体。
(3) 将白色固体转入蒸发皿,石棉网上小火烘干,再移入坩埚,酒精灯上加热,用玻璃棒轻轻搅拌(反应进行更充分),加热约30 min,得到干燥白色细粉末状固体,冷却到室温,称重。
3.2碳酸钠含量的测定
3.2.1盐酸标准溶液的标定
精确称取3份约0.5 g硼砂于锥形瓶中,加入约40 mL蒸馏水溶解(水量过少会导致部分不溶),滴入甲基红指示剂1~2滴,用盐酸(约0.1 mol/L)滴定,滴定至溶液由黄色变为橙色且30 s后不恢复即为终点。平行滴定3次,并记录消耗盐酸体积。计算盐酸标准溶液的浓度。
3.2.2双指示剂法
精确称取产品碳酸钠0.11 ~0.14 g 3份于锥形瓶中,加入50 mL左右的蒸馏水溶解,滴入2滴酚酞(也可用甲酚红-百里酚蓝指示剂代替,颜色变化更敏锐 ),此处酚酞可多加1滴,有利于终点颜色的判断[11],用盐酸滴定至溶液呈无色且0.5 min内不恢复,可用终点标准比色液帮助确定终点[12],记录消耗盐酸体积V1。
(1) 传统方法。再滴加1滴甲基橙(此处甲基橙的量应尽可能少,否则将影响终点颜色的判断 ),继续滴定至溶液由黄色变为橙色即为终点,记录此步消耗盐酸的体积V2。计算碳酸钠的含量。若双指示剂法颜色变化不易观察,可用电导滴定法代替[13]。
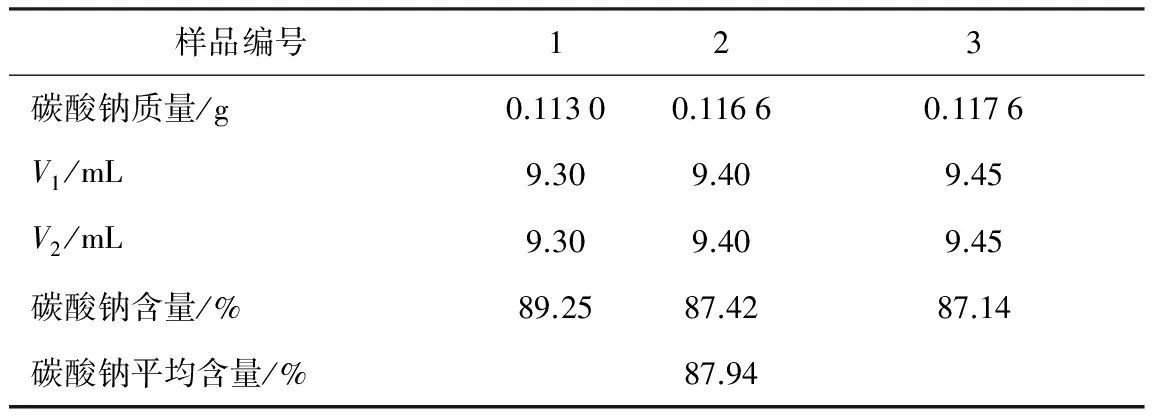
(2) 改进方法。再滴加1滴甲基橙,继续滴定至溶液由黄色变为橙色,记录消耗盐酸的体积V2,将锥形瓶放入水浴锅中,加热约1~2 min,观察溶液颜色是否变回黄色,若变回黄色,则需补加盐酸,重新记录V2。计算碳酸钠的含量。
3.2.3电位滴定法
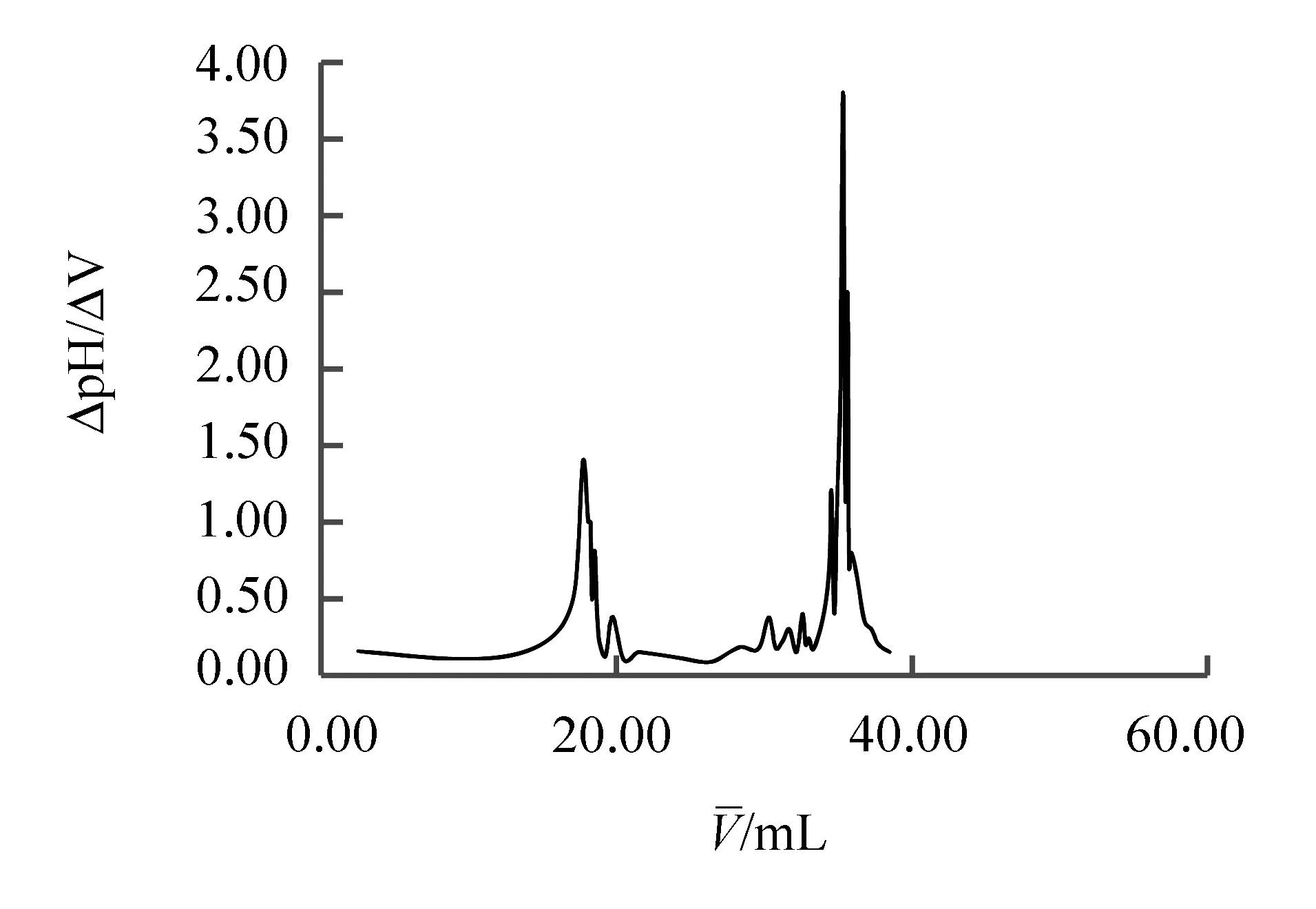
精确称取产品碳酸钠0.21 g于烧杯中,加入50 mL左右的蒸馏水溶解。放入搅拌子,将pH计插入溶液中(pH电极不要触碰到搅拌子)。开启电磁搅拌器,用盐酸滴定,接近终点时控制滴定速度,pH趋于稳定时结束滴定。平行滴定2次,记录滴入盐酸的体积V和溶液的pH。以△pH/△V为纵坐标,以V为横坐标绘制△pH/△V-V曲线,确定滴定终点。
4 实验结果和讨论
4.1产率

4.2Na2CO3纯度的测定
4.2.1双指示剂法
混合碱溶液中含有NaOH、NaHCO3、Na2CO3,测定各成分含量一般用双指示剂法[14],向滴入酚酞的混合碱溶液中滴加盐酸,至溶液由红色变为无色,此时消耗盐酸的体积为V1,再滴入甲基橙,继续滴加盐酸,至溶液变为橙色,此步消耗盐酸体积为V2。
若V1>V2,则溶液为Na2CO3和NaOH混合物,各组分含量为:
若V1 若V1=V2,则溶液不含NaHCO3。 (1)传统方法。用硼砂标定盐酸,平行滴定3次取平均值得盐酸浓度为0.1043 mol/L,RSD=0.29%。以此浓度的盐酸滴定产品碳酸钠,碳酸钠纯度为88.11%,见表1。根据混合碱双指示剂法原理,上述数据V1>V2,符合第一种情况,理论上产品应含有碳酸钠和氢氧化钠,但理论上本实验并没有氢氧化钠产生。此方法误差较大,影响实验结论。 表1 盐酸滴定碳酸钠的记录(指示剂:酚酞,甲基橙) (2) 改进方法。硼砂滴定盐酸,平行滴定3次取平均值测得盐酸浓度为0.102 3 mol/L,RSD=0.20%。以此浓度的盐酸滴定产品碳酸钠,碳酸钠纯度为87.94%,见表2。改进方法数据中V1=V2,产品不含NaHCO3。这是因为改进方法在滴定碳酸钠的时候增加了水浴加热,目的是将原本溶液中的CO2赶出去,否则滴定终点会提前到达,造成误差。同时也说明了本实验最后一步灼烧碳酸氢钠制备碳酸钠反应是完全的,酒精灯完全可以满足需求,不需要用高要求、较危险的马弗炉或可调电炉。 表2 盐酸滴定碳酸钠的记录(指示剂:酚酞,甲基橙) 4.2.2电位滴定法 用盐酸滴定产品Na2CO3,记录消耗盐酸的体积V和溶液的pH,用一阶微商法计算Na2CO3的纯度,绘制Na2CO3的△pH/△V-V曲线,曲线第一个峰值所对应的体积即为滴定终点时消耗盐酸的体积Ve。公式如下: 用硼砂滴定盐酸,平行滴定3次取平均值测得盐酸浓度为0.090 3 mol/L;RSD=0.11%。用此浓度的盐酸滴定产品碳酸钠,取平均值,见图1。 图1 盐酸滴定碳酸钠的一阶曲线 取测定的平均值,即产品中Na2CO3的含量为84.16%。电位滴定法消除了指示剂法依赖人体感官判断所造成的误差,使测定结果更为精确,且电位滴定法计算的实验结果比双指示剂法简洁明确。 4.3注意事项 (1) 碳酸氢氨不易溶于饱和食盐水中,分次加入时可在水浴中微热,有利于提高碳酸氢氨的溶解度。 (2) 碳酸钠制备第二步产生的母液中含有氯化铵,直接排放会污染环境,所以可加一步母液处理[5],即向母液中加入过量食盐,析出氯化铵晶体。 本文对碳酸钠制备的传统方法进行了改进,改进后的方案提高了学生实验的可操作性和实验效果。 (1) 比较了不同方法下的碳酸钠制备和含量测定,改进了文献中马弗炉300 ℃加热、电炉加热等步骤。考虑到实验室学生操作安全性和方便性,改用酒精灯加热,结果表明,改进方案可以制备出碳酸钠。 (2) 传统教材中,碳酸钠制备、混合碱含量测定分别作为单独的实验,本实验将无机制备与定量分析结合,合并成综合实验。综合性实验可以锻炼学生的多学科交叉、综合分析问题的能力。 (3) 练习了双指示剂法和电位滴定法,培养学生从多方面思考解决问题的能力。 (4) 可以结合实验来讲解理论书上判断混合碱的种类和含量测定的内容,从而掌握复杂体系中酸碱滴定的知识和具体方法。 (5) 通过滴定分析所制备的碳酸钠,给学生讲解分步滴定的原理、条件和方法,比较有水浴加热和没有水浴加热结果的区别和反应机理。 (6) 通过比较双指示剂法和电位滴定法测定含量的准确性,学习针对不同实验可能出现的误差情况选择合适的实验方法。 References) [1] 张竹霞,邵桂雪,刘海瑞,等.控制剂碳酸钠辅助微波合成球形纳米银颗粒[J].稀有金属材料与工程,2013,42(4):809-813. [2] 张和发.碳酸钠法测定血红蛋白的探讨[J].皖南医学院学报,1997,15(4):437-438. [3] Hu W T,Wang H J,Liu X W,et al. Effects of minerals in ferric bauxite on sodium carbonate decomposition and volatilization [J]. Journal of Central South University,2015(7):2503-2507. [4] 白玉山,于鹦.侯氏制碱法中的绿色化学思想[J].习题与解题思路,2004(9):47-49. [5] 曹子英.工业碳酸钠提纯过程的杂质驻留与去除研究[J].当代化工,2015,44(4):847-849. [6] 陆丽洁,刘丽君.模拟工业制备纯碱的实验设计[J].化学教育,2014(1):52-54. [7] 周贤亚,聂丽.无机化学实验项目改进创新:以“碳酸钠的制备”为例[J].化学教育,2014(14):37-38. [8] 姚小红,张涤,柳莉,等.用电位滴定法测定工业用氢氧化钠中氢氧化钠和碳酸钠的含量[J].现代科学仪器,2006(4):96-97. [9] 叶芝峰.电位滴定—线性神经网络法用于工业碳酸钠的测定[J].纯碱工业,2014(6):13-16. [10] 范文杰,蔡晗,郭青青,等.碳酸氢钠晶体的制备[J].化工高等教育,2014(5):47-50. [11] 沈巧莲.双指示剂法测定混合碱实验条件的优化[J].金华职业技术学院学报,2007,7(2):78-80. [12] 崔敏,吕仁庆,李儒奕,等.混合碱溶液滴定实验中指示剂的改进[J].当代化工,2015,44(7):1618-1620. [13] 王方阔,张帅,张燕.纯碱化合物的制备及产品纯度分析[J].广东化工,2013,40(20):93-94. [14] 陈若愚,朱建飞.无机与分析化学实验[M].2版.北京:化学工业出版社,2010:111-112. Improvement of experiment of preparation and content determination of sodium carbonate Sun Yuli, Li Jun, Shi Chen (School of Chemical Biology and Pharmaceutical Sciences, Capital Medical University, Beijing 100069, China) Based on the principle of “Hou’s process for soda production,”sodium carbonate is prepared by using ammonium bicarbonate and sodium chloride, and its content is measured. The preparation and steps for the content determination of sodium carbonate by using the traditional method are improved, and the conditions for preparation and the productivity are explored. To determine the content of the products, the double-indicator method and potentiometric titration method are compared. Through the preparation and content determination of sodium carbonate in the experiments of inorganic chemistry and analytical chemistry, the students’experimental skills are well trained. preparation for sodium carbonate; double-indicator method; potentiometric titration method 10.16791/j.cnki.sjg.2016.10.049 实验课程改革 2016-04-12 北京市教委专项(PXM2013-014226-07- 000025;PXM2013-014226-07-000001);首都医科大学本科生科研创新项目(xsky2015046);首都医科大学第二课堂项目(drkt2015042) 孙雨丽(1996—),女,北京,本科生,药学专业 李珺(1974—),女,湖北嘉鱼,博士,副教授,主要从事药物分析的研究.E-mail:lijun88@ccmu.edu.cn O658 A 1002-4956(2016)10-0196-03
5 结语

