纬向不同地理种群栓皮栎虫食特征及其与气象因子的关系
王小菲 倪妍妍 高文强 刘建锋* 江泽平
(1.中国林业科学研究院林业研究所,北京 100091; 2.国家林业局林木培育重点实验室,北京 100091)
纬向不同地理种群栓皮栎虫食特征及其与气象因子的关系
王小菲1,2倪妍妍1,2高文强1,2刘建锋1,2*江泽平1,2
(1.中国林业科学研究院林业研究所,北京 100091;2.国家林业局林木培育重点实验室,北京 100091)
昆虫对叶片的取食是植物群落的普遍特征,为了探讨纬度和气象因子对虫食作用的影响,本文调查了我国纬向6个地理区域(北纬26°~40°,约跨14°)栓皮栎叶片虫食特征及分布格局,结果表明:(1)不论成年树还是幼树栓皮栎,叶片虫食率和虫食频度随纬度的减小呈显著增加的趋势(P≤0.05);(2)比较各地理区域虫食结构特征发现,随纬度的减小,成年树和幼树栓皮栎其未受虫食叶片的比例逐渐减少,甚至趋于0,而受中、强度虫食(>25%)的叶片的比例逐渐增加;即低纬度地区具有更强的虫食作用;(3)除了低纬度样点(湖南城步)外,其余各区域栓皮栎叶片其虫食程度主要集中在0.5%~5%;(4)双因素方差分析表明栓皮栎在不同个体发育阶段受虫食作用存在显著差异,总体表现出幼树叶片虫食率显著高于成年树(P<0.05);(5)不同地理区域栓皮栎成年树及幼树叶片的虫食率、虫食频度与年降雨量呈显著正相关(P<0.05),而与年均温无显著相关关系;同时,成年树和幼树叶片的虫食频度与极端最低温呈显著正相关(P<0.05)。
栓皮栎;地理尺度;植食作用;气象因子;防御
昆虫对叶片的取食是植物群落的普遍特征[1],昆虫作为动物界种类最多的类群,其中的三分之一(大约35万种)是植食性昆虫,他们对植物施加的选择压力不容忽视[2]。在长期互作中,有些植物被淘汰,有些则繁荣昌盛。然而,植物受昆虫侵害,可直接表现为叶面积损失以及叶肉组织损伤,这不仅影响植物的光合产量,进而影响植物生长、发育和生殖等,而且还影响植物竞争的结果和群落的组成,最终将对群落的生物多样性、植物的区域环境适应以及植物的进化产生重要影响[3~5]。有研究发现[6]在低纬度的热带森林,每年约有11%的叶产量被虫食;在我国西双版纳等热带次生林中,唐建维等[7]发现受虫食的林分叶片损失量超过总生物量的20%以上,郑征等[8]发现西双版纳热带雨林6种林窗内幼树的叶片虫食率超过30%,Bazzaz等[9]甚至发现在热带森林中植物受虫害的损失接近于其在自身生殖上的投入。然而,植物为了抵抗昆虫的啃食,也会从形态、生理等方面形成了防御外界胁迫的生存策略[10~12]。由于植物本身缺乏移动的能力,植物为抵抗昆虫等生物的危害,在各种生态胁迫的长期演化下,植物也会发展提高自身的防御能力来抵御外界胁迫[13~14],这可能是地球上现存植物在自然演化过程中,屡经害虫猖獗而没有灭绝的重要原因之一[15]。可以说虫食作用对于植物所造成的压力是植物形成防御策略的一个主要因素,二者之间的相互作用也一直深人们的关注[14,16~17]。因此,通过分析不同地理区域上植物受虫食特征及受害程度,对于研究植物防御策略、区域环境适应以及优良植物资源选育等具有重要的理论和现实意义。
目前我国对于植物虫食作用的相关研究多集中在某一小范围区域上[8,18~19],而对不同区域环境下的虫食特征等相关研究鲜有报道。栓皮栎(Quercusvariabilis)是东亚地区分布最广的树种之一,具有较强的适应性,在我国其分布区可北起辽宁,南至云南、广东等地,纬度跨度从25°~40°,气候梯度依次横跨了中温带、暖温带、北亚热带、中亚热带和南亚热带,是我国亚热带、暖温带落叶阔叶林中具有代表性的树种之一[20],同时也具有较大的经济和生态价值。因此,本文以栓皮栎为研究对象,调查和分析不同地理区域(纬向上)栓皮栎天然种群的虫食特征,同时考虑到植物在不同发育阶段的营养、生殖和防御策略的差异可能会影响昆虫的取食,因而对成年树和幼树分开调查并对比,结合气象因子,进一步探讨植物不同发育阶段虫食特征随纬向的变化规律及其与气象因子的关系,为理解植物防御策略的地理变异及其驱动机制等相关研究提供理论基础。
1 材料与方法
1.1 样点选择
根据栓皮栎在我国的分布情况,在其分布区域内选取6个纬度点的天然次生林分作为调查样点,样点纬度范围在26°~40°N,约每跨2°为一个纬度取样点(图1,表1)。
由于各样点地理跨度较大,为确保采样工作大致在植物生长的同一个物候期,本文参照龚高法等[21]提出的我国植物物候期的地理分布规律,来推算各地采样点的物候期推移时间(即物候期近似日期)。在我国的地理条件下的物候期推算公式可表示为:
Y=a+b(φ-30°)+c(λ-110°)+dh
(1)
其中,Y表示植物的物候期;φ表示纬度;λ表示经度;h表示海拔(100 m);a,b,c,d为系数。
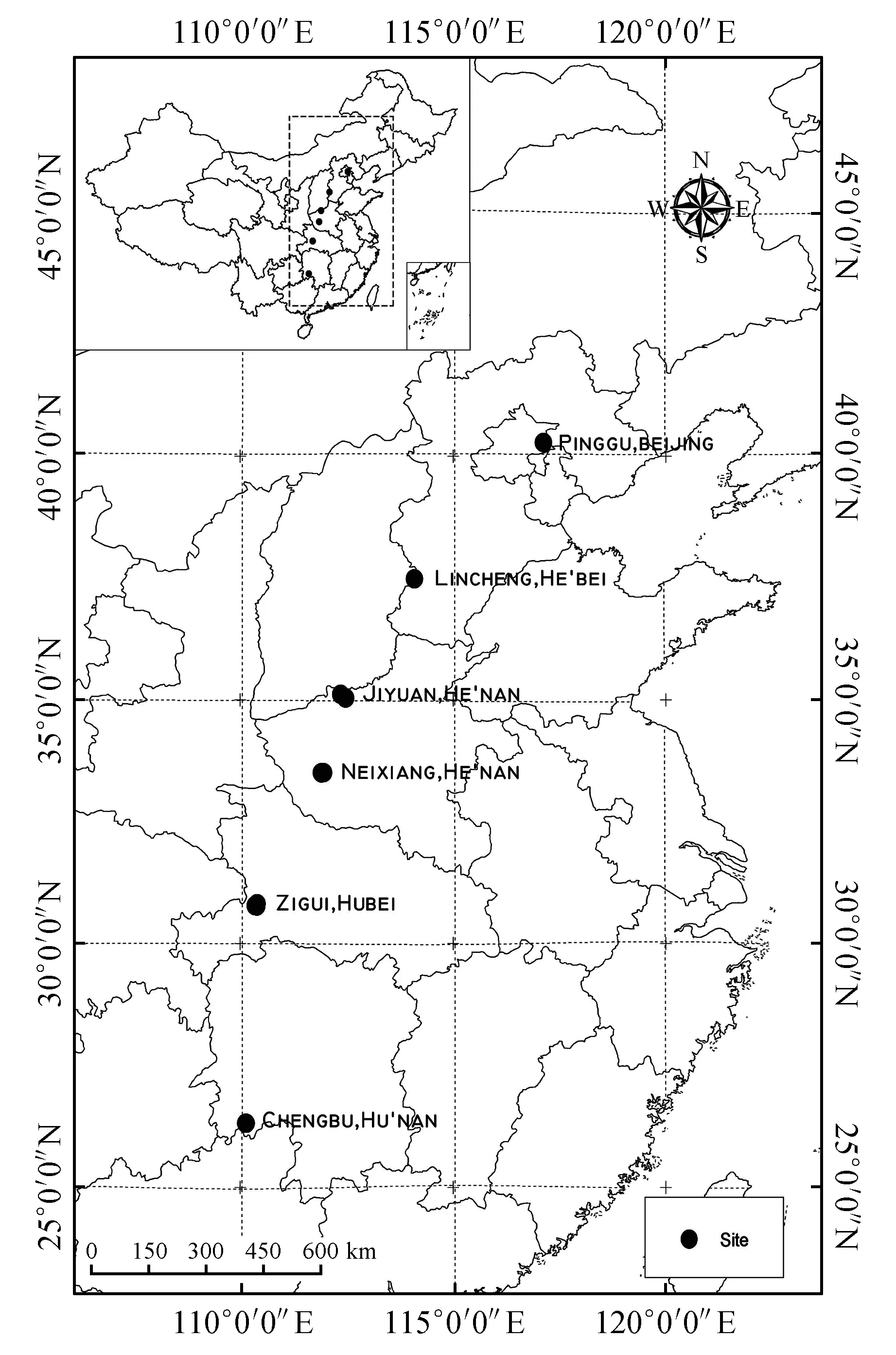
图1 栓皮栎取样位置分布图Fig.1 Map of the sampling sites of Q.variabilis in China
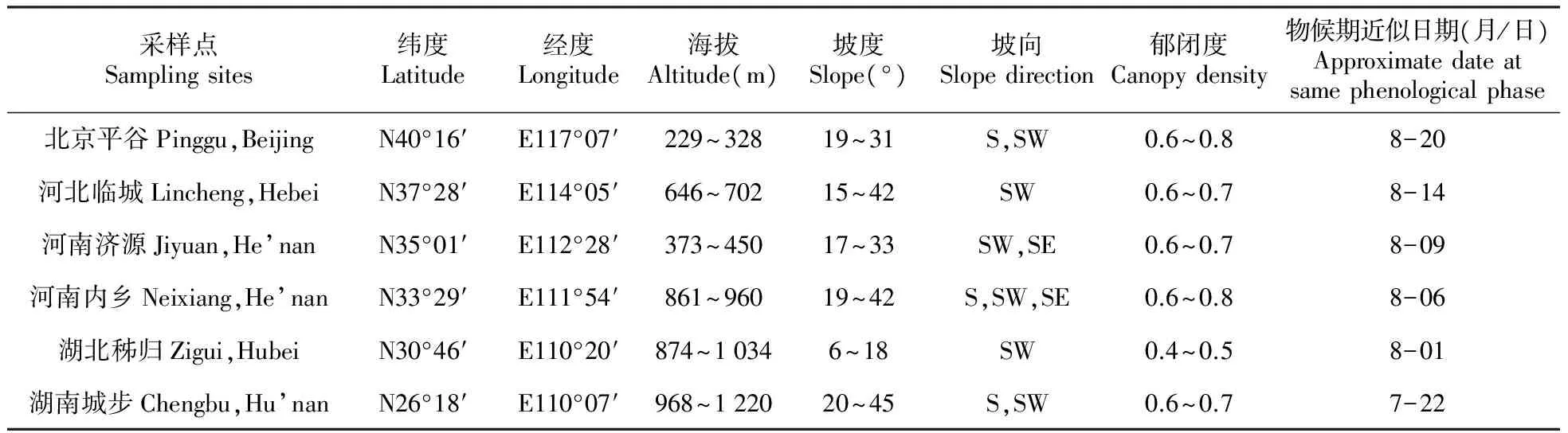
采样点Samplingsites纬度Latitude经度Longitude海拔Altitude(m)坡度Slope(°)坡向Slopedirection郁闭度Canopydensity物候期近似日期(月/日)Approximatedateatsamephenologicalphase北京平谷Pinggu,BeijingN40°16′E117°07′229~32819~31S,SW0.6~0.88-20河北临城Lincheng,HebeiN37°28′E114°05′646~70215~42SW0.6~0.78-14河南济源Jiyuan,He’nanN35°01′E112°28′373~45017~33SW,SE0.6~0.78-09河南内乡Neixiang,He’nanN33°29′E111°54′861~96019~42S,SW,SE0.6~0.88-06湖北秭归Zigui,HubeiN30°46′E110°20′874~10346~18SW0.4~0.58-01湖南城步Chengbu,Hu’nanN26°18′E110°07′968~122020~45S,SW0.6~0.77-22
注:以北京平谷地区(40°16′ N)8月20日为标准参照的起始日期进行推算。
Note:Starting from a “standard” date of 20thAugust in Pinggu,Beijing at 40°16′N,the following sampling times are estimated to be equivalent in terms of biological activity.
文献计算和提供了大致能代表我国春夏秋三个季节自然物侯期,因而系数参照与栓皮栎物候期最为接近的板栗树种。具体取样和调查时间见表1。
1.2 调查方法
叶片虫食观测采用非连续的随机取样调查[8,22]。在每一个确定的林分区域内,统一选择阳坡或向阳地带,地形均一的地段为调查样地,每个纬度带选择3块样地,每块样地选择生长良好的3棵成年树和3棵幼树,其株高和胸径详见表2。随机取每棵样树不同方位可受太阳光照的枝条不少于5个,每个枝条统一保留前20片叶子进行统计和调查,即每个纬度带总计调查1 800片(20片×5个枝条×9棵样树×2个个体发育阶段=1 800片/纬度带),样本数远高于Morrow等[23]、王宏伟等[19]的取样要求。逐一识别虫食叶片[24],其中有明显被风吹烂或者枝条掉落等并非昆虫啃食造成的叶片不计入虫食统计内。测定内容包括虫食频度和叶片虫食率[24~25],计算公式如下:

(2)
(3)
其中,叶片虫食率使用叶面积扫描仪(Leaf Area Meter,Yaxin-1241,北京)测量叶片虫食面积和潜在的完整叶片面积(可使用带颜色的纸片盖住虫食部分再次扫描获得潜在的完整叶片面积)。另外,根据叶片受虫食程度的大小将其划分7级进行统计:L0:未虫食叶片(将虫食率小于0.5%的叶片视为未虫食叶片);L1:叶片被啃食0.5%~5%;L2:叶片被啃食5%~15%;L3:叶片被啃食15%~25%;L4:叶片被啃食25%~50%;L5:叶片被啃食50%~75%;L6:叶片被啃食75%以上。

表2 样木树形因子调查表
注:表中数值=平均值±标准偏差
Noet:Values are mean±SE
1.3 气象数据
本文中涉及的气象数据从美国国家海洋和大气局(National Oceanic and Atmospheric Administration)气象数据中心(NCDC)网站(http://www.ncdc.noaa.gov/)下载获得。主要气象变量包括年平均温度(annual mean temperature,℃)、最冷月的最低温(minimum temperature of the coldest month,℃)、最热月的最高温(maximum temperature of the warmest month,℃)、年总降雨量(annual precipitation,mm)等。将我国各站点2014年数据导入ArcGIS v10.0使用Kriging空间插值法(考虑海拔对温度的影响)进行拟合,根据样地经纬度坐标提取所需气象数据。
1.4 数据分析
所有数据使用R软件(version 3.0.3 http://www.r-project.org/)分析处理,叶片虫食率和虫食频度与纬度的关系采用简单线性回归分析方法;不同个体发育阶段和不同地理区域植物叶片的虫食特征采用two-way ANOVA方差分析进行差异显著性检验。考虑到不同纬度地理区域的海拔差异较大,为了真实反映纬度效应,采用Lindgren[26]的等效纬度概念,按下式将实际纬度换算成等效纬度(Equivalent latitude)后进行统计分析及制图:
当海拔低于300 m,等效纬度=实际纬度+(海拔-300)/200;
当海拔高于300 m,等效纬度=实际纬度+(海拔-300)/140。
2 结果与分析
2.1 叶片虫食的纬向地理分布格局
由图2A可以看出,不论成年树还是幼树,随着等效纬度的降低栓皮栎叶片虫食率呈显著增加的趋势(P成年树=0.05,P幼树=0.03),成年树虫食率从5.56%(北京)增加至22.91%(湖南城步),幼树从5.08%(北京)增加至29.77%(湖南城步);同样,叶片虫食频度随纬度的减小而显著增加(P成年树=0.005,P幼树=0.01),成年树从59.17%增加至99.17%,幼树从63.00%增加至98.67%,从湖北秭归往南叶片虫食频度已接近100%,即低纬度地区具有更强的虫食作用。相比等效纬度,叶片虫食率、虫食频度与实际纬度之间同样显示显著的负相关关系(图2:B),与纬度校正后的结果一致。
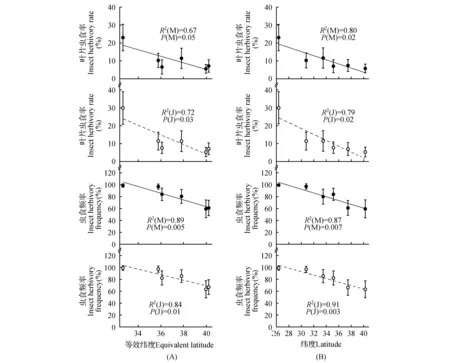
图2 栓皮栎叶片虫食率和虫食频度随纬度变化 ●和○分别为成年树和幼树各900片叶子样本虫食调查的平均值;---为成年树简单线性回归拟合;为幼树简单线性回归拟合Fig.2 Insect herbivory rate and frequency change across latitudinal gradients ● and ○ refer to the mean values of 900 leaf samples in mature and juvenile trees,respectively;--- is fitted line of mature trees; is fitted line of young trees
根据双因素方差分析结果表明(表4),不同纬度对栓皮栎叶片虫食率和虫食频度产生显著影响(P<0.001);叶片虫食率在不同个体发育阶段存在显著差异(P=0.017);植物个体发育阶段和纬度的交互作用同样显著影响叶片虫食率(P<0.001)。
表3纬向不同区域栓皮栎叶片虫食率和虫食频度比较
Table3Comparisonofnsectherbivoryrateandfrequencyamongtwoontogeneticstagesandsixsites
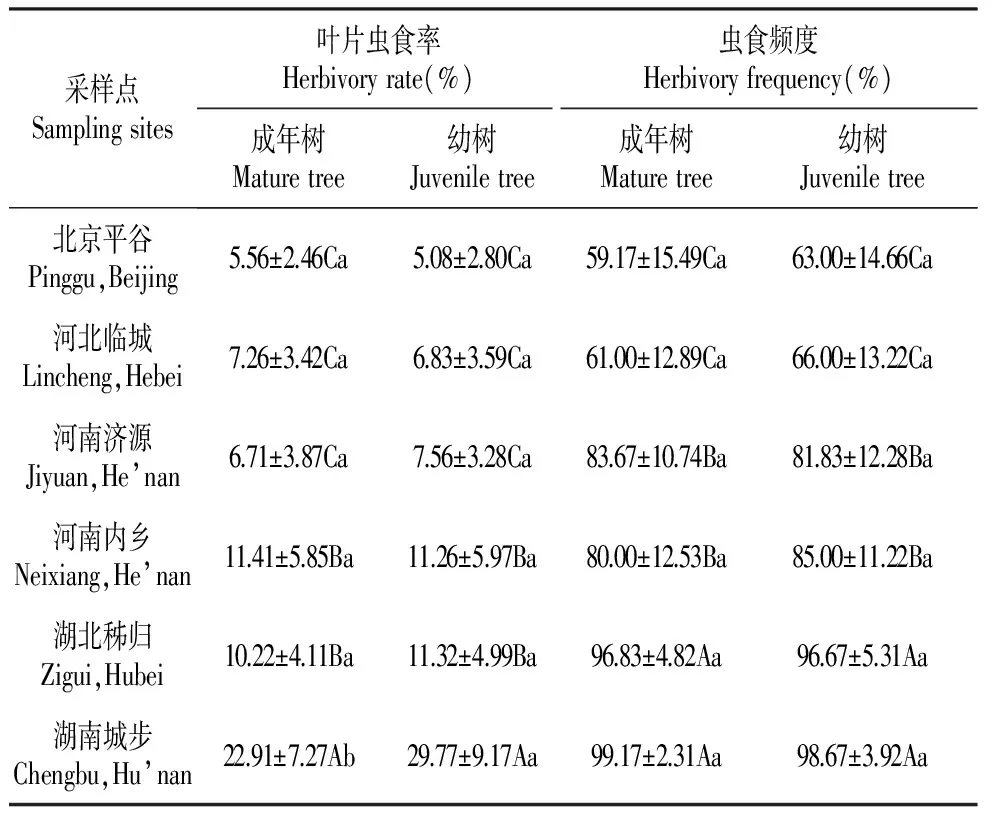
采样点Samplingsites叶片虫食率Herbivoryrate(%)虫食频度Herbivoryfrequency(%)成年树Maturetree幼树Juveniletree成年树Maturetree幼树Juveniletree北京平谷Pinggu,Beijing5.56±2.46Ca5.08±2.80Ca59.17±15.49Ca63.00±14.66Ca河北临城Lincheng,Hebei7.26±3.42Ca6.83±3.59Ca61.00±12.89Ca66.00±13.22Ca河南济源Jiyuan,He’nan6.71±3.87Ca7.56±3.28Ca83.67±10.74Ba81.83±12.28Ba河南内乡Neixiang,He’nan11.41±5.85Ba11.26±5.97Ba80.00±12.53Ba85.00±11.22Ba湖北秭归Zigui,Hubei10.22±4.11Ba11.32±4.99Ba96.83±4.82Aa96.67±5.31Aa湖南城步Chengbu,Hu’nan22.91±7.27Ab29.77±9.17Aa99.17±2.31Aa98.67±3.92Aa
注:数据为平均值±标准差,N=900,同一行数值带有不同小写字母表示成年树树和幼树虫食特征差异达0.05显著水平(T检验),同一列不同大写字母表示不同地理区域虫食特征差异达0.05显著水平(LSD法)。
Note:Data=Mean±SD;Different lowercase letters indicate significant difference at the 0.05 level between mature and juvenile trees,different capital letters indicate significant difference at the 0.05 level among 6 sampling sites,respectively.
表4不同地理区域栓皮栎叶片虫食特征的双因素方差分析
Table4Summaryoftwo-wayANOVAanalysisofherbivoryamongtwoontogeneticstagesandsixsites
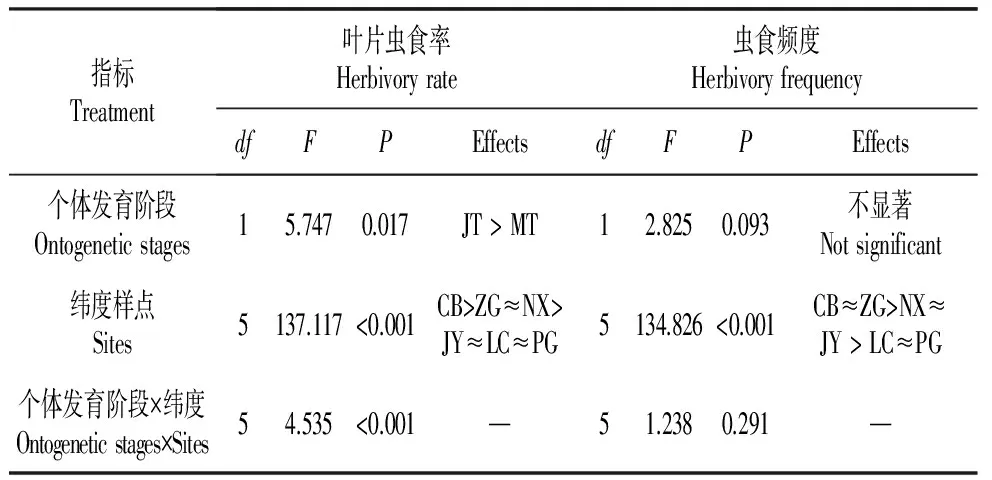
指标Treatment叶片虫食率Herbivoryrate虫食频度HerbivoryfrequencydfFPEffectsdfFPEffects个体发育阶段Ontogeneticstages15.7470.017JT>MT12.8250.093不显著Notsignificant纬度样点Sites5137.117<0.001CB>ZG≈NX>JY≈LC≈PG5134.826<0.001CB≈ZG>NX≈JY>LC≈PG个体发育阶段×纬度Ontogeneticstages×Sites54.535<0.001—51.2380.291—
注:MT.成年树;JT.幼树;PG.北京平谷;LC.河北临城;JY.河南济源;NX.河南内乡;ZG.湖北秭归;CB.湖南城步
Note:MT.Mature tree;JT.Juvenile tree;PG.Pinggu,Beijing;LC.Lincheng,Hebei;JY.Jiyuan,He’nan;NX.Neixiang,He’nan;ZG.Zigui,Hubei;CB.Chengbu,Hu’nan
2.2 不同地理区域成年树、幼树虫食结构比较
由图3可知,纬向不同地理区域栓皮栎成年树、幼树叶片受虫食程度存在明显差异且呈现一定的规律性。从高纬度地区到低纬度地区,不论成年树还是幼树,未受虫食叶片(L0)的比例逐渐减少,甚至趋于0;相反,受中、强度虫食的叶片的比例(即>25%,L4+L5+L6)随纬度的增加而逐渐减少,甚至在北京平谷和和河北临城区域叶片虫食率>75%的叶片几乎趋于零。

图3 不同地理区域栓皮栎成年树、幼树叶片虫食结构比较 L0.未虫食叶片;L1.叶片被啃食0.5%~5%;L2.叶片被啃食5%~15%;L3.叶片被啃食15%~25%;L4.叶片被啃食25%~50%;L5.叶片被啃食50%~75%;L6.叶片被啃食75%以上 A.北京平谷;B.河北临城;C.河南济源;D.河南内乡;E.湖北秭归;F.湖南城步(从A到F,纬度递减)Fig.3 Comparison of leaf herbivory between two ontogenetic stages among different geographical regionsL0.Undamaged; L1. 0.5%-5% of leaf area consumed; L2. 5%~15% of leaf area consumed; L3. 15%~25% of leaf area consumed; L4. 25%~50% of leaf area consumed; L5. 50%~75% of leaf area consumed; L6. More than 75% of leaf area consumed A.Pinggu,Beijing; B.Lincheng,Hebei; C.Jiyuan,He’nan; D.Neixiang,He’nan; E.Zigui,Hubei; F.Chengbu,Hu’nan
除了湖南城步外,北京平谷、河北临城、河南济源、河南内乡、湖北秭归等区域的叶片其虫食程度主要集中在0.5%~5%(L1,属轻度取食),其中成年树虫食程度在0.5%~5%的叶片约占总叶片数量的34.3%~48.5%,幼树为34.8%~48.0%;湖南城步区域的叶片虫食程度成年树主要集中在5%~15%,约占总叶片数量的33.67%,幼树集中在25%~50%,约占总叶片数量的35.17%;成年树、幼树在0.5%~5%的虫食叶片仅占各自总叶片数量的11.0%和7.3%。
2.3 叶片虫食与气候因子的关系
由图4可知,各地区栓皮栎成年树和幼树与年均温无显著相关关系,而与年降雨量和极端气温呈现一定的相关性。其中,成年树、幼苗其叶片虫食率与年降雨量呈显著正相关(成年树:R2=0.72,
P=0.03;幼树:R2=0.74,P=0.03),与极端最低温呈正相关关系,与极端最高温呈负相关关系,但都没达到显著水平;同样,成年树和幼树的虫食频度与年降雨量和极端最低温呈显著正相关(成年树:PAP=0.007,PMTCM=0.003;幼树:PAP=0.006,PMTCM=0.008),而与极端最高呈负相关关系(成年树:R2=0.52,P=0.10;幼树:R2=0.63,P=0.06),但都没达到显著水平。

图4 栓皮栎叶片虫食率和虫食频度与气象因子的关系 ●.成年树;○.幼树;---.成年树简单线性回归拟合;.幼树简单线性回归拟合 AMT.年均温(℃);MTWM.最暖月的最高气温(℃);MTCM.最冷月的最低气温(℃);AP.年降雨量(mm)Fig.4 Insect herbivory rate and frequency of leaves in relation to meteorological factors ●.Mature tree; ○.Juvenile tree; ---.Is fitted line of mature trees; .Is fitted line of young tree AMT. Annual mean temperature(℃);MTWM. Maximum temperature of the warmest month(℃);MTCM. minimum temperature of the coldest month(℃);AP. Annual precipitation(mm)
3 讨论
昆虫等对叶片的取食是植物群落的普遍特征[1],二者之间的相互作用影响着彼此的生态和进化过程,同时也影响着植物竞争的结果和群落的组成、结构和动态[14]。本文结果表明,各地理区域栓皮栎在生长旺季叶片虫食率在5%~30%,不论成年树还是幼树,叶片虫食率和虫食频度随纬度的增加而逐渐递减,即说明低纬度地区植物遭受更强的虫食作用。这与Moreira等[27]对墨西哥广布种爵床科Ruellianudiflora(Acanthaceae)的研究结果相一致,同时也支持前人提出的假说:相比寒冷地区,在较温暖地区(低纬度地区)的森林植被遭受较强虫食作用[6,14,28~29]。然而也有相反的结论,Adams等[30]对北美东部地区跨17个纬度的4个广布种白栎(Quercusalba)、红枫(Acerrubrum)、山毛榉(Fagusgrandifolia)和枫香树(Liquidambarstyraciflua)虫食特征调查结果发现4个树种其叶片虫食率随纬度增加而增加,并认为这种相反的结果可能受某些地区突发性的昆虫爆发(如在美国新泽西州的天幕毛虫(Malacosomadisstria)和其它松毛虫的爆发)等因素有关,这对于群落功能的研究上给我们一些启示:即对于冷、暖气候差异相比,植物与植食昆虫间的“生物”关系强度可能是需要考虑的一个重要方面。
本文分析了校正纬度和不校正纬度与虫食特征的关系,发现叶片虫食率、虫食频度与纬度之间都显示显著的负相关关系,两种结果一致,可知在较大纬度尺度下,本文研究区域范围海拔差异不足以影响虫食的纬度梯度变化。
纬向代表一个复杂的环境梯度,随纬度差异,温度、水分等均表现出不同。本文研究结果发现,纬向不同地理区域栓皮栎成年树和幼树叶片虫食作用与年均温均无显著相关关系,而与年降雨量和极端气温呈现一定的相关性,表现出与年降雨量和极端低温呈正相关关系,而与极端高温呈负相关关系,同时根据气象数据可知,我国极端最高温和极端最低温都出现在北方,因而可能是极端气温和较低的湿度限制了昆虫等植食性动物的生存和繁衍,致使北方昆虫的种类和数量相对较少,而越往南(或越靠近赤道)植食昆虫的生物多样性越来越高[31~33],植物与植食昆虫间的“生物”关系越为激烈,植物受到的植食压力也就越来越大。
另外,本文研究发现栓皮栎在不同个体发育阶段受虫食作用存在显著差异,表现出幼树叶片虫食率高于成年树,特别是在低纬度地区,这可能是由于幼树叶片较低的硬度和韧性等,即所谓的机械防御能力[34~35]较低,而导致受到相对严重的昆虫啃食。
本文仅仅是以广布种栓皮栎为例的典型纬向虫食调查的一个案例,而当前对于纬度和虫食之间的关系仍存有争议。将来的研究除了基于叶片的调查以外,还可对植物种子、果实、凋落物或是其他器官的虫食特征进一步研究,如Moreira等[27]发现种子随纬向受到的虫害格局与叶片相反,而Moles等[36]发现种子虫食与纬度没有显著的相关关系等等。因此,对于纬度与虫食特征的关系,将来仍需从多角度进一步探索,以及通过分析虫食特征与植物防御的关系、虫食特征与气候因素的关系、虫食特征与昆虫天敌的关系,为进一步探讨植物在不同地理区域以及全球变化背景下的适应性及分布特点提供理论基础。
1.Cyr H,Face M L.Magnitude and patterns of herbivory in aquatic and terrestrial ecosystems[J].Nature,1993,361(6408):148-150.
2.Futuyma D J.Some current approaches to the evolution of plant-herbivore interactions[J].Plant Species Biology,2000,15(1):1-9.
3.Marquis R J.Leaf herbivores decrease fitness of a tropical plant[J].Science,1984,226(4674):537-539.
4.Mcnaughton S.On plants and herbivores[J].American Naturalist,1986,128(5):765-770.
5.Lehtilä K,Strauss S Y.Effects of foliar herbivory on male and female reproductive traits of wild radish,raphanus raphanistrum[J].Ecology,1999,80(1):116-124.
6.Coley P D,Aide T.Comparison of herbivory and plant defenses in temperate and tropical broad-leaved forests[M].New York:Plant-animal Interactions:Evolutionary Ecology in Tropical and Temperate Regions,1991:25-49.
7.唐建维,张建侯,宋启示,等.西双版纳热带次生林生物量的初步研究[J].植物生态学报,1998,22(6):489-498.
8.郑征,陈旭东,毛红卫,等.西双版纳热带季节雨林林窗内幼树叶生长与虫食动态[J].植物生态学报,2001,25(6):679-686.
9.Bazzaz F A,Chiariello N R,Coley P D,et al.Allocating resources to reproduction and defense[J].Bioscience,1987,37(1):58-67.
10.Howe G A,Jander G.Plant immunity to insect herbivores[J].Annual review of plant biology,2008,59:41-66.
11.War A R,Paulraj M G,Ahmad T,et al.Mechanisms of plant defense against insect herbivores[J].Plant Signaling & Behavior,2012,7(10):1306-1320.
12.蔡志全,曹坤芳.热带森林植物幼叶抗虫食防卫方式研究的现状及进展[J].广西植物,2002,22(5):474-480.
13.Leather S R.Herbivory,phenology,morphology and the expression of sex in trees:who is in the driver’s seat?[J].Oikos,2000,90(1):194-196.
14.Coley P D,Barone J.Herbivory and plant defenses in tropical forests[J].Annual Review of Ecology and Systematics,1996,27:305-335.
15.赵爽,王琦,李艳红.植物生理与分子生物学[J].植物生理学通讯,2007,43(2):384-390.
16.Feeny P.Seasonal changes in oak leaf tannins and nutrients as a cause of spring feeding by winter moth caterpillars[J].Ecology,1970,51(4):565-581.
17.Aide T M.Patterns of leaf development and herbivory in a tropical understory community[J].Ecology,1993,74(2):455-466.
18.江红,蔡永立,李恺,等.浙江天童常绿阔叶林石栎叶片昆虫取食状类型和取食强度研究[J].生态学杂志,2005,24(9):989-993.
19.王宏伟,蔡永立,李恺,等.浙江天童常绿阔叶林中11种常绿乔灌木叶片虫食状分析[J].生物多样性,2006,14(2):145-151.
20.张文辉,卢志军.栓皮栎种群的生物学生态学特性和地理分布研究[J].西北植物学报,2002,22(5):1093-1101.
21.龚高法,简慰民.我国植物物候期的地理分布[J].地理学报,1983,38(1):33-40.
22.Fox L,Morrow P.Estimates of damage by herbivorous insects on eucalyptus trees[J].Australian Journal of Ecology,1983,8(2):139-147.
23.Morrow P,Lamarche V C.Tree ring evidence for chronic insect suppression of productivity in subalpine eucalyptus[J].Science,1978,201(4362):1244-1246.
24.Adams J M,Rehill B,Zhang Y,et al.A test of the latitudinal defense hypothesis:herbivory,tannins and total phenolics in four north american tree species[J].Ecological Research,2009,24(3):697-704.
25.刘志国,景军,李恺,等.亚热带阔叶林植物叶片虫食特征研究[J].生态环境学报,2013,22(1):78-84.
26.Lindgren K.Genotype x environment interaction of provenances ofPinuscontorta(dougl.)[J].Studia Forestalia Suecica(sweden),1984,166:41-44.
27.Moreira X,Abdala-roberts L,Parra-tabla V,et al.Latitudinal variation in herbivory:influences of climatic drivers,herbivore identity and natural enemies[J].Oikos,2015,124(11):1444-1452.
28.Salazar D,Marquis R J.Herbivore pressure increases toward the equator[J].Proceedings of the National Academy of Sciences,2012,109(31):12616-12620.
29.Hillebrand H.On the generality of the latitudinal diversity gradient[J].The American Naturalist,2004,163(2):192-211.
30.Adams J M,Zhang Y.Is there more insect folivory in warmer temperate climates? a latitudinal comparison of insect folivory in eastern north america[J].Journal of Ecology,2009,97(5):933-940.
31.Andrew N R,Hughes L.Species diversity and structure of phytophagous beetle assemblages along a latitudinal gradient:predicting the potential impacts of climate change[J].Ecological Entomology,2004,29(5):527-542.
32.Pennings S C,Ho C,Salgado C S,et al.Latitudinal variation in herbivore pressure in atlantic coast salt marshes[J].Ecology,2009,90(1):183-195.
33.Garibaldi L A,Kitzberger T,Ruggiero A.Latitudinal decrease in folivory withinNothofaguspumilioforests:dual effect of climate on insect density and leaf traits?[J].Global Ecology and Biogeography,2011,20(4):609-619.
34.Sanson G,Read J,Aranwela N,et al.Measurement of leaf biomechanical properties in studies of herbivory:opportunities,problems and procedures[J].Austral Ecology,2001,26(5):535-546.
35.Ibanez S,Lavorel S,Puijalon S,et al.Herbivory mediated by coupling between biomechanical traits of plants and grasshoppers[J].Functional Ecology,2013,27(2):479-489.
36.Moles A T,Westoby M.Latitude,seed predation and seed mass[J].Journal of Biogeography,2003,30(1):105-128.
EntomicHerbivoryCharacteristicsofQuercusvariabilisLeavesandCorrelationwithMeteorologicalFactorsacrossDifferentGeographicalRegions
WANG Xiao-Fei1,2NI Yan-Yan1,2GAO Wen-Qiang1,2LIU Jian-Feng1,2*JIANG Ze-Ping1,2
(1.Research Institute of Forestry,Chinese Academy of Forestry,Beijing 100091;2.Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration,Beijing 100091)
Herbivory is the common characteristics of plant community. To explore the effects of latitude and meteorological factors on herbivory, we investigated the entomic herbivory characteristics ofQuercusvariabilisleaves acorss different geographical regions, with a 14° latitudinal spanning from 26° N(Chengbu, Hu’nan Province) to 40°N(Beijing). Either the mature tree or juvenile tree, leaf herbivory rate and frequency significantly increased toward the equator or at lower latitudes(P<0.05). According to the insect herbivory structure, the proportion of the non-chewed leaves decreased, while the proportion of the above 25%-chewed leaves increased toward the equator. Namely, it shows strong herbivory at lower latitudes. Except the southest site(Chengbu, Hu’nan Province), the proportion of herbivory mainly concentrated between 0.5%-5% for all other sites. Leaf herbivory rates in the juvenile tree were significantly higher than that in the mature tree(P<0.05). Multiple regression results revealed significant effects of annual precipitation and minimum temperature of the coldest month on leaf herbivory rate and frequency despite ontogenic stages, but the maximum temperature of the warmest month significantly affected leaf herbivory frequency in the juvenile tree. Therefore, the latitudinal variation in leaf herbivory likely appears to be driven predominantly by variation in extreme temperature and precipitation.
Quercusvariabilis;geographic scale;herbivory;meteorological factor;defence
国家自然科学基金项目(41371075);北京市科技计划课题(Z141100002314009)资助
王小菲(1987—),男,博士研究生,主要从事生理生态、树木地理方向研究。
* 通信作者:E-mail:Liujf@caf.ac.cn
2015-11-08
Q948;S763
A
10.7525/j.issn.1673-5102.2016.03.021

