岩扇贝幼贝滤食率的基础研究
曹善茂,梁伟锋,汪 健,刘 钢,李晓雨
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
岩扇贝幼贝滤食率的基础研究
曹善茂,梁伟锋,汪 健,刘 钢,李晓雨
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
为了解岩扇贝Crassadoma gigantea幼贝的摄食率,采用静水法研究了在不同温度(6、10、14、18、22℃)、体质量(小、中、大3种规格)、饵料(新月菱形藻Nitzschia closterium、湛江等边金藻Isochrysis zhanjiangensis、亚心形扁藻Platymonas subcordiformis、小球藻Chlorella vulgaris)和饵料浓度(15×104、30× 104、45×104、60×104、75×104cells/mL)条件下岩扇贝的滤食率及其昼夜节律。结果表明:温度、体质量、饵料种类和饵料浓度对岩扇贝幼贝滤食率有显著或极显著影响(P<0.05或P<0.01);在试验温度和体质量范围内,幼贝单位体质量的滤食率均随温度和体质量的增加而增大;幼贝对4种单胞藻的滤食率依次为新月菱形藻>湛江等边金藻>亚心形扁藻>小球藻,且对4种单胞藻的滤食率有显著性或极显著性差异(P<0.05或P<0.01);当新月菱形藻浓度为30×104cells/mL时,幼贝的滤食率达到最大,极显著高于其他饵料浓度组(P<0.01);幼贝的滤食率存在显著的昼夜变化(P<0.05),一天中存在一个滤食高峰时段,即17:00~21:00[40.161×108cells/(g·h)],且显著高于其他时段(P<0.05),存在两个低峰时段,即9:00~13:00[32.496×108cells/(g·h)]和1:00~5:00[29.934×108cells/(g·h)],均显著低于其他时段(P<0.05)。研究表明,岩扇贝的适温范围及对饵料的适应性较广,可作为中国重要扇贝引进品种加以培养。
岩扇贝;滤食率;体质量;温度;饵料浓度
岩扇贝Crassadoma gigantea隶属于软体动物门Mollusca、瓣鳃纲Lamellibranchia、珍珠贝目Pterioida、扇贝科Pectinidae。原产于北美太平洋海域,以其个体大、出柱率高、生长速度快、味道鲜美而著称,是优良的扇贝品种,在国际市场供不应求。在当前国内扇贝养殖品种较少、产量不稳定、死亡率居高不下的情况下,岩扇贝应是引进品种的良好选择之一。
目前,国外学者对岩扇贝的营养成分、口感、冷藏肉质的稳定性、野生种群的生长速率、排精产卵机制、幼贝的饵料配比、附着过程与机制等进行了大量研究[1-7],国内对扇贝类的滤食率研究也比较多[8-17],这为扇贝的生理生态研究、增养殖和可持续发展等提供了重要的理论依据,但国内尚未见对岩扇贝摄食生理的相关研究报道。本试验中,研究了岩扇贝幼贝在不同温度、体质量、饵料种类与饵料浓度条件下的滤食率及其昼夜节律,以期为岩扇贝引进中国的可行性提供数据支持,为岩扇贝人工育苗、成体养殖等生产实践提供指导。
1 材料与方法
1.1 材料
试验用岩扇贝亲贝于2014年11月自加拿大温哥华岛引进。亲贝于2015年5月人工育苗后,子一代幼贝在大连龙王塘海域养殖至6月龄,取720枚用于试验。试验用水为大连市黑石礁海域沙滤自然海水。
1.2 方法
1.2.1 幼贝的暂养 试验在大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室进行。挑选状态良好、无损伤的个体,洗刷去体表附着物,暂养于4个25 L的控温循环水族缸中,每缸100枚。暂养期间水温为(14.0±0.3)℃,定时投饵换水,海水盐度为31.6~32.3,pH为7.93~8.33, DO>5 mg/L。投喂新月菱形藻Nitzschia closterium、湛江等鞭金藻Isochrysis zhanjiangensis、亚心形扁藻Platymonas subcordiformis和小球藻Chlorella vulgaris,均为本实验室培养所得的新鲜藻液。日投饵量≥25×104cells/(mL·d)(以新月菱形藻计),每两天换水1/3~1/2,主投新月菱形藻,辅投湛江等鞭金藻、亚心形扁藻、小球藻。每天测定水化指标。1.2.2 温度对幼贝滤食率的影响试验 试验设6、10、14、18、22℃5个温度组。从14℃开始,每日升高或降低2℃直至设定温度。试验在浓度为30×104cells/mL的新月菱形藻藻液中进行。
1.2.3 体质量对幼贝滤食率的影响试验 试验温度为18℃,设小、中、大3种规格体质量(软体部干质量分别为0.005、0.012、0.026 g)的幼贝组。试验在浓度为30×104cells/mL的新月菱形藻藻液中进行。
1.2.4 饵料种类及饵料浓度对幼贝滤食率的影响试验 饵料种类试验设小球藻、新月菱形藻、湛江等鞭金藻、亚心形扁藻4个饵料种类组,以浓度为30×104cells/mL的新月菱形藻生物量为标准,换算出其他3种饵料试验所需浓度(表1)。试验在各组藻液中进行。
饵料浓度试验设15×104、30×104、45×104、60×104、75×104cells/mL 5个饵料浓度组,用新月菱形藻作为试验饵料。

表1 4种饵料细胞大小及在等生物量下的浓度Tab.1 Cell sizes and concentration of species of algae at equivalent biomass
1.2.5 昼夜节律对幼贝滤食率的影响试验 试验设9:00~13:00、13:00~17:00、17:00~21:00、21:00~1:00、1:00~5:00、5:00~9:00 6个时间段的试验组。试验时对试验装置进行24 h遮光处理以保持黑暗,试验温度为18℃。从9:00开始试验,连续测定13:00、17:00、21:00、1:00、5:00、9:00 6个时间点的4 h平均滤食率。每个时间段的试验开始前用浓度为500×104cells/mL的新月菱形藻藻液和新鲜海水在5 L锥形瓶中配制成30×104cells/mL(略有误差,按实测值计算)藻液。每个时间段的试验方法为:将30×104cells/mL藻液加入1000 mL烧杯中,微量充气,使容器内饵料均匀分布,每个烧杯放入3枚试验贝,该试验段结束后,即时测定烧杯中的饵料浓度,并将试验贝移入预先准备好的下一组装有藻液的烧杯中,继续下一时段的试验。
1.2.6 饲养管理 岩扇贝幼贝暂养20 d后开始试验,达到各试验条件后稳定48 h,正常投饵。试验在1 L烧杯中进行,每杯放3个幼贝,空白对照组不放幼贝,不封口,试验时间为2 h(昼夜节律试验除外),期间微量充气,分别测定试验前后水中饵料浓度。每个试验组设3个重复和1个空白对照,试验期间杜绝任何惊扰。试验结束后,用游标卡尺测量幼贝的壳长、壳高,然后解剖分离贝壳与软体部,均置于烘箱(70℃)中烘干至恒重,用分析天平称重。各试验用岩扇贝幼贝规格参数见表2。
1.2.7 指标的计算 饵料浓度用血球计数板定量,每个样品均定量4次,取其平均值,并根据下式计算试验幼贝的滤食率:

其中:IR为单位体质量的滤食率[cells/(g·h)];C0和Ct分别为试验开始和结束时水中的饵料浓度(104cells/mL);V为试验水体体积(L),本次试验均为1 L;W为幼贝软体部干质量(g);t为试验时间(h),除昼夜节律试验外均为2 h;Sd为空白组饵料变化系数。
1.3 数据处理
采用SPSS 19.0软件进行单因子方差分析(One-Way ANOVA)及组间多重比较(LSD法),极显著性水平设为0.01,显著性水平设为0.05。
2 结果与分析
2.1 温度与岩扇贝幼贝滤食率的关系
从图1可见,在6~22℃下,岩扇贝幼贝单位体质量滤食率随温度的升高而增大,变化范围为(8.037~36.576)×108cells/(g·h),变化幅度为355.1%。单因子方差分析表明,温度对岩扇贝的滤食率影响极显著(P<0.01)。通过回归分析,得出滤食率(IR)与水温(T)之间的关系方程为IR=-0.01104T2+1.9812T-2.3895(R2=0.9781)。
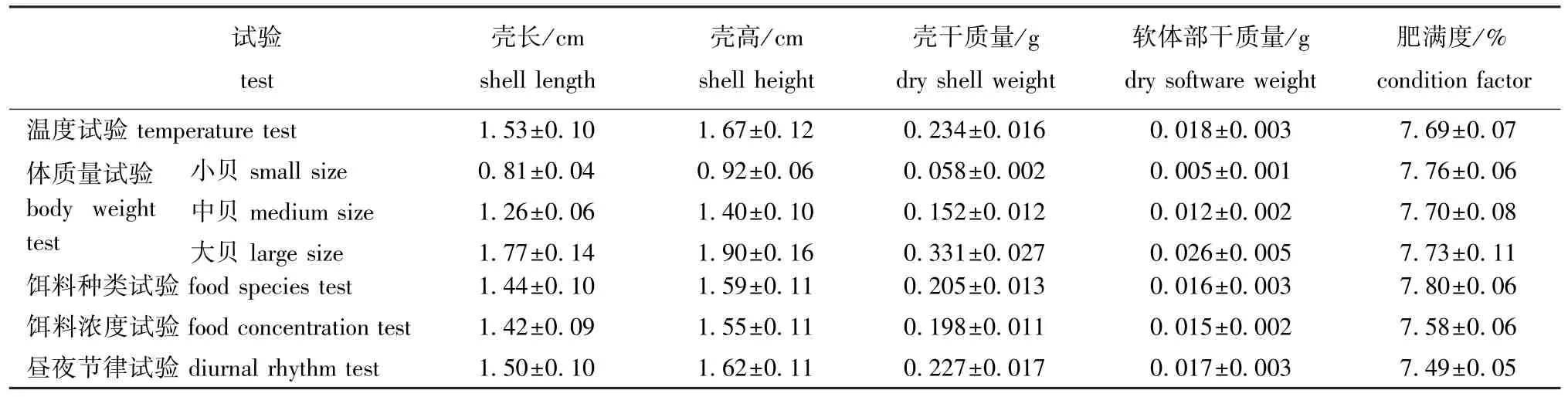
表2 各试验用岩扇贝幼贝规格Tab.2 Specifications of juvenile rock scallop used in the experiment

注:标有不同大写字母者表示组间有极显著性差异(P<0.01),标有不同小写字母者表示组间有显著性差异(P<0.05),下同Note:Themeans with different capital letters are very significantly different at the 0.01 probability level,with different letters being significantly different at the 0.05 probability level,et sequentia图1 温度对岩扇贝幼贝滤食率的影响Fig.1 Effect of tem perature on the filter-feeding rate of juvenile rock scallop
2.2 体质量与岩扇贝幼贝滤食率的关系
从图2可见,在18℃下,岩扇贝幼贝单位体质量的滤食率随软体部干质量的增大而升高。单因子方差分析表明,体质量对岩扇贝幼贝滤食率的影响极显著(P<0.01)。回归分析表明,体质量(W)与滤食率(IR)呈正相关的幂指数关系,关系方程为IR=115.4W0.459(R2=0.986,n=9)。

图2 体质量对岩扇贝幼贝滤食率的影响Fig.2 Effect of body weight on the filter-feeding rate of juvenile rock scallop
2.3 饵料种类与岩扇贝幼贝滤食率的关系
从图3可见,幼贝对新月菱形藻的滤食率最高,为305 mg/(g·h),对湛江等边金藻和亚心形扁藻的滤食率次之,分别为291、284 mg/(g·h),对小球藻的滤食率最低,为258 mg/(g·h)。单因子方差分析及组间多重比较分析表明,4种藻类对岩扇贝幼贝的滤食率有显著性影响(P<0.05),且各饵料组间有显著或极显著性差异(P<0.05或P<0.01)。
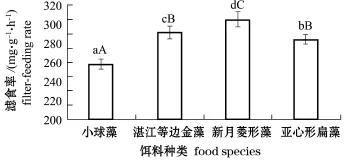
图3 4种饵料对岩扇贝幼贝滤食率的影响Fig.3 Effect of diet species on the filter-feeding rate of juvenile rock scallop
2.4 饵料浓度与岩扇贝幼贝滤食率的关系
从图4可见:饵料浓度在(15~75)×104cells/mL范围内,岩扇贝幼贝的滤食率随浓度的增加呈先升高后降低趋势;当饵料浓度为30×104cells/mL时,幼贝的滤食率达到最大,为27.441× 108cells/(g·h);当饵料浓度为60×104cells/mL时,滤食率最低,为11.262×108cells/(g·h)。多重比较结果表明,15×104、60×104、75×104cells/mL 3个浓度组间的滤食率无显著性差异(P>0.05),其余各组间均有极显著性差异(P<0.01)。回归分析得出滤食率(IR)与饵料浓度(X)间的关系式为IR=2.7485X3-26.671X2+74.981X-38.579(R2=0.9866)。

图4 饵料浓度对岩扇贝幼贝滤食率的影响Fig.4 Effect of food concentration on the filter-feeding rate of juvenile rock scallop
2.5 岩扇贝幼贝滤食率的昼夜节律
从图5可见,一天中有一个滤食高峰时段,出现在17:00~21:00,滤食率为40.161×108cells/(g·h),另有两个滤食低峰时段,一个是9:00~13:00,滤食率为32.496×108cells/(g·h),另一个是1:00~5:00,滤食率为29.934×108cells/(g·h)。研究表明,岩扇贝幼贝的滤食率存在显著的昼夜变化(P<0.05),其中9:00、17:00、1:00 3个时间点间的滤食率无显著性差异(P>0.05),其余各时间点间均存在显著性差异(P<0.05)。

图5 岩扇贝幼贝滤食率的昼夜变化Fig 5 Diurnal variation in the filter-feeding rate of juvenile rock scallop
3 讨论
3.1 温度对贝类滤食率的影响
水温是影响贝类生理活动变化的重要因素之一,主要通过改变滤食性贝类鳃丝上侧纤毛的摆动频率和海水的黏滞性来影响贝类的滤水、摄食活动[8]。关于水温对贝类摄食生理的影响已有大量报道。研究表明,在适温范围内,贝类的滤食率随温度的升高而增大,并在某一温度达到最大,而后则随温度的继续升高而下降。在适宜的温度区间内,温度升高会使贝类的生命活动加强,体内酶促反应效率更高,新陈代谢加快,同时可提高纤毛的摆动频率,降低海水的黏度,滤水率加快,滤食率随之增大;而当水温超过一定的范围,环境条件不适宜时,贝类的上述生命活动均受到抑制,从而导致摄食降低[9-13]。另外,不同种贝类的滤水能力不同,因而滤食率相差较大;即使是同种贝类,试验条件和测定方法差异也会影响所测得的滤食率。
本研究结果显示,在6~22℃时,岩扇贝幼贝的滤食率和水温呈正相关关系,并在22℃时达到最大值。笔者认为,由于驯化后对中国海水环境的适应,试验用岩扇贝幼贝较原产地岩扇贝适温范围(6~20℃)更广。从这个角度看,岩扇贝经驯化后应该能够适应大连的海水温度。
3.2 体质量对贝类滤食率的影响
贝类的体质量是影响其滤食率的重要因素之一。研究表明[18-20],双壳贝类滤食率与体质量的关系可以用Y=aXb表示,a值的变化较大,b为体质量指数。Winter[21]的研究表明,滤食性贝类b值范围为0.66~0.82。Bayne等[22]综合众多文献后,计算的b值平均为(0.62±0.13)。另在许多报道中,双壳贝类b值为0.3~0.8,不超过1。本试验中岩扇贝的b值平均为0.459,总体为0.3~0.8。造成贝类体质量指数的差异可能与试验所用扇贝的规格、生理状态、饵料及所处的环境等有关。
3.3 饵料种类对贝类滤食率的影响
岩扇贝幼贝对4种不同饵料的滤食率大小依次为新月菱形藻>湛江等边金藻>亚心形扁藻>小球藻,岩扇贝幼贝对粒径为5.79μm的新月菱形藻具有最高的选择性,而对粒径稍大的湛江等边金藻(6.22μm)和亚心形扁藻(8.35μm)选择性稍低,对粒径最小的小球藻(4.35μm)选择性最低,这可能是因为岩扇贝幼贝鳃丝发育较完全,鳃丝间隔最适于滤食5~6μm的饵料颗粒,对较大和较小的饵料颗粒则次之。此外,海洋单细胞藻类大多数为硅藻,在长期的演化过程中岩扇贝形成了对硅藻类的摄食偏好,这也可能是其对新月菱形藻摄食率最高的原因之一。
3.4 饵料浓度对贝类滤食率的影响
饵料浓度是影响贝类滤食率的重要参数。多种海洋贝类在一定饵料浓度范围内其滤食率表现为单峰变化,这是贝类自身生理调节及多种因素综合作用的结果,海湾扇贝、栉孔扇贝、太平洋牡蛎、菲律宾蛤仔[14,23]、黄边糙鸟蛤Trachycardium flavum[15]、大珠母贝Piuctadamaxima稚贝[16]和大西洋浪蛤Spisula solidissima[17]等许多贝类均符合此规律。本试验条件下,饵料浓度为(15~30)×104cells/mL时,岩扇贝幼贝的滤食率随饵料浓度的增加而增加,当饵料浓度为30×104cells/mL时滤食率最大,但当大于该浓度时,幼贝滤食率开始下降,浓度达到60×104cells/mL时,其滤食率急剧下降,这与许多研究一致,可能是由于在含有高浓度饵料的海水中,岩扇贝幼贝过滤一定体积海水时得到的饵料更多,同时海水黏滞性升高,减慢了其滤水速率,使得滤食率较低。Bayne[24]认为:在饵料浓度达到最适浓度前,贝类滤食率随饵料浓度的增加而增加,二者呈正相关的幂函数关系;当饵料浓度达到最适浓度时,滤食率达最大值,而后开始降低,呈负相关的幂函数关系。若投饵量过低,水中饵料稀薄,贝类单位时间内通过滤水而获取的饵料颗粒变少,滤食能力则受到抑制。
3.5 岩扇贝幼贝滤食率的昼夜变化
宇宙的天体运动和地球的地质运动会引起生物圈的一系列变化,很多变化有规律且呈周期性,而生物为适应这种变化会产生一定的节律性行为,这种节律性可世代遗传,多年之后,生物的这些行为不仅由自然界变化引起,同时也成为机体内存在的一种生物时钟,即便没有了自然界的变化,短时间内生物的节律性行为因生物时钟影响仍将存在。即使环境产生了变化(如异地引种),原有的生物节律性可能也会在一定时期内存在(如人的时差)。
黎辉等[13]、陈汉辉等[25]、刘青等[26]、吴桂汉等[27]的研究证实,水生生物摄食的昼夜节律现象也广泛存在。梁旭方等[28]认为,鱼类摄食昼夜节律因其感觉器官不同而不同,视觉发达的鱼类白昼摄食,化学感觉强烈的鱼类夜间摄食。吴桂汉等[27]研究证实,菲律宾蛤仔Ruditapesphilippinarum的摄食率有显著的昼夜差异,其夜间的摄食率明显高于白昼,最大值和最小值分别发生在00:00和12:00。吴庆龙等[29]认为,背角无齿蚌Anodonta woodiana的滤水率也有一定的日变化,傍晚时较高,最大值出现在18:00。杜美荣等[30]的研究表明,栉孔扇贝面盘幼虫、稚贝的滤水行为均具有明显的昼夜节律性,最大值出现于21:00~翌日1:00,最小值出现在09:00~13:00。本试验是在没有自然光的情况下,对昼夜24 h内岩扇贝幼贝滤食率的变化进行了研究,结果表明,一昼夜中,岩扇贝幼贝滤食率有显著变化,在17:00~21:00最高,在13:00~17:00和5:00~9:00较低,其他时段稍高。岩扇贝初次自太平洋东岸引入中国,它的昼夜摄食节律需要较长时间才能适应新环境,这可能是与栉孔扇贝存在明显不同的原因。光照条件对岩扇贝幼贝滤食率的昼夜节律性是否有影响,正光照周期处理是否与本试验结果一致,反光照周期是否又会对其滤食率产生新的变化,仍需进一步研究。总之,因幼贝的滤食方式与成贝一致,研究其摄食昼夜节律变化可用于未来人工育苗,而种贝促熟均在黑暗情况下进行,在此过程中了解其摄食的昼夜节律变化,可掌握准确的投饵时间和投饵量,促进育苗生产。
综上所述,岩扇贝的适温范围及对不同饵料的适应性较广,经过一段时间的驯化后,应能较快适应大连海域的水温条件,可作为中国引进重点扇贝品种加以重视。
[1]Phleger C F,Holtz R B,Grimes PW,et al.Chemical and sensory analysis of the purple-hinge rock scallopHinnites multirugosusGale[J].Journal of Food Science,2006,43(6):1793-1796.
[2]Maxwell-Miller G,Josephson R V,Spindler A A,et al.Chilled(5℃)and frozen(-18℃)storage stability of the purple-hinge rock scallop,HinnitesmultirugosusGale[J].Journal of Food Science,1982,47(5):1654-1661.
[3]Monical Jr JB.Comparative studies on growth of the purple-hinge rock scallopHinnitesmultirugosus(Gale)in southern California [J].Proceedings of the World Mariculture Society,1979,10(1-4):648.
[4]Laurén D J.Oogenesis and protandry in the purple-hinge rock scallop,Hinnitesgiganteus,in upper Puget Sound,Washington,U. S.A.[J].Canadian Journal of Zoology,1982,60(10):2333-2336.
[5]Cary SC,Leighton D L,Phleger C F.Food and feeding strategies in culture of larval and early juvenile purple-hinge rock scallop,Hinnitesmultirugosus(Gale)[J].Journal of the World Aquaculture Society,1981,12(1):156-169.
[6]Culver CS,Richards JB,Page H M.Plasticity of attachment in the purple-hinge rock scallop,Crassadoma gigantea:implications for commercial culture[J].Aquaculture,2006,254(1-4):361-369.
[7]曹善茂,王昊,陈炜,等.岩扇贝闭壳肌营养成分的分析及与中国3种扇贝的比较[J].大连海洋大学学报,2016,31(5):544-550.
[8]王芳,董双林,张硕,等.海湾扇贝和太平洋牡蛎的食物选择性及滤除率的实验研究[J].海洋与湖沼,2000,31(2):139-144.
[9]匡世焕,孙慧玲,李锋,等.野生和养殖牡蛎种群的比较摄食生理研究[J].海洋水产研究,1996,17(2):87-94.
[10]杨晓新,林小涛,计新丽,等.温度、盐度和光照条件对翡翠贻贝滤水率的影响[J].海洋科学,2000,24(6):36-39.
[11]袁有宪,曲克明,陈聚法,等.栉孔扇贝对环境变化适应性研究——温度对存活、呼吸、摄食及消化的影响[J].中国水产科学,2000,7(3):24-27.
[12]董波,薛钦昭,李军.温度对菲律宾蛤仔滤食率、清滤率和吸收率的影响[J].海洋水产研究,2000,21(1):37-42.
[13]黎辉,金启增,郭澄联,等.合浦珠母贝幼虫、幼苗的摄食率和摄食节律研究[J].热带海洋,1997,16(3):41-48.
[14]董波,薛钦昭,李军.海洋滤食性贝类摄食率的研究现状[J].海洋科学,1999(3):26-29.
[15]蒋丽梅.黄边糙鸟蛤代谢生理和摄食生理以及能量收支的基础研究[D].湛江:广东海洋大学,2012.
[16]范嗣刚,姜松,黄桂菊,等.合浦珠母贝和大珠母贝稚贝摄食率及摄食节律的比较研究[J].水产科技情报,2015,42(1):6-10.
[17]郭海燕,王昭萍,于瑞海,等.饵料密度、温度和体质量对大西洋浪蛤滤水率的影响[J].海洋科学,2005,29(8):1-3.
[18]Winter JE.Über den Einflußder nahrungskonzentration und anderer faktoren auf filtrierleistung und nahrungsausnutzung der muschelnArctica islandicaandModiolusmodiolus[J].Marine Biology,1969,4(2):87-135.
[19]Ali R M.The influence of suspension density and temperature on the filtration rate ofHiatella arctica[J].Marine Biology,1970,6 (4):291-302.
[20]Winter JE,Langton RW.Feeding experimentswithMytilus edulisL.at small laboratory scale.The influence of suspended silt in addition to algal suspensions on growth[C]//Persoone G,Jaspers E.Proceedings of the10th European Symposium on Marine Biology.Wetteren:University Press,1976:583-600.
[21]Winter JE.A review on the knowledge of suspension-feeding in Lamellibranchiate bivalves,with special reference to artificial aquaculture systems[J].Aquaculture,1978,3(1):1-33.
[22]Bayne B L,Newell R C.9-physiological energetics ofmarinemolluscs[J].The Mollusca,1983,40:407-515.
[23]王芳,董双林,范瑞青,等.四种滤食性贝类滤食器官鳃的扫描电镜观察[J].青岛海洋大学学报,1998,28(2):240-244.
[24]Bayne B L.The physiology of suspension feeding by bivalvemolluscs:an introduction to the Plymouth“TROPHEE”workshop [J].Journal of Experimental Marine Biology and Ecology,1998, 219(1-2):1-19.
[25]陈汉辉,杞桑.夜光藻摄食和营养繁殖的昼夜节律[J].暨南大学学报,1991,12(3):104-107,111.
[26]刘青,曲晗,张硕,等.强壮箭虫摄食生态的实验研究[J].水产学报,2006,30(6):767-772.
[27]吴桂汉,陈品健,江瑞胜,等.盐度和昼夜节律对菲律宾蛤仔摄食率的影响[J].台湾海峡,2002,21(1):72-77.
[28]梁旭方,何大仁.鱼类摄食行为的感觉基础[J].水生生物学报,1998,22(3):278-284.
[29]吴庆龙,陈宇炜,刘正文.背角无齿蚌对浮游藻类的滤食选择性与滤水率研究[J].应用生态学报,2005,16(12):2423-2427.
[30]杜美荣,方建光,毛玉泽,等.栉孔扇贝面盘幼虫和稚贝的滤水率昼夜节律[J].渔业科学进展,2012,33(5):73-77.
Fundamental research on filter-feeding rate of juvenile rock scallop
CAO Shan-mao,LIANGWei-feng,WANG Jian,LIU Gang,LIXiao-yu
(Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
The filter-feeding rate and feeding rhythm of juvenile rock scallopCrassadoma giganteawith various body weight(dry software weight)of 0.005 g(S),0.012 g(M)and 0.026 g(L)were studied under different algae includingNitzschia closterium,Isochrysis zhanjiangensis,Platymonas subcordiformis,andChlorella vulgaris,at concentration of(15×104,30×104,45×104,60×104,and 75×104cells/mL)and water temperatures of6,10,14, 18℃,and 22℃in order to understand the filter-feeding rate of juvenile rock scallop by a hydrostaticmethod.It was found that there were significant or very significant effects of temperature,body weight,alga species,and alga concentration on the filter-feeding rate of juvenile rock scallop(P<0.05 orP<0.01).The filter-feeding rate per unit body weight of juvenile rock scallop was shown to increase with warming temperature and increase in body weight within the test temperature range(6-22℃).The filter-feeding rate order of the scallop fed the four unicellular algae was expressed asN.closterium>I.zhanjiangensis>P.subcordiformis>C.vulgaris,with significant or very significant differences among the four unicellular algae(P<0.05 orP<0.01).The maximum filter-feeding rate per unitbody weightwas observed atN.closteriumconcentration of30×104cells/mL,significantly higher than those in other groups(P<0.01).There were significant diurnal variation in filter-feeding rate(P<0.05),with peak at 17:00-21:00[40.161×108cells/(g·h)],significantly higher than those in other time(P<0.05),and two low values at9:00-13:00[32.496×108cells/(g·h)],and 1:00-5:00[29.934×108cells/(g·h)],significant lower than thos in other time(P<0.05).The findings indicate that rock scallop is suitable for induction and culture due to wide suitable water temperature range and food items.
Crassadoma gigantea;filter-feeding rate;body weight;temperature;food concentration
Q954.4
A
10.16535/j.cnki.dlhyxb.2016.06.005
2095-1388(2016)06-0612-06
2016-04-02
辽宁省海洋与渔业厅项目(201214);大连市海洋与渔业局项目(2012011)
曹善茂(1960—),男,副教授。E-mail:caoshm@dlou.edu.cn

