拟南芥AtPI基因植物表达载体的构建及其在烟草中的遗传转化
刘彩霞 郑唐春 代丽娟 刘 轶 曲冠证
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
拟南芥AtPI基因植物表达载体的构建及其在烟草中的遗传转化
刘彩霞 郑唐春 代丽娟 刘 轶 曲冠证*
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
花是被子植物主要的繁殖器官,在繁育后代的过程中,发挥着极其重要的作用,PISTILLATA(PI)基因作为控制花器官发育的B类功能基因中的一员,在花器官发育中起到重要的作用。为探究PI基因在花瓣和雄蕊发育中的功能,本文以拟南芥(Arabidopsisthaliana)中的PI基因作为研究对象,利用PCR技术从拟南芥花序cDNA扩增出AtPI基因,构建植物表达载体(pROKⅡ-AtPI)并进行烟草(Nicotianatobacum)转化。转基因植株的PCR检测结果表明,AtPI基因已经整合到了烟草基因组中。在T2代植株中,通过实时定量荧光PCR检测显示,AtPI在mRNA水平也均有表达。过量表达PI的转基因烟草在花器官中存在明显表型,与野生型相比主要表现为转基因植株花冠变小,雄蕊缩短,果实畸形且子房基部比野生型长5~10 mm,上述结果表明AtPI基因是特异性参与雄蕊和花瓣的发育并起着至关重要的作用。
拟南芥;PISTILLATA(PI);烟草;雄蕊;花瓣;子房
花是被子植物区别于其他植物类群最重要的特征之一,其发育是一个相对保守的过程,从营养生长向生殖生长的转化是一个复杂的多步骤协同完成的过程,根据对模式植物的分子遗传学研究结果表明,花的发育受多个转录因子的调控,并形成一个复杂的调控网络[1]。1990年,Yanofsky等从拟南芥中克隆出同源异型基因Agamous,从此打开了研究同源异型基因调节花发育作用的大门。之后由Angenent和Colombo基于对拟南芥及金鱼草的研究提出了“ABC”模型[2~5],该模型的三类功能基因组成分别介绍如下:A类功能基因有APETALA1(AP1)和APETALA2(AP2);B类功能基因有APETALA3(AP3)和PISTILLATA(PI);C类功能基因为AGAMOUS(AG)[6~7]。这三类基因的功能大致分别为以下几点:A类中AP1决定花分生组织形成,决定萼片和花瓣器官原基的发生;AP2则是与AP1共同决定该原基的发生;B类AP3和PI则是聚合在一起共同作用的共同控制花瓣、雄蕊发育;C类控制雄蕊、心皮的发育,使花芽发育具有确定性[8~11]。
PI作为控制花发育B类功能基因的一员,同样隶属于MADS-box家族,具有高度的保守性,目前对于PI基因的研究大部分都是通过利用拟南芥中的AtPI基因的保守序列进行设计引物在其它物种如:兰花、油菜、甘蓝等一些单子叶植物中进行PI基因的克隆及生物信息学分析,分析结果表明PI基因在进化程度上十分迅速,但PI基因在不同物种之间对花瓣及雄蕊发育的控制作用是极其保守的,同时王若琳,Liu等研究发现PI基因在花器官形成中对心皮的发育也有着重要的作用[12~13]。这对研究不同物种中控制花发育的基因丰富了理论基础[14]。
目前为止拟南芥中PI基因在烟草中异源表达研究报道较少。本实验根据拟南芥B类功能基因的高度保守性和组织特异性表达特征,从拟南芥花序中克隆PI基因、构建植物表达载体并进行烟草遗传转化。结果显示转基因烟草发生了显著的表型变化,且这些表型在以前的转基因拟南芥中未被发现。本研究不仅对植物花器官B类特征基因PI功能进行了新的补充,还丰富了对植物花发育的“ABC”模型的新的认识。
1 材料与方法
1.1 实验材料
本实验所需野生型烟草(Nicotianatabacum)和拟南芥(ArabidopsisthalianaCol-0)种子均为本实验室保存。
质粒提取、胶回收试剂盒购自OMEGA公司(美国);PCR相关试剂、DNA marker、限制性内切酶、T4DNA ligase、PrimeScriptTMRT reagent Kit购自TaKaRa公司(中国大连);EASYPureTMPlant RNA Kit、pEASY-T1、大肠杆菌Trans1-T1感受态购自Transgen(中国);农杆菌EHA105为本实验室保存;pROKII载体由山东师范大学张慧教授惠赠;其他实验试剂为进口或国产分析纯。
1.2 拟南芥花序总RNA提取及AtPI基因的克隆
用EASYPureTMPlant RNA Kit试剂盒提取拟南芥花器官的总RNA,采用PrimeScriptTMRT reagent Kit试剂盒进行cDNA合成。以cDNA为模版,利用表1中的引物(PI-F/R)进行PCR扩增,反应程序:94℃预变性4 min;94℃变性30 s;55℃退火30 s;72℃延伸1 min共35个循环,72℃再延伸7 min,PCR结束后全部产物进行1%琼脂糖凝胶电泳分析。利用凝胶回收试剂盒回收目的片段,将回收后的片段根据操作手册介绍方法连入pEASY-T1载体中,转化大肠杆菌Trans1-T1感受态,涂LB抗性平板(卡那抗性),对获得的单克隆经过菌落PCR验证,筛选后的阳性克隆命名为pEASY-T1-AtPI,送至哈尔滨博仕生物技术有限公司测序。

表1 本研究使用的引物
1.3 植物表达载体构建
通过表1引物(PI-F/R)扩增的目的片段,将获得的目的片段和pROKII载体质粒,同时利用限制性内切酶XbaⅠ、KpnⅠ进行双酶切,并分别凝胶回收目的片段,利用T4DNA ligase过夜连接转化大肠杆菌Trans1-T1感受态,涂LB抗性平板(卡那抗性),对获得的单克隆进过菌落PCR验证,筛选后的阳性克隆命名为pROKII-AtPI,送至哈尔滨博仕生物技术有限公司测序。
选取测序正确的质粒转化农杆菌EHA105,提取农杆菌中的质粒根据表1中的引物(pROKII-F/R)进行PCR检测。
1.4 转基因烟草获得及分子检测
通过根瘤农杆菌介导法进行烟草的遗传转化,转化过程如下:预培1~2 d;农杆菌(OD=0.6)侵染5 min;共培1 d;脱菌。经一个月后获得抗性株系。
对抗性株系进行分子检测,用CTAB方法提取抗性植株总DNA,利用表1引物进行PCR并用1%琼脂糖凝胶检测,筛选出阳性转基因株系。
1.5 转基因植株的实时定量荧光PCR检测
利用实时荧光定量PCR验证AtPI基因在转录水平的表达,将获得的转基因株系用EASYPureTMPlant RNA Kit试剂盒提取植株的总RNA,采用反转录试剂盒进行cDNA合成。将合成的第一链cDNA加去离子水稀释10倍,作为模版,以Ntactin为内参进行qRT-PCR扩增,扩增引物见表1。反应体系为20 μL;其中2×SYBR Green实时荧光染料混合液10 μL,ROX DyeⅡ 0.4 μL,2 μL cDNA模板,正向引物(PI-RT-F),反向引物(PI-RT-R)各0.8 μL。qRT-PCR的扩增条件为:95℃ 30 s;95℃ 5 s,60℃ 35 s,40个循环。每个样品进行3次重复,反应完毕后,获取数据并通过2-ΔΔCt法进行基因表达量差异分析。
1.6 过表达转基因烟草植株的表型观察
挑选表达量较高3个转基因株系及对照株系分别移栽10棵至温室,分别对其进行定期的观察,在移栽后60 d后开始开花,1周后进入盛花期,在顶部花序中,随机选取5朵刚刚开放的花,分别测量它们的花冠、柱头和雄蕊的长度,最后对测量的结果利用SPSS 19.0软件进行SNK差异性统计分析。
2 结果与分析
2.1 拟南芥花序总RNA提取及AtPI基因的克隆
利用RNA提取试剂盒,从拟南芥花序中成功提取总RNA(图1:A),并反转录为cDNA作为模版,进行PCR扩增1%琼脂糖凝胶电泳检测显示,获得条带与预期PI基因大小一致(图1:B)。将目的条带切胶回收后与T/A克隆载体pEASY-T1连接,转化大肠杆菌Trans1-T1,随机挑取单克隆,并经菌落PCR验证(图1:C),并对筛选出的阳性克隆进行测序检测,测序结果通过Bioedit生物软件进行分析,结果表明,克隆片段与目的基因100%相同,将测序正确的菌落命名为pEASY-T1-AtPI。
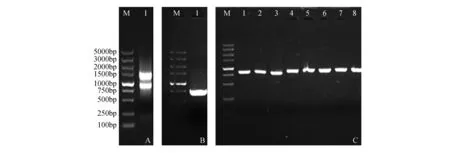
图1 拟南芥花序总RNA提取和AtPI基因的克隆鉴定 A.拟南芥总花序RNA:M. DNA marker DL5000;1.拟南芥花序总RNA;B.拟南芥PI基因的克隆:M. DNA marker DL5000;1. PI基因PCR产物;C. pEASY-T1-AtPI载体在大肠杆菌菌液中PCR检测:M. DNA marker DL5000;1~8. pEASY-T1-AtPI PCR产物Fig.1 The total RNA of A.thaliana inflorescences and clone and verification of AtPI gene A. Total RNA of A.thaliana inflorescences: M. DNA marker DL5000; 1. Total RNA of A.thaliana inflorescences; B. The cloning of PI gene: M. DNA marker DL5000; 1. PCR product of AtPI gene; C. PCR detection of pEASY-T1-AtPI in E.coli: M. DNA marker DL5000; 1-8. PCR product of pEASY-T1-AtPI
2.2 植物表达载体构建
植物表达载体图谱如图2所示,并根据该图谱进行载体构建。步骤如下:对测序正确的pEASY-T1-AtPI菌液提质粒,之后与pROKII载体质粒,同时用限制性内切酶XbaⅠ、KpnⅠ做双酶切,之后用1%琼脂糖凝胶电泳检测(图3:A),对目的片段切胶回收,并利用T4DNA ligase连接转化大肠杆菌Trans1-T1感受态,涂LB抗性平板(卡那抗性),随机挑取单菌落,进行菌落PCR验证,筛选出阳性克隆(图3:B),命名为pROKII-AtPI,将菌液送公司测序,结果表明,PI基因成功整合到pROKII载体上,之后通过液氮冻融法将pRIKII-AtPI质粒转化到农杆菌EHA105感受态细胞中,随机挑取8个单克隆,经PCR检测(图3:C),均为阳性克隆,并标记为EHA105(pROKII-AtPI)。
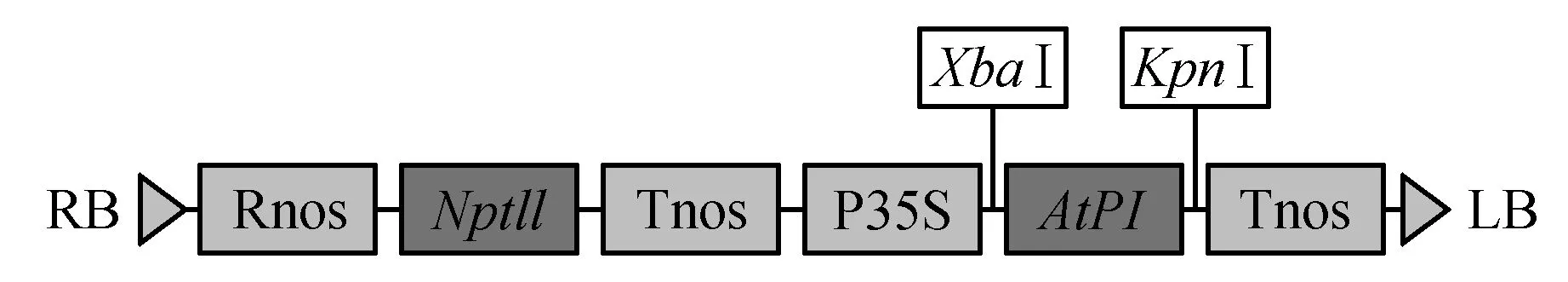
图2 植物表达载体pROKII-AtPI的构建图谱Fig.2 Plant expression vector constructs pROKII-AtPI map
2.3 转基因植株的获得及分子检测
用含有pROKII-AtPI农杆菌EHA105侵染烟草叶片,经4~6周的选择培养,从叶片周围生成大
量抗性芽。待抗性芽长出叶片后,将叶片切下放在含有卡那(50 mg·L-1)抗生素的分生培养基上继代培养(图4)。将两次分化获得的芽在生根培养基中进行生根定植,最终共获得12株转基因烟草植株。提取已获得有抗性的转基因株系的基因组DNA,利用表1中pROKII通用引物对其进行PCR扩增检测(图5),结果显示抗性植株中均含有目的基因,说明外源基因已经整合入烟草基因组中。
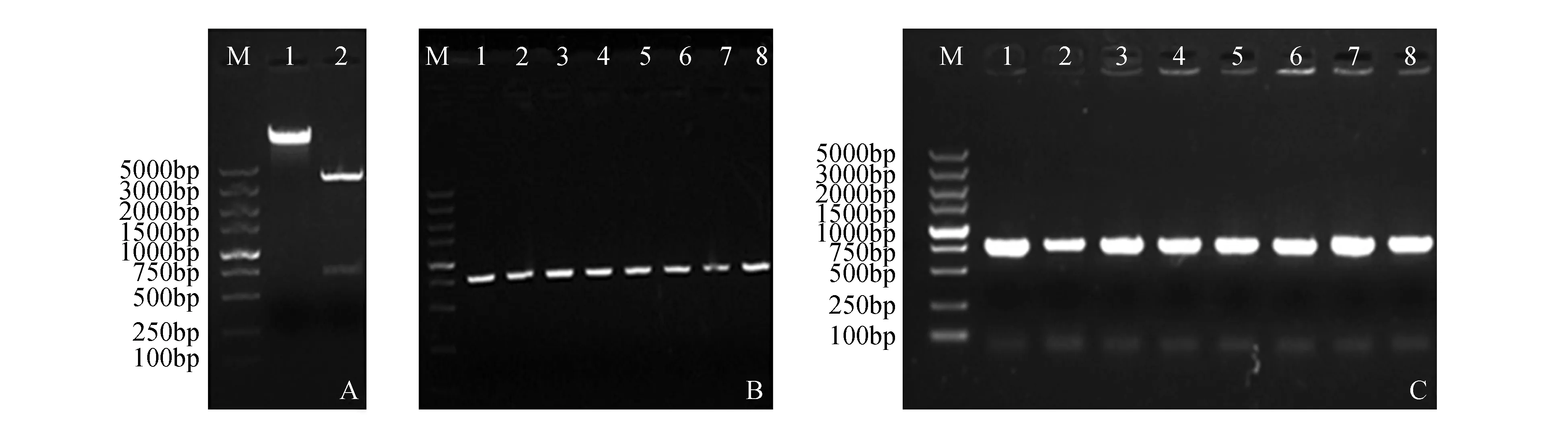
图3 植物表达载体pROKII-AtPI的构建及检测 A.限制性内切酶酶切产物的电泳结果:M. DNA marker DL5000;1. pROKII载体质粒双酶切条带;2. pEASY-T1-AtPI质粒双酶切条带;B.植物表达载体pROKII-AtPI的质粒PCR检测:M. DNA marker DL5000;1~8. pROKII-AtPI PCR产物;C.农杆菌EHA105转化子的菌液PCR检测:M. DNA marker DL5000;1~8. EHA105(pROKII-AtPI)转化子菌液PCR检测Fig.3 Construction and detection of plant expression vector pROKII-AtPI A. Electrophoretogram of restriction enzymes digestion: M. DNA marker DL5000; 1. Digestion of pROKII vector with XbaⅠ and KpnⅠ; 2. Digestion of pEASY-T1-AtPI with XbaⅠ and KpnⅠ; B. PCR detection of plant expression vector pROKII-AtPI: M. DNA marker DL5000; 1-8. PCR product of pROKII-AtPI; C. PCR detection of Agrobacterium-mediated transformation: M. DNA marker DL5000; 1-8. PCR products of transformants in Agrobacterium
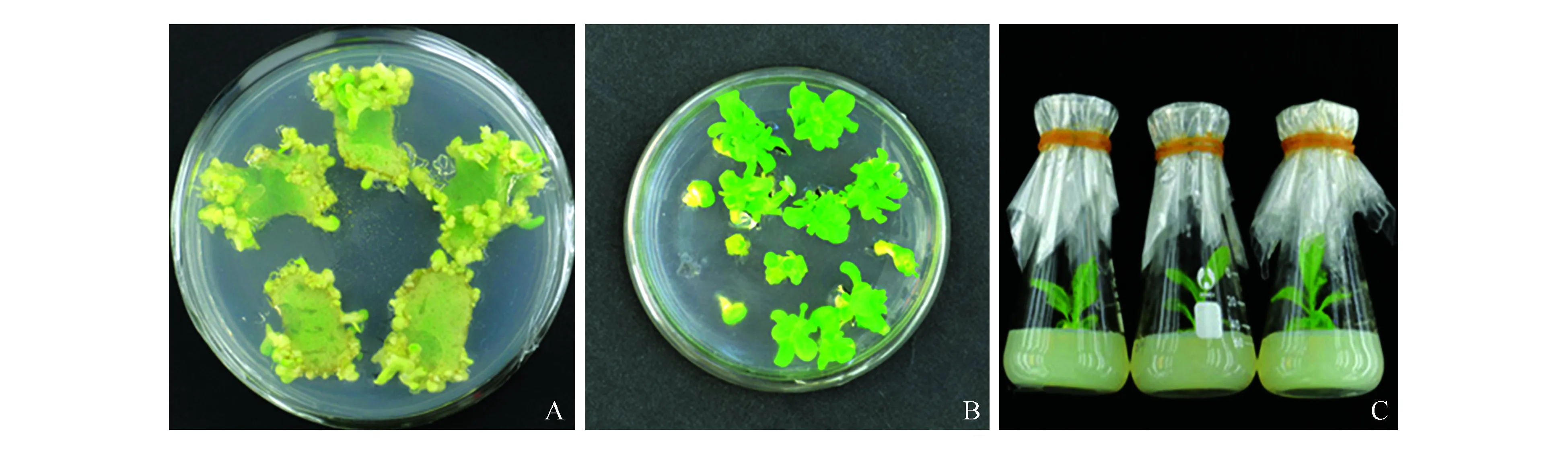
图4 转基因植株的获得 A~B.选择培养基上形成的抗性芽;C.转基因植株生根苗Fig.4 The obtaining of transgenic plants A-B.The putative transgenic shoot buds; C.The transgenic seedling for rooting
2.4 实时定量RT-PCR分析
为了研究拟南芥PI基因在烟草植株中的表达情况,提取烟草叶总RNA,进行实时荧光定量PCR检测。与野生型烟草比,拟南芥PI基因转化到烟草植株中均有表达,表达量较高的株系有1、5、7、8、9和11,表达量最高的株系是1、9、11(图6),选这3个株系用于下一步的后续分析。
2.5 转基因株系表型观测
将得到的转基因株系进行不定期观察,在营养生长期,未发现明显的形态学差异。待植株进入花器官发育至成熟期,发现转基因株系与野生型株系相比花冠变小、雄蕊变短(图7:A~B)。同时在雌蕊发育过程中,相对于野生型株系比较,子房基部多出一节,且形成畸形种夹型(图7:C)。分别选取3株转基因株系1、9、11和3株对照株系(每个株系顶端随机取5朵花),测量它们的花冠、柱头及雄蕊的长度,利用SPSS19.0软件,采用SNK方差齐性检验的方法对其差异显著性进行分析,结果如图8,转基因株系与野生型株系比,雄蕊及花冠显著变短,上述结果表明过表达PI基因影响转基因植株的花器官及果实的发育。

图5 转基因株系PCR检测 M. DNA marker DL5000;1~10. 10个抗性植株的DNA PCR检验;11. ddH2O作为阴性对照Fig.5 PCR detection of transgenic plants M. DNA marker DL5000; 1-10. PCR products of 10 independent transgenic tobacco; 11. ddH2O as a negative control
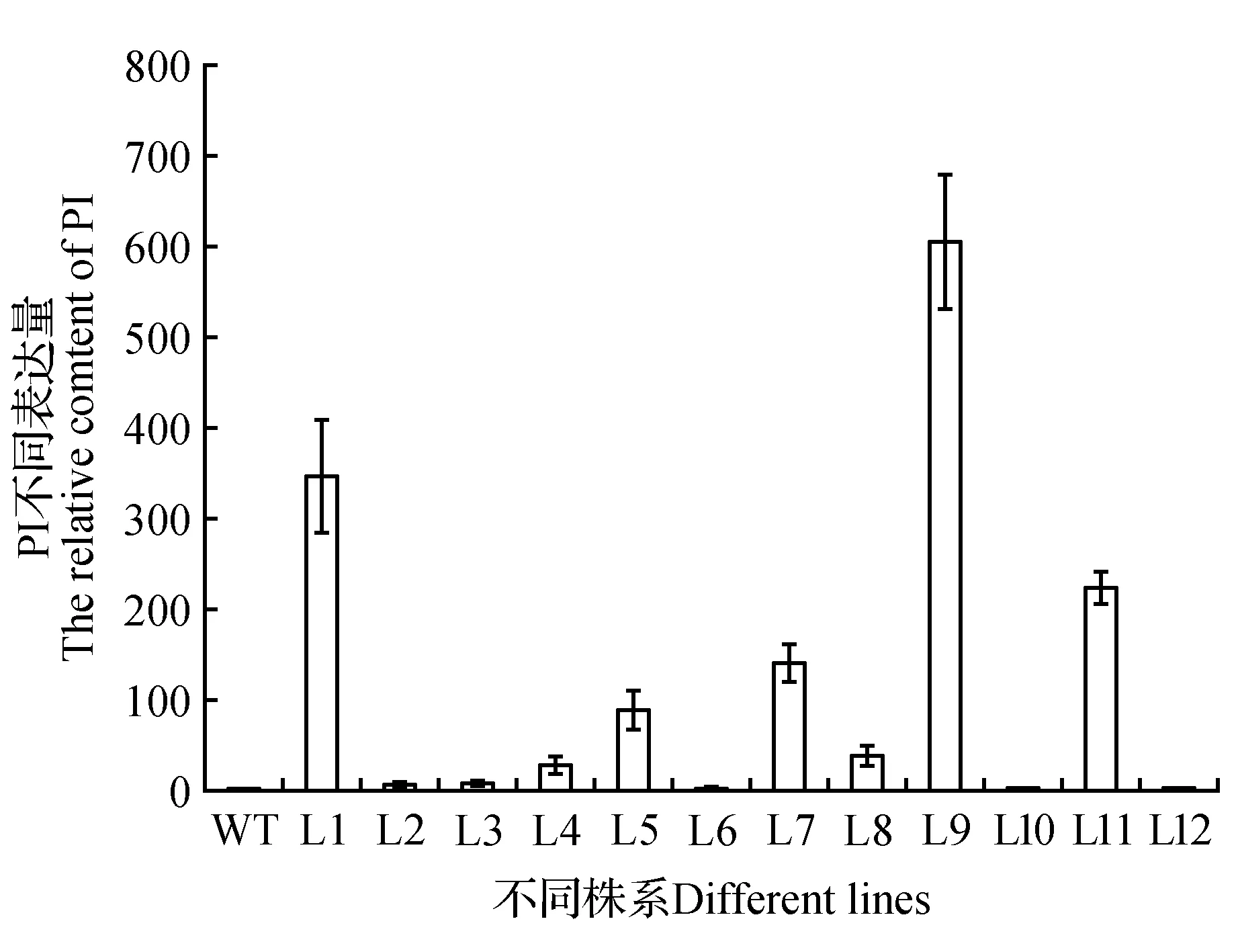
图6 转基因植株的qRT-PCR检测 WT. 野生型烟草;1~12. 12个PI转基因烟草植株Fig.6 qRT-PCR detection of transgenic plants WT. Wild-type tobacco; 1-12. Twelve PI transgenic tobacco plants

图7 转基因株系花器官表型分析 A.花冠大小观察;B.雄蕊大小比较;C.雌蕊子房差异观察 WT. 野生型对照植株;L1/L9/L11. 3个不同的转基因烟草株系Fig.7 Analysis of floral organ phenotype in transgenic plants A. Corolla size observation; B. Androecium size comparison; C. Ovary observed WT. Wild-type tobacoo; L1/L9/L11. Three different transgenic tobacco lines

图8 转基因烟草表型的统计分析 WT.野生型对照;L1/L9/L11. 3个不同的转基因株系Fig.8 Statistic analysis phenotype of transgenic tobacco WT. Wild-type control; L1/L9/L11. Three different transgenic lines
4 讨论
自1991年“ABC”模型被提出后,对于被子植物花器官的发育探究就受到了广泛的关注。根据对这三类功能基因的进化程度及生物信息学分析,表明除A类功能基因中的APETALA2(AP2)基因之外,其它基因都隶属于MADS-box家族,该家族在氨基酸的C端和N端具有高度的保守性,这表明基因虽然在进化程度上略有差异,但行使的特异性功能区域被保留下来,因此在不同物种中虽然花器官的形态各异,但其基本结构都大体一致。其中B类功能基因在拟南芥中包括PISTILLATA(PI)和APETALA3(AP3)这两个基因,它们对于雄蕊和花瓣的发育发挥着关键的作用[15~16],研究表明B类功能基因缺失,会导致雄蕊转化为心皮,花瓣则转化为萼片,这就会形成只有心皮和萼片的不完整花器官。根据目前的研究发现,PISTILLATA(PI)基因在单子叶和双子叶植物中对花瓣及雄蕊发育的调控具有高度保守性[17~19],但在生物信息学上分析表明,在不同物种中PI基因的保守区域高度一致,但在其它区域则差异性较大,因此PI基因对不同物种的花瓣及雄蕊发育的调节具有一定的差异,这主要表现在产生多态性的雄蕊及花瓣。
本实验为探究拟南芥PI基因异源表达功能,从拟南芥cDNA中克隆出PI基因,将PI基因转入烟草后发现了新的表型。在生殖生长阶段,与野生型相比,过表达PI的转基因烟草的花器官发生了明显的变化,主要表现在花冠的长度小于对照植株,同时雄蕊长度短于对照植株,通过SPSS软件分析数据显示变化明显。这个结果暗示,PI基因对于花瓣及雄蕊的发育是起一定作用的。同时本实验还发现转基因植株的雌蕊子房基部较野生型长出5~10 mm异常组织且子房畸形,其最终导致转基因烟草严重败育。该现象与Smykal P等人研究的转化SOC1基因的烟草具有相似的性状[20],这表明PI基因在促进花瓣及雄蕊发育的同时对心皮的发育产生了异常的调控作用,这在性别决定的种子植物中,PI可能具有激活雄性器官发育并抑制雌性器官发育[21~22]。研究表明,花瓣是由A类功能基因与B类功能基因共同作用形成的,雄蕊则是B类功能基因基因与C类功能基因共同作用形成的,心皮则是由C类功能基因单独作用形成的,本实验结果表明转基因株系的雌蕊基部变长、子房畸形导致转基因株系严重败育,这表明拟南芥PI基因在异源调控植物的花器官发育中起到一定的作用,同时也说明拟南芥PI基因可能与烟草中控制心皮发育的C类功能基因之间存在拮抗作用,而导致此现象。拟南芥PI基因在转基因植物中是通过怎样的方式促进雄蕊发育的同时抑制了心皮的发育仍需要进一步探究,以期对该现象作出机理性的阐述,挖掘出其潜在的应用价值,为败育机理提供理论基础。
1.徐启江.草原龙胆花器官MADS-BOX基因克隆与表达分析[D].哈尔滨:东北林业大学,2007.
2.Carpenter R,Coen E S.Floral homeotic mutations produced by transposon-mutagenesis inAntirrhinummajus[J].Genes Dev,1990,4(9):1483-1493.
3.华志明.植物成花分子机理研究的进展[J].植物生理学通讯,1998,34(1):74-79.
4.许智宏,刘春明.植物发育的分子机理[M].北京:科学出版社,1999.
5.余叔文,汤章城.植物生理与分子生物学:第2版[M].北京:科学出版社,1999:546-561.
6.胡晓梅,祝欣,王健美,等.油菜花蕾发育及开花过程中ABCD功能基因的表达差异分析[J].中国农业科技导报,2007,9(5):80-86.
7.王力先,王永飞.被子植物花发育的ABC模型研宄进展[J].安徽农学通报,2007,13(8):49-51.
8.郭滨.蝴蝶兰花发育相关B类MADS_box基因的克隆与鉴定[D].上海:复旦大学,2006.
9.马利超,王彦荣,刘志鹏.蒺藜苜蓿花器官特异基因的表达分析[J].遗传,2015,34(5):621-634.
10.Theissen G.Development of floral organ identity:stories from the MADS house[J].Curr Opin Plant Biol,2001,4(1):75-85.
11.Theissen G,Saedler H.Plant biology.Floral quartets[J].Nature,2001,409(6819):469-471.
12.王关林,方宏筠.植物基因工程原理与技术[M].北京:科学出版社,1998.
13.Liu Y G,Shirano Y,Fukaki H,et al.Complementation of plant mutants with large genomic DNA fragments by a transformation-competent artificial chromosome vector accelerates positional cloning[J].Proc Natl Acad Sci USA,1999,96(11):6535-6540.
14.Ditta G,Pinyopich A,Robles P,et al..The SEP4 gene ofArabidopsisthalianafunctions in floral organ and meristem identity[J].Curr Biol,2004,14(21):1935-1940.
15.Singh S K,Shukla A K,Dhawan O P,et al.Recessive loci Pps-1 and OM differentially regulatePISTILLATA-1 andAPETALA3-1 expression for sepal and petal development inPapaversomniferum[J].PLoS One,2014,9(6):e101272.
16.Liu S,Sun Y,Du X,et al.Analysis of theAPETALA3- andPISTILLATA-like genes inHedyosmumorientale(Chloranthaceae) provides insight into the evolution of the floral homeotic B-function in angiosperms[J].Ann Bot,2013,112(7):1239-5121.
17.Yanofsky M F.Floral meristems to floral organs:genes controlling early events inArabidopsisflower development[J].Annu Rev Plant Physiol Plant Mol Biol,1995,46:167-188.
18.张浩.蝴蝶兰花发育相关B族和C族MADS盒基因的功能研究[D].上海:复旦大学,2009.
19.Mara C D,Huang T,Irish V F.The Arabidopsis floral homeotic proteinsAPETALA3 andPISTILLATAnegatively regulate theBANQUOgenes implicated in light signaling[J].Plant Cell,2010,22(3):690-702.
20.Smykal P,Gennen J,De Bodt S,et al.Flowering of strict photoperiodicNicotianavarieties in non-inductive conditions by transgenic approaches[J].Plant Mol Biol,2007,65(3):233-242.
21.Wuest S E,O’Maoileidigh D S,Rae L,et al.Molecular basis for the specification of floral organs byAPETALA3 andPISTILLATA[J].Proc Natl Acad Sci U S A.2012,109(33):13452-13457.
22.LÜ L L,Duan J,Xie J H,et al.Cloning and expression analysis of aPISTILLATAhomologous gene from pineapple(AnanascomosusL.Merr)[J].Int J Mol Sci,2012,13(1):1039-1053.
ConstructionofPlantExpressionVectorandGeneticTransformationAnalysisofArabidopsisthalianaAtPIGeneinNicotianatabacum
LIU Cai-Xia ZHENG Tang-Chun DAI Li-Juan LIU Yi QU Guan-Zheng*
(State Key Laboratory of Tree Genetics and Breeding,Northeast Forestry University,Harbin 150040)
The flower is the main reproductive organs of the plants, plays an extremely important role in the process of breeding and thePISTILLATA(PI) gene, and as a member of the B functional gene, plays an important role in floral organ development. In order to explore the function ofPIgene in the development of petals and stamens, thePIgene inArabidopsisthalianawas used as the research object, and theAtPIgene was amplified from cDNA by PCR, and the plant expression vector(pROKⅡ-AtPI) was constructed and transformed into tobacco. By PCR, theAtPIgene was integrated into the tobacco genome. The T2 generation plants were detected by qRT-PCR, andAtPIwas also expressed at the level of mRNA. Transgenic tobacco plants exist obvious phenotype compared to wild-type tobacco, such as smaller corolla, shorter stamens, and abnormal ovary, which is 5-10 mm longer than wild-type tobacco. The specific participation in the development of stamens, petals and ovary meanwhile plays a crucial role is geneAtPI.
Arabidopsisthalian;PISTILLATA(PI);Nicotianatabacum;stamen;petal;ovary
教育部新世纪优秀人才支持计划项目(NCET-12-0808);国家自然科学基金项目(31370661)资助
刘彩霞(1990—),女,硕士研究生,主要从事林木遗传育种研究。
* 通信作者:E-mail:quguanzheng@yahoo.com
2015-11-25
Q943
A
10.7525/j.issn.1673-5102.2016.03.011

