四乙烯五胺功能化有序介孔氧化铝的合成及其CO2选择吸附性能研究
蒋晓萍,周 钰,许 琦
(1.盐城工学院化学化工学院,盐城 224051;2.常州大学材料科学与工程学院,常州 213164)
四乙烯五胺功能化有序介孔氧化铝的合成及其CO2选择吸附性能研究
蒋晓萍1,2,周 钰1,许 琦1
(1.盐城工学院化学化工学院,盐城 224051;2.常州大学材料科学与工程学院,常州 213164)
以九水硝酸铝为铝源,非表面活性剂柠檬酸为模板剂,稀氨水为沉淀剂合成有序介孔氧化铝(OMA)。以四乙烯五胺(TEPA)为活性组分,采用物理浸渍将其负载到OMA的内孔及比表面上,制备出氨基功能化的OMA用于CO2的选择吸附研究。采用XRD、BET和TEM对合成的吸附剂进行表征,通过自制的固定床反应器测量穿透曲线的方法研究其对CH4/CO2混合气的吸附分离性能。分别考察了负载量和吸附温度对吸附性能和分离因子的影响。结果表明,TEPA负载量为50%的吸附剂、吸附温度为70 ℃时对CO2吸附量最大,为2.598 mmol/g,TEPA/OMA经过10次吸附-脱附循环后,其吸附性能变化较小,仅下降了8.65%,具有较好的循环稳定性。
有序介孔氧化铝; 四乙烯五胺; CO2; 吸附性能; 分离因子
1 引 言
大气“温室效应”和全球气候变暖是人类在21世纪面临的最大环境问题和挑战。众所周知,CO2是大气中含量高、存留时间长的最重要的温室气体。近年来研究发现[1],CH4的温室效应是CO2温室效应的21倍,所以CH4的排放也是引起温室效应的主要原因。随着我国经济的飞速发展,占据能源结构较大比例的化石能源已逐渐出现供不应求的局面[2],一些列清洁能源如天然气、沼气,被大量推广使用。然而,天然气、煤层气[3]和沼气等除了含有主要成分CH4,还会存在一定量的CO2,其中CO2的存在不仅降低了燃气的热值,同时会腐蚀管道。另一方面,老气井的挖潜和新气田的开采伴随而来的是排放出大量的CH4,与空气中的CO2混合加剧“温室效应”。因此,不论是从节约能源还是环境保护的角度,对CH4/CO2混合气进行分离回收和利用是一件势在必行的事情。
常用的气体分离方法有深冷法、溶剂吸收法、膜分离法和吸附分离法[4]等。其中吸附分离法由于其高选择性成为目前气体分离领域中最有前景的方法,而在吸附分离法中至关重要的因素是吸附剂的选取。传统上主要选用炭基材料、沸石吸附剂[5],集中研究N2/CO2混合气体的分离过程,而对于CH4/CO2混合气体的分离及吸附材料的结构、吸附量和循环稳定性能有所忽略。现有的吸附剂材料很难同时满足高吸附量、高选择性、低能耗再生和物理化学稳定性的特点,所以开发新型的同时兼具以上几个特点的吸附剂,能够解决吸附分离CH4/CO2混合气体技术工业化的核心问题。
有序介孔氧化铝是一种非硅基介孔材料,具有较大的比表面积和孔容、表面酸性及出色的热稳定性,能够作为催化剂、吸附剂及催化剂载体应用于化工过程研究中,是理想的气体吸附分离材料[6]。因为CO2的四极矩大于CH4,CO2的极化率更大,而且CO2是酸性气体,为了提高CO2吸附量和选择性,在有序介孔氧化铝上引入亲CO2的碱性基团-NH2,增加材料的碱性位和孔道极性[7],增加CO2的吸附能力,以实现CH4/CO2的有效分离。因此,本文通过四乙烯五胺改性有序介孔氧化铝材料,并考察负载量和吸附温度对CH4/CO2吸附分离性能的影响。
2 实 验
2.1 材料的制备
按照相关文献[8]制备有序介孔氧化铝。首先,在室温下配制0.67 mol/L 的CA溶液,搅拌至澄清备用。然后,在80 ℃下将37.5461 g Al(NO3)3·9H2O溶解于50 mL去离子水中,搅拌30 min。再加入50 mL 0.67 mol/L 的CA溶液,继续搅拌1 h,用稀氨水(V氨水∶V水=1∶2)调节pH=8,密封状态下强力搅拌4 h后室温陈化10 h。抽滤并用去离子水和无水乙醇反复轮流洗涤3遍,放入80 ℃鼓风干燥箱中烘干,以2 ℃/min的升温速率在空气条件下升温至600 ℃煅烧6 h,随炉冷却至室温,得到有序介孔氧化铝(OMA)。
将一定量的TEPA溶于40 mL甲醇[9],搅拌至完全溶解后,边搅拌边加入10 g OMA载体,将烧杯密封,室温下搅拌24 h。搅拌结束后,将混合物放入表面皿上,在80 ℃鼓风干燥箱中烘干,即得到相应负载量的固态胺吸附剂TEPA/OMA,分别记为20wt%,40wt%,50wt%,60wt%。
2.2 材料的表征
采用美国Beckman Coulter SA3100型比表面积及孔径分析仪测定样品的N2吸附-脱附等温线。样品在吸附测试前需要在120 ℃下脱气15 min,以除去所吸附的水分子和气体分子。通过Brunauer-Emmett-Teller(BET)方程计算样品的比表面积。采用日本理学的D/max 2500PC X-射线分末衍射仪对样品进行物相分析,所用的管电压和电流分别是40 kV和40 mA且使用镍单色器和Cu Kα射线(λ= 0.15406 nm),扫描2θ范围1°~10°,扫描速度是4°/min。
2.3 CH4/CO2吸附分离性能和循环再生性能测试
在参照文献[10]自制的固定床反应器上测试CH4/CO2吸附分离性能,如图1所示。固定床反应器中所有管线均为不锈钢管,内径3 mm,壁厚0.5 mm。吸附柱为内径8 mm,长100 mm,壁厚1 mm的不锈钢管,管内壁在使用前经过无水乙醇的彻底清洗。床层入口处插入外径为1 mm的T型热电偶,控制进气温度。在吸附过程中,5 g吸附剂装填于吸附柱中,先在室温下通过抽真空至-0.10 MPa的方式除去吸附剂上所吸附的杂质分子,然后在常压下通入一定温度的100 mL/min 10% CO2/CH4混合气,气体流量有质量流量控制器控制。CH4和CO2的出口浓度由在线多组分气体分析仪(DF-OMT)分析。当CO2的出口浓度达到平衡时,则吸附测试过程结束。
吸附量和分离因子是由穿透曲线法[11],分别按照式(1)和(2)计算。
(1)
(2)

图1 自制固定床反应器流程图Fig.1 Flow diagram of self-fixed bed reactor
式(1)中m是指吸附剂质量,g;uo和ue分别代表进出口处的线速度,cm/s;yo和ye分别代表进出口气某组分的百分含量;A和L分别是指床层截面积和床层长度,cm2、 cm;C是气相总浓度,mol/L;ε是床层空隙率;P是吸附压力,kPa;T是吸附温度,K;R是气体常数,为8.314 J/(mol·K);t是吸附时间,s。饱和吸附量是当出口百分含量达到进口百分含量的95%时的吸附量。式(2)中x和y分别是指某组分的吸附相和气相摩尔分数,i和j分别是指气相和吸附相组分。
循环再生性能测试也在图1所示的固定床反应器上进行。吸附达到平衡后,通入120 ℃ 200 mL/min 纯N210 min,对吸附剂进行脱附过程。然后,降温到70 ℃,再次通入70 ℃ 100 mL/min 10% CO2/CH4混合气进行第二次吸附过程。最后,重复上述吸附-脱附过程10次来检测吸附剂的循环稳定性。
3 结果与讨论
3.1 X-射线衍射分析(XRD)
OMA和TEPA/OMA的小角度XRD图谱如图2所示。OMA在1.8°处出现一个尖峰,这是属于OMA的主要特征衍射峰。所有TEPA/OMA吸附剂在1.8°左右都保留了OMA的这个特征峰,说明浸渍前后样品的晶体结构没有发生本质性变化。但是TEPA/OMA的衍射峰强度随着负载量的增加逐渐减弱且变宽,而且衍射峰均向大角度方向有所移动[12],说明TEPA成功的负载到载体OMA上。

图2 TEPA/OMA吸附剂的XRD图谱Fig.2 XRD patterns of TEPA/OMA adsorbents
3.2 比表面积分析(BET)
以非表面活性剂柠檬酸为模板剂,共沉淀合成后煅烧除去柠檬酸,得到有序介孔氧化铝(OMA)。图3是有序介孔氧化铝(OMA)的N2吸附等温线和BJH孔径分布图。图(a)中的N2吸-脱附等温线属于Ⅳ型曲线,呈现出OMA的典型特征。当P/P0<0.4时,N2吸附量随着相对压力P/P0的增加而增加;在相对压力P/P0为0.4~1.0范围内有一个H1型滞后环,这一类型是在孔径分布相对较窄的介孔物质中才会出现的迟滞回线。从OMA的BJH孔径分布图上可以知道,OMA的孔径分布在10~30 nm之间,其分布范围较窄且出现一个强峰,平均孔径是17.39 nm,属于介孔材料(2~50 nm)。由此表明通过共沉淀法能够成功合成出单一且有序的介孔氧化铝(OMA),比表面积和孔容分别是223.75 m2/g和0.28 cm3/g。
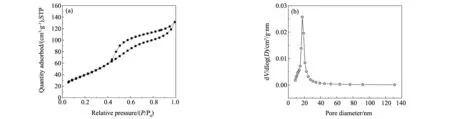
图3 有序介孔氧化铝(OMA)的N2吸附等温线(a)和BJH孔径分布图(b)Fig.3 N2 adsorption isotherms and BJH pore size distribution of OMA

图4 TEPA/OMA吸附剂的N2吸附等温线Fig.4 N2 adsorption isotherms of TEPA/OMA adsorbents
图4是不同TEPA负载量功能化后的OMA吸附剂的N2吸附等温线,图中,50%TEPA/OMA吸附剂的N2吸附等温线保持Ⅳ型,说明此时孔道依旧属于介孔结构。而当TEPA负载量超过60%后,N2吸附量非常小,说明此时吸附剂的孔道内被TEPA填满。从表1可以看出,50%TEPA/OMA吸附剂的比表面积和孔容分别为108.72 m2/g和0.11 cm3/g,而当TEPA负载量为60%时,吸附剂的比表面积和孔容分别仅为4.62 m2/g和0.02 cm3/g,说明此时四乙烯五胺(TEPA)已经将OMA载体的孔道堵塞甚至覆盖了整个表面。
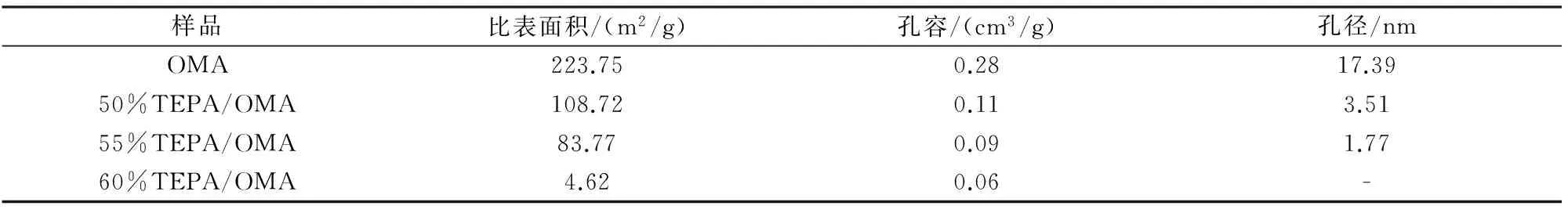
表1 TEPA/OMA吸附剂的孔结构性质Tab.1 The pore structure properties of TEPA/OMA adsorbents
3.3 透射电镜分析(TEM)

图5 (a)OMA和(b)50%TEPA/OMA吸附剂的TEM图Fig.5 TEM images of OMA and TEPA/OMA adsorbents
图5是OMA和50%TEPA/OMA吸附剂的透射电镜图像。由图5a可以清晰的看到OMA呈现出规则的“蠕虫”状孔道结构,孔径大小基本一致且分布均匀。图5b的TEM图像显示,50%TEPA/OMA吸附剂仅仅只是在OMA的表面上覆盖了一层薄膜,经过TEPA负载并不会改变OMA的孔道有序性。
3.4 TEPA负载量对CO2选择吸附性能的影响
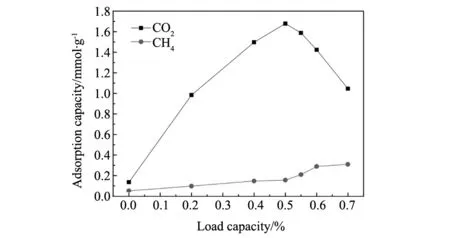
图6 不同负载量TEPA/OMA的吸附性能Fig.6 The adsorption capacity of TEPA/OMA adsorbents
25 ℃下,控制进气组成为10%CO2/CH4,进气流量是100 mL/min,对比不同TEPA负载量的吸附剂对混合气中CO2选择吸附能力的影响,如图6所示。从图上可以看出,OMA本身对CO2和CH4的平衡吸附量分别约为0.135 mmol/g和0.0515 mmol/g,而且两种气体之间的分离因子也仅为0.2913,说明此时的OMA与气体分子之间仅存在范德华力,属于单一的物理吸附过程。经过有机胺TEPA负载后,TEPA/OMA的CO2吸附量随着负载量的增加而增大,这是由于负载后的吸附表面存在很多碱性位点,而CO2是酸性气体,能与TEPA分子中的胺基发生酸碱化学反应生成氨基甲酸盐,从而增加对CO2的吸附量。当TEPA负载量为50wt%时,吸附剂的CO2吸附量达到最大,为1.679 mmol/g,远远超过文献[13]所报道的APTES/OMA吸附剂的CO2吸附量(0.639 mmol/g)。然而,当负载量超过50wt%,CO2的吸附量随着负载量的增加而减少,主要是因为负载量已超过材料的孔容,有机胺TEPA分子把OMA的孔道填堵塞,一方面造成材料对CO2气体的物理吸附大大下降,另一方面增加了CO2气体的扩散阻力以及减少了气体分子与材料表面活性位点的有效接触面积,从而导致CO2的化学吸收反应不能充分进行。50%TEPA/OMA与OMA的选择吸附性能对比如表2所示,从表2的数据中可以看出当CO2吸附量达到最大时,吸附剂对CO2的选择性也得到了大大提高,其分离因子增加到1.1989。

表2 50%TEPA/OMA与OMA的选择吸附性能Tab.2 The selective adsorption of OMA and 50%TEPA/OMA adsorbents
3.5 吸附温度对CO2选择吸附性能的影响
吸附温度在CO2吸附过程中是一个非常重要的影响因素,以常温下吸附性能最好的吸附剂50%TEPA/OMA为研究对象,在100 mL/min 的10%CO2/CH4的混合气中测试了吸附温度分别25 ℃、40 ℃、55 ℃、70 ℃、85 ℃和100 ℃时的CO2选择性吸附能力,如图7所示。当吸附温度温度从25 ℃增加到70 ℃时,CO2的吸附量增加至2.598 mmol/g,而继续升高吸附温度至100 ℃,CO2的吸附量却下降至2.092 mmol/g。这是因为 CO2吸附过程被认为是一个动力学与热力学相结合的过程,且CO2的化学吸收是一个放热反应,所以相对较低的温度比较有利于CO2的吸收。但是有机胺TEPA是一种高粘度的液体,反应活性较低。当温度低于70 ℃时,CO2的吸附过程主要由动力学控制。升温至70 ℃时,TEPA分子的活性增强且分散更均匀,气体分子的活性也有所增强,CO2分子能够克服扩散阻力与更多的活性位点发生反应,提高CO2的吸附量。随着吸附温度继续升高,CO2吸附过程转变成由热力学主导,所以CO2吸附量有所下降。另外,CH4的吸附量一直随着温度升高而轻微下降,主要是因为CH4与吸附剂之间的吸附作用是非常弱的范德华力,而温度的升高加快了CH4的扩散速度导致吸附量的下降。不同温度下,50%TEPA/OMA对10%CO2/CH4混合气的分离因子列于表3中,其中70 ℃时分离因子达到最大。

表3 不同温度下的分离因子Tab.3 CO2/CH4 separation factor under different temperatures
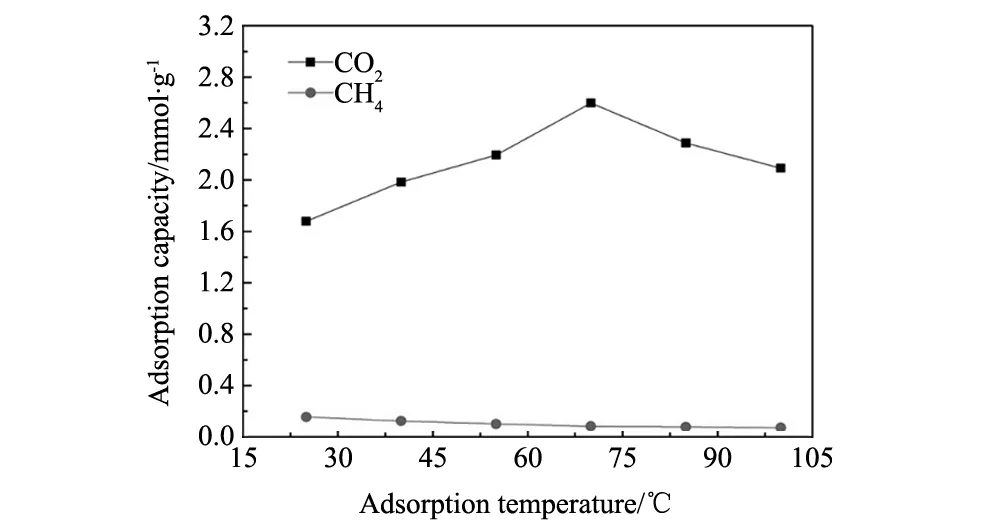
图7 不同温度下50%TEPA/OMA的吸附性能Fig.7 Adsorption capacity of 50%TEPA/OMA adsorbents under different temperatures

图8 50%TEPA/OMA的吸附-脱附循环性能Fig.8 Adsorption-desorption cycling performance of 50%TEPA/OMA adsorbent
3.6 循环再生性能
在实际工业应用中,出色的吸附性能和优越的再生性能是选择吸附剂的两个重要因素。本文在120 ℃时用200 mL/min 纯N2对吸附饱和的50%TEPA/OMA吸附剂进行脱附10 min,再降温至70 ℃进行选择性吸附来测试50%TEPA/OMA吸附剂的循环稳定性。图8是50%TEPA/OMA吸附剂经过10次吸附-脱附循环后CO2饱和吸附量的变化。从图上可以看出,10次循环后50%TEPA/OMA吸附剂的CO2饱和吸附量保持在2.3732 mmol/g,大约下降了8.65%,接近于文献[14]报道的60%TEPA/modified nanosepiolite 吸附剂的再生能力(下降了7.89%)。这可能是由于碱性基团的再生不完全或者所负载的TEPA在高温下会随N2气流而持续挥发所导致的。吸附-脱附循环测试结果表明,50%TEPA/OMA吸附剂具有相对稳定的CO2吸附量,没有发生明显的劣化,具有很大的应用潜力和商业前景。
4 结 论
通过物理浸渍法将有机胺TEPA负载到有序介孔氧化铝上制备出用于选择性吸附CO2的固态胺吸附剂TEPA/OMA。当TEPA负载量为50wt%,吸附温度是70 ℃时,CO2的饱和吸附量达到最大,是2.598 mmol/g,大大超过OMA本身的吸附性能。另外,当达到CO2最大吸附量时,50% TEPA/OMA吸附剂对10%CO2/CH4混合气的分离因子达到3.499。该吸附剂经过10次吸附-脱附循环后,其结构性质没有发生本质变化,CO2吸附性能也保持在原来吸附性能的91.35%,循环稳定性能较好,具有很大潜力用于工业化捕集CO2。
[1] Masoud M,Fatemeh G.Gas adsorption separation of CO2/CH4system using zeolite 5A[J].MicroporousandMesoporousMaterials,2014,200:1-10.
[2] Tagliabu M,Farrusseng D,Valencia S,et al.Natural gas treating by selective adsorption: Material science and chemical engineering interplay[J].Chem.Eng.J.,2009,155(3):553-566.
[3] Flores R M.Coalbed methane: From hazard to resource[J].Int.J.Coal.Geol.,1998,35(1-4):3-26.
[4] 江 皓,吴全贵,周红军.沼气净化提纯制生物甲烷技术与应用[J].中国沼气,2012,30(2):8-13.
[5] Jadhav P D,Chatti R V,Biniwale R B,et al.Monoethanol amine modified zeolite 13x for CO2adsorption at different temperatures[J].EnergyFuels,2007, 21:3555.
[6] 黄能武.介孔氧化铝的制备与应用[D].天津:天津大学学位论文,2010,06.[7] Liu J,Cheng D,Liu Y,et al.Adsorption removal of carbon dioxide using polyethyleneimine supported on propanesulfonic-acid-functionalized mesoporous SBA-15[J].EnergyFuels,2013,27(9):5416-5422.
[8] 马 媛.介孔氧化铝的制备[D].上海:华东理工大学学位论文,2013.
[9] Yao M,Dong Y,Hu X,et al.Tetraethylenepentamine-modified silica nanotubes for low-temperature CO2capture[J].EnergyFuels,2013,27:7673-7680.
[10] Yao M,Dong Y,Xie J,et al.Preparation of polyethylenimine-functionalized silica nanotubes and their application for CO2adsorption[J].ActaPhysico-ChimicaSinica,2014,30:789-796.
[11] 阮红征.CO2/N2混气体吸附分离研究[D].天津:天津大学学位论文,2010.
[12] Xu X,Song C,Andresen J M,et al.Novel polyethylenimine modified mesoporous molecular sieve of MCM-41 type as high-capacity adsorbent for CO2capture[J].EnergyFuels,2002,16:1463-1469.
[13] 王亚坤,赵瑞红,冯晓霞,等.氨基化有序介孔氧化铝合成及吸附CO2性能研究[J].材料导报B:研究篇,2012,26(8):71-74.
[14] Maryam L,Maohong F.Modified nanosepiolite as an inexpensive support of tetraethylenepentamine for CO2sorption[J].NanoEnergy,2015,11:235-246.
Synthesis of TEPA-functionalized Organized Mesoporous Alumina and Their Selective Adsorption of CO2
JIANGXiao-ping1,2,ZHOUYu1,XUQi1
(1.School of Chemistry & Chemical Engineering,Yancheng Institute of Technology,Yancheng 224051,China;2.School of Materials Science & Engineering,Changzhou University,Changzhou 213164,China)
Organized mesoporous alumina (OMA) was synthesized by Al(NO3)3·9H2O, non-surfactant CA was used as template, dilute ammonia as precipitating agent. Solid amine adsorbents were prepared by introducing tetraethylenepentamine (TEPA) into OMA by physical impregnation method for CO2capture. The synthesized adsorbents were charactered by XRD, N2adsorption-desorption and TEM. The adsorption separation properties of CH4/CO2were discussed by means of breakthrough curve analysis in self-made fixed bed and the effects of TEPA loadings and adsorption temperatures were investigated. The results show that the maximal adsorption capacities are 2.598 mmol/g achieved as 50% TEPA loadings and 70 ℃ adsorption temperature. In addition, after ten cyclic adsorption-desorption tests, the CO2adsorption capacity changes a little, just decreases about 8.65%, demonstrating the TEPA/OMA adsorbent displays am excellent regenerability.
organized mesoporous alumina;TEPA;CO2;adsorption property;separation factor
科技部2016年国家重点研发计划(JFYS2016ZY01003568)
蒋晓萍(1991-),女,硕士.主要从事功能材料的研究
许 琦,教授.
TD98
A
1001-1625(2016)09-2798-06

