1 株产壳聚糖酶细菌的分离、鉴定和发酵条件优化
冯志彬,薛 钰,陈国忠,张 娟,罗 乐,程仕伟
(1.鲁东大学生命科学学院,山东 烟台 264025;2.鲁东大学农学院,山东 烟台 264025)
1 株产壳聚糖酶细菌的分离、鉴定和发酵条件优化
冯志彬1,薛钰1,陈国忠1,张娟2,罗乐1,程仕伟1
(1.鲁东大学生命科学学院,山东 烟台 264025;2.鲁东大学农学院,山东 烟台 264025)
从烟台海岸带沙质土壤中分离筛选壳聚糖酶产生菌株,对其进行分类鉴定,优化其发酵条件,为酶法生产壳寡糖提供技术依据。通过透明圈法初步判断产酶能力,液体发酵复筛测定酶活力,筛选到酶活力达36.20 U/mL的菌株amyP216。通过菌体形态、菌落特征、生理生化及16S rDNA序列分析鉴定菌株amyP216为莫哈韦芽孢杆菌(Bacillus mojavensis)。通过单因素和正交试验确定最佳发酵条件为:胶体壳聚糖添加量20 g/L、酵母浸粉添加量12.5 g/L、吐温-80添加量1.0 g/L、初始发酵pH 6.0、发酵温度30 ℃。在最优条件下利用5 L自控发酵罐培养45 h壳聚糖酶活力可达到80.60 U/mL,较优化前(36.20 U/mL)提高了1.2 倍。莫哈韦芽孢杆菌amyP216是一株壳聚糖酶活力较高的生产菌株,具有潜在的研究和应用价值。
莫哈韦芽孢杆菌;壳聚糖酶;壳寡糖;分离鉴定;发酵条件优化
壳聚糖是甲壳素脱乙酰基后的产物,为自然界中唯一存在的碱性多糖,储量丰富,但溶解性较差,应用受到极大限制,而其降解产物壳寡糖具有优良的水溶性,且具有多种生物活性如抗菌、提高机体免疫力和抗肿瘤等,在保健食品、生物医学、化学工业、化妆品、农业、饲料等领域有着广泛的应用[1-3]。壳聚糖的水解工艺主要包括化学水解法和酶水解法,与传统化学水解法相比,酶解法更易控制,底物特异性强,副产物少,环境无污染,是生产壳寡糖的首选方法[4]。壳聚糖酶(chitosanase)又称壳聚糖-N-乙酰-氨基葡糖苷水解酶,专一性水解壳聚糖中的β-1,4-糖苷键,是制备壳寡糖理想的酶制剂[5-6]。除制备壳寡糖外壳聚糖酶还具有其他用途,如在农业上可作为生物防治剂以及在生物技术中可用于原生质分离、细胞化学定位和生产单细胞蛋白等[7]。
壳聚糖酶在细菌、放线菌、真菌及病毒等微生物中均有存在,针对以上微生物产壳聚糖酶的应用研究较为广泛,主要集中在菌株筛选、培养条件优化及工程菌构建等多个方面,并取得了一定的成果[8-10]。2012年王艳君等[11]从福建潮间带泥样中筛选到1 株青霉菌,通过优化培养条件壳聚糖酶活力达到18 U/mL,同年Sinha等[12]分离到1株链霉菌,利用壳聚糖无机盐培养基在32 ℃条件下培养3 d,壳聚糖酶活力达到6 U/mL。2015年阎贺静等[13]研究了碳源对烟曲霉WHSW-01菌株诱导产生壳聚糖酶活力的影响,最终酶活力达到6.78 U/mL,较优化前提高了83.24%。2000年Rivas等[14]克隆Bacillus subtilis 168中壳聚糖酶基因又在该菌中高效表达,酶的比活力达到56.9 U/mg。2015年Sun Yuying等[15]克隆微小杆菌OU01壳聚糖酶基因,构建pCT7-CHISP6H载体,在大肠杆菌BL21(DE3)中表达,壳聚糖酶活力达到67.56 U/mL。但由于产酶菌株产酶量及酶活性普遍较低,难以规模化生产和广泛应用。因此继续筛选产酶量高的其他微生物来源的壳聚糖酶,得到具工业化潜在应用价值的新酶源,是充分发挥壳聚糖酶功能和壳寡糖工业化生产的关键。本实验从烟台海岸带附近沙质土壤中分离出1 株产壳聚糖酶活性较高的菌株,对其进行种属鉴定及发酵条件优化,为工业化生产壳聚糖酶及酶法制备壳寡糖提供理论依据。
1 材料与方法
1.1材料与试剂
分离样品:烟台海岸带沙质土壤。
细菌微量生化鉴定管 北京奥博星生物技术有限责任公司;细菌基因组DNA提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒、Taq DNA聚合酶 生工生物工程(上海)股份有限公司;所用试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2培养基
斜面保藏培养基(g/L):酵母浸粉5、蛋白胨10、NaCl 5、琼脂20,pH 7.0,121 ℃灭菌20 min。
筛选培养基(g/L):胶体壳聚糖10.0、NH4Cl 5.0、MgSO40.5、KH2PO42、酵母浸粉1、琼脂20,pH 6.5,121 ℃灭菌20 min。
液体种子培养基(g/L):胶体壳聚糖10、酵母浸粉5、MgSO40.5、NaCl 2.5、KH2PO42,pH 6.5,121 ℃灭菌20 min。
发酵培养基(g/L):胶体壳聚糖20、酵母浸粉10、MgSO40.5、NaCl 2.5、KH2PO42、CaCl20.1,pH 6.5,121 ℃灭菌20 min。
1.3仪器与设备
SPX-150B-Z生化培养箱 广东省医疗器械厂;T100 PCR仪 美国Bio-Rad公司;ZWY-111G恒温振荡摇床 上海智城分析仪器制造有限公司;LDZX-75KB高压灭菌锅 上海申安医疗器械厂;TGL-16B高速离心机上海安亭科学仪器厂;BGZ-5自控发酵罐 上海保兴生物设备公司。
1.4方法
1.4.1菌株筛选
将土样用无菌水稀释后,涂布于筛选培养基平板上,于30 ℃培养箱中培养48 h。挑选有明显透明圈的菌落,划线分离纯化,将划线后长出的单菌落接入摇瓶发酵培养基中进行产酶复筛,30 ℃恒温摇床中培养60 h,离心后取发酵上清液测定酶活力,将酶活力高的菌株保存并鉴定。
1.4.2菌株鉴定
1.4.2.1菌株形态及生理生化鉴定
肉眼观察细菌在分离培养基上的菌落形态、颜色等;经过革兰氏染色后,在光学显微镜下观察和拍照。参照《常见细菌鉴定手册》[16]和文献[17]中的生理生化鉴定指标,对待测菌株进行V.P.实验、甲基红实验、耐盐性实验、接触酶实验、糖醇发酵实验、淀粉水解和明胶液化等生理生化指标测定。
1.4.2.2分子生物学鉴定
利用细菌基因组DNA提取试剂盒提取菌株的基因组DNA,并以此为模板采用16S rDNA基因的通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR扩增。反应条件为:95 ℃ 5 min;93 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min 10 s,25 个循环;72 ℃ 10 min[17]。PCR产物经琼脂糖凝胶电泳检测鉴定后,交由北京六合华大基因科技股份有限公司测序。测序结果经GenBank上利用BLAST程序进行相似性比对,运用MEGA 5.0的邻接(neighbor-joining,NJ)法构建系统发育树。
1.4.3发酵方法
1.4.3.1种子培养
取甘油管保藏菌种划线至LB斜面培养基,30 ℃培养24 h,保存至4 ℃冰箱备用;挑取单菌落接种至液体种子培养基,30 ℃、200 r/min培养24 h,即为种子液。
1.4.3.2摇瓶发酵培养
按5%接种量将种子液接入发酵培养基,500 mL三角瓶装50 mL发酵培养基,30 ℃、220 r/min培养60 h。
1.4.3.3发酵罐培养
按5%接种量将种子液接入装有3 L发酵培养基的5 L自控发酵罐中,转速600 r/min,通气量2 L/min,温度30 ℃。
1.4.4产酶条件优化
1.4.4.1不同碳源对菌株amyP216产壳聚糖酶的影响
在基础发酵培养基其余组分和培养条件保持不变的情况下,分别添加20 g/L的胶体壳聚糖、淀粉、蔗糖、羧甲基纤维素、葡萄糖及胶体几丁质作为发酵产酶的碳源,30 ℃、200 r/min条件下振荡培养60 h,检测壳聚糖酶活力,确定最佳碳源。实验重复3 次取平均值。
1.4.4.2不同氮源对菌株amyP216产壳聚糖酶的影响
分别添加10 g/L的酵母浸粉、蛋白胨、玉米浆、NaNO3、NH4Cl及尿素作为发酵的氮源,30 ℃、200 r/min振荡培养60 h,检测壳聚糖酶活力,确定最佳氮源。实验重复3 次取平均值。
1.4.4.3表面活性剂对菌株amyP216产壳聚糖酶的影响
以最适碳氮源为基础,分别添加1 g/L的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、吐温-60、吐温-80、司盘-80、曲拉通X-100表面活性剂,以不加表面活性剂的基础发酵培养基为对照组,30 ℃、200 r/min振荡培养60 h,检测壳聚糖酶活力,确定最佳表面活性剂。实验重复3 次取平均值。
1.4.4.4起始pH值对菌株amyP216产壳聚糖酶的影响
在其他培养条件一致的情况下,将培养基的起始pH值分别调至5.0、5.5、6.0、6.5、7.0、7.5,接种后于30 ℃、200 r/min条件下振荡培养60 h,检测壳聚糖酶活力,确定最适pH值。实验重复3 次取平均值。
1.4.4.5发酵温度对菌株amyP216产壳聚糖酶的影响
在其他培养条件一致的条件下,分别在26、28、30、33、35、37 ℃条件下振荡培养60 h,检测壳聚糖酶活力,确定最适发酵温度。实验重复3 次取平均值。
1.4.4.6正交试验设计
以胶体壳聚糖添加量、酵母浸粉添加量、吐温-80添加量、起始pH值和发酵温度为变量,以壳聚糖酶活力为指标,进行L16(45)正交试验,确定最佳发酵条件。
1.4.5指标测定
1.4.5.1壳聚糖酶活力测定
发酵液离心取上清液(必要时作适当稀释)0.1 mL加入0.02 mol/L pH 5.6 的HAc-NaAc缓冲液1 mL,pH 5.6,10 g/L粉末壳聚糖的HAc溶液0.9 mL,50 ℃水浴15 min后加3,5-二硝基水杨酸试剂1.5 mL终止反应,沸水浴5 min显色,冷却后定容至25 mL,离心,取上清液测520 nm波长处的吸光度。等量煮沸灭活的发酵液作为空白对照。并绘制氨基葡萄糖标准曲线,计算反应液中的还原糖含量,换算壳聚糖酶的酶活力。酶活力单位定义[18]:每毫升酶液每分钟产生1 μmol还原糖所需的酶量为一个酶活力单位(U)。
1.4.5.2菌体生物量和溶氧(dissolved oxygen,DO)测定
发酵液取样10 mL,10 000 r/min离心10 min,取沉淀菌体105 ℃烘干至恒质量,称量菌体干质量,即为菌体生物量。
DO由发酵罐溶氧电极测定,可在发酵罐显示屏直接读出。
1.5数据统计与分析
2 结果与分析
2.1产壳聚糖酶菌株的筛选
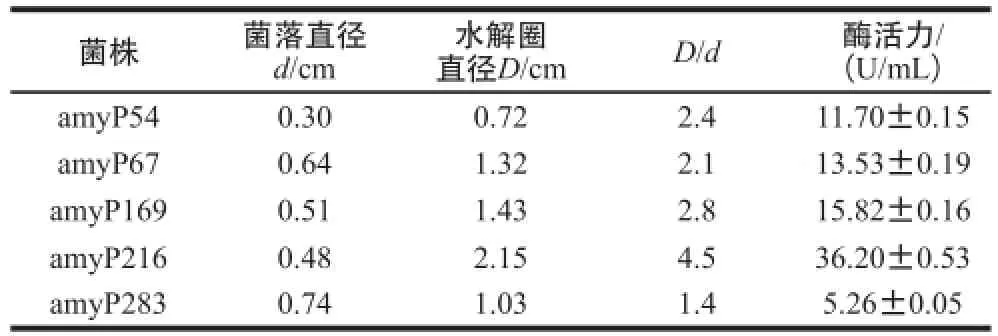
表1 产壳聚糖酶菌株水解圈直径和菌落直径的比值Table1 D/d (ratio of hydrolysis zone diameter to colony diameter)values of the chitosanase-producing strains
由表1可知,利用壳聚糖酶筛选培养基,从烟台海岸带沙质土壤中分离到5 株水解圈较大的菌株,通过分离纯化并进行摇瓶复筛,发现菌株amyP216的产壳聚糖酶能力较强,初始酶活力达到36.20 U/mL,且产酶稳定,以此菌为进一步实验的菌株。
2.2菌株amyP216鉴定
2.2.1菌落形态及生理生化指标鉴定
菌株amyP216在筛选培养基上培养24 h菌落呈乳白色、近圆形、菌落中央凸起、不透明、有褶皱、无光泽、边缘不规则、易挑取,菌落直径3~4 mm左右(图1a);通过显微镜观察,杆状、单个不成链、革兰氏阳性,培养48 h后观察芽孢着生在菌体中间或侧端位置,不膨大或个别细胞轻微膨大,椭圆形或柱形(图1b)。
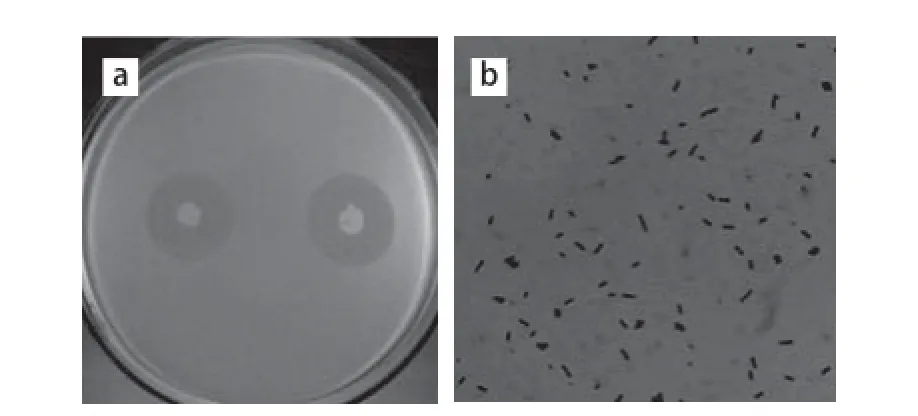
图1 菌株amyP216菌落形态(a)和革兰氏染色结果(b)(×1 000)Fig.1 Colony morphological characteristics (a) and gram staining (b)of strain amyP216 (× 1 000)
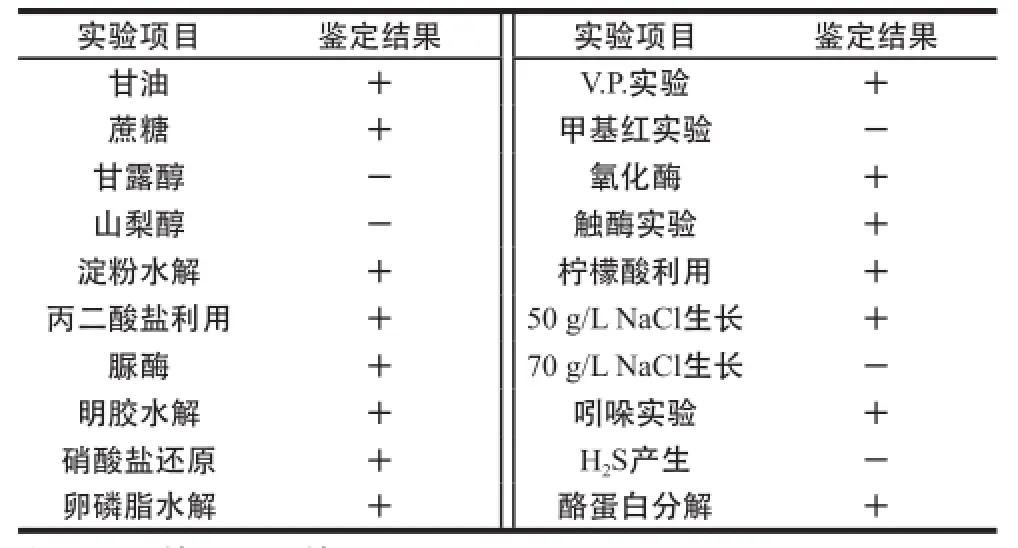
表2 菌株amyP216的生理生化特征Table2 Physiological and biochemical characteristics of strain amyP216
菌株amyP216进行生理生化实验结果(表2)表明,甲基红实验、硫化氢产生实验呈阴性,不能同化利用山梨醇和甘露醇,在70 g/L NaCl的培养基中不能生长,其他实验均为阳性。
综合上述实验结果,结合形态学特征,依据《常见细菌系统鉴定手册》,初步将菌株amyP216鉴定为芽孢杆菌属(Bacillus sp.)。
2.2.2菌株分子生物学鉴定

图2 基于16S rDNA序列的系统发育进化树Fig.2 Phylogenetic tree based on 16S rDNA sequences of selected strains
菌株amyP216经DNA提取、PCR扩增和测序获得的16S rDNA基因序列长度为1 466 bp,将其序列信息提交到GenBank,获得登录号KF496886,利用BLAST程序将所得基因序列与GenBank数据库的序列进行比对,选取与其相似度较高且已定名的菌株的16S rDNA基因序列构建系统发育进化树(图2)。相似度比较分析结果表明菌株amyP216与莫哈韦芽孢杆菌(Bacillus mojavensis)的同源关系最近,相似度高达99%以上。结合形态学和生理生化鉴定结果,确定amyP216菌株为莫哈韦芽孢杆菌。保藏在中国典型培养物保藏中心,保藏号为:CGMCC No. 7187。
2.3产酶条件优化研究
2.3.1碳源对产壳聚糖酶发酵的影响
碳源是供给微生物生命活动所需能量、构成菌体细胞以及合成代谢产物的物质基础。添加不同碳源进行发酵实验,结果见图3。胶体壳聚糖作碳源最有利于产酶,壳聚糖酶活力达到40.20 U/mL,远高于其他碳源的发酵效果,说明菌株amyP216产生的壳聚糖酶是诱导酶,在底物壳聚糖的诱导作用下方可大量产生,这和文献[12-13,18]的报道也是一致的。蔗糖和葡萄糖虽然有利于菌体生长(数据未显示)却不利于产酶,胶体几丁质基本无法被菌体同化利用,故产生的壳聚糖酶活力最低。因此选择胶体壳聚糖为最佳产酶碳源。
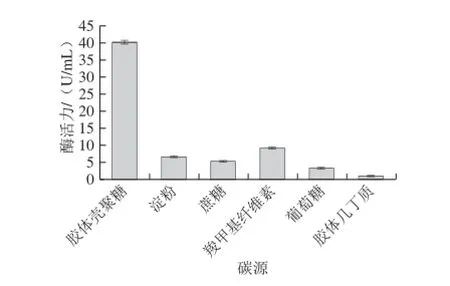
图3 碳源对菌株amyP216产壳聚糖酶的影响Fig.3 Effect of different carbon sources on chitosanase production by amyP216
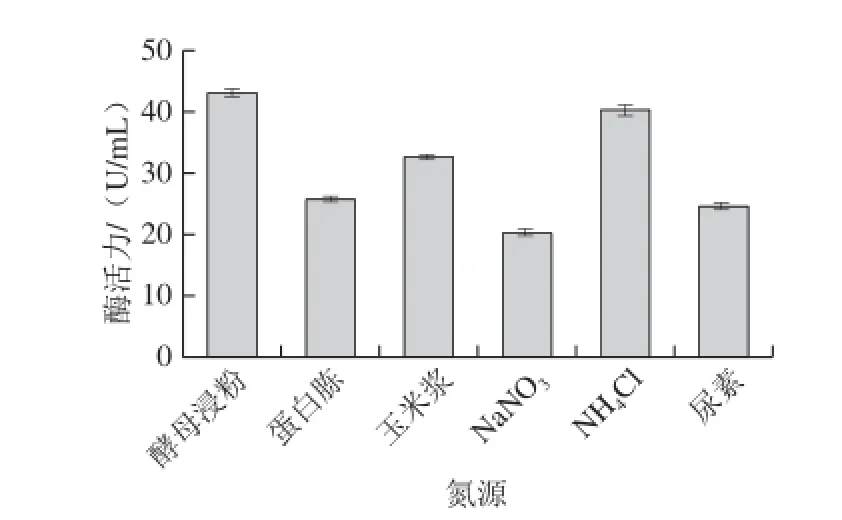
图4 氮源对菌株amyP216产壳聚糖酶的影响Fig.4 Effect of different nitrogen sources on chitosanase production by amyP216
2.3.2氮源对产壳聚糖酶发酵的影响如图4所示,菌株利用不同氮源产壳聚糖酶效果有较大不同,其中以酵母浸粉作为氮源时酶活力最高,达到43.10U/mL,其他依次分别为NH4Cl、玉米浆、蛋白胨、尿素及NaNO3,总体来看,有机氮源的产酶效果略优于无机氮源,但无机氮源中的铵盐对壳聚糖酶合成也是有利的。根据发酵结果最终确定最佳产酶氮源为酵母浸粉。
2.3.3表面活性剂对产壳聚糖酶发酵的影响
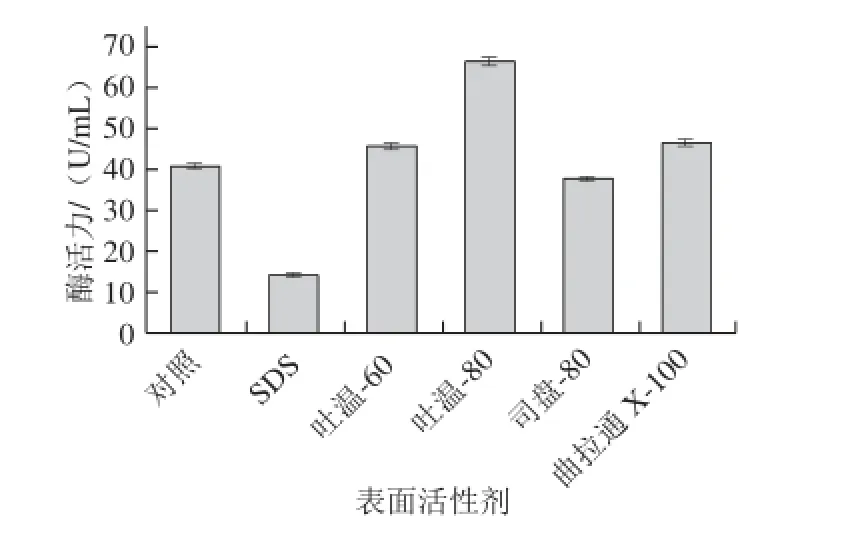
图5 不同表面活性剂对菌株amyP216发酵产壳聚糖酶的影响Fig.5 Effect of different surfactants on chitosanase production by amyP216
在优化培养基碳氮源的基础上,添加不同表面活性剂进行产壳聚糖酶发酵实验,结果(图5)发现添加吐温类表面活性剂及曲拉通 X-100对产酶有促进作用,其中吐温-80的作用最为显著,壳聚糖酶活力最高达到66.40 U/mL,添加司盘-80和SDS则会抑制壳聚糖酶的合成,尤以SDS作用强烈,壳聚糖酶活力远低于对照组。
2.3.4起始pH值对产壳聚糖酶发酵的影响
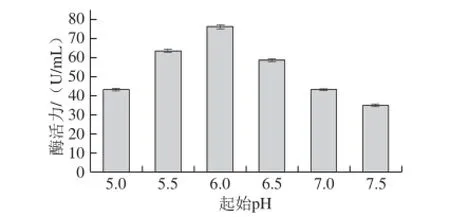
图6 发酵起始pH值对菌株amyP216产壳聚糖酶的影响Fig.6 Effect of initial pH on chitosanase production by amyP216
将发酵培养基调节不同pH值,考察对壳聚糖酶产生的影响。由图6可知,培养基起始pH值在5.5~6.5范围内最有利于壳聚糖酶的合成,尤以pH值为6.0时壳聚糖酶活力最高,达到76.30 U/mL。低于或高于此范围均不利于酶的合成,当pH值为5.0和7.5时,相应的壳聚糖酶活力分别仅为最高酶活力时的56.6%和45.7%。
2.3.5发酵温度对产壳聚糖酶发酵的影响
由图7可知,不同发酵温度对菌株amyP216产壳聚糖酶影响较为显著。发酵温度为30 ℃时,菌株产壳聚糖酶活力最高,为75.10 U/mL,降低或升高温度酶活力均明显下降,当发酵温度低至26 ℃时,壳聚糖酶活力仅为最高酶活力的68%,温度升高到37 ℃时,壳聚糖酶活力尚不足最高酶活力的50%。

图7 发酵温度对菌株amyP216产壳聚糖酶的影响Fig.7 Effect of temperature on chitosanase production by amyP216
2.3.6正交试验结果
结合单因素试验结果,以胶体壳聚糖添加量、酵母浸粉添加量、吐温-80添加量、起始pH值、发酵温度为因素,设计五因素四水平正交试验,结果如表3所示,极差R值大小顺序为:RD>RA>RE>RC>RB,说明起始pH值对产壳聚糖酶活力影响最大,其次是胶体壳聚糖添加量、发酵温度、吐温-80添加量和酵母浸粉添加量。K值分析结果显示,5 个因素的最优组合为A3B4C2D3E3,即胶体壳聚糖添加量20 g/L、酵母浸粉添加量12.5 g/L、吐温-80添加量 1.0 g/L、起始pH 6.0、发酵温度30 ℃。依据此组合进行发酵验证实验,最终酶活力为75.60 U/mL,高于正交试验中所有的组合,说明该组合确实为最佳发酵条件。
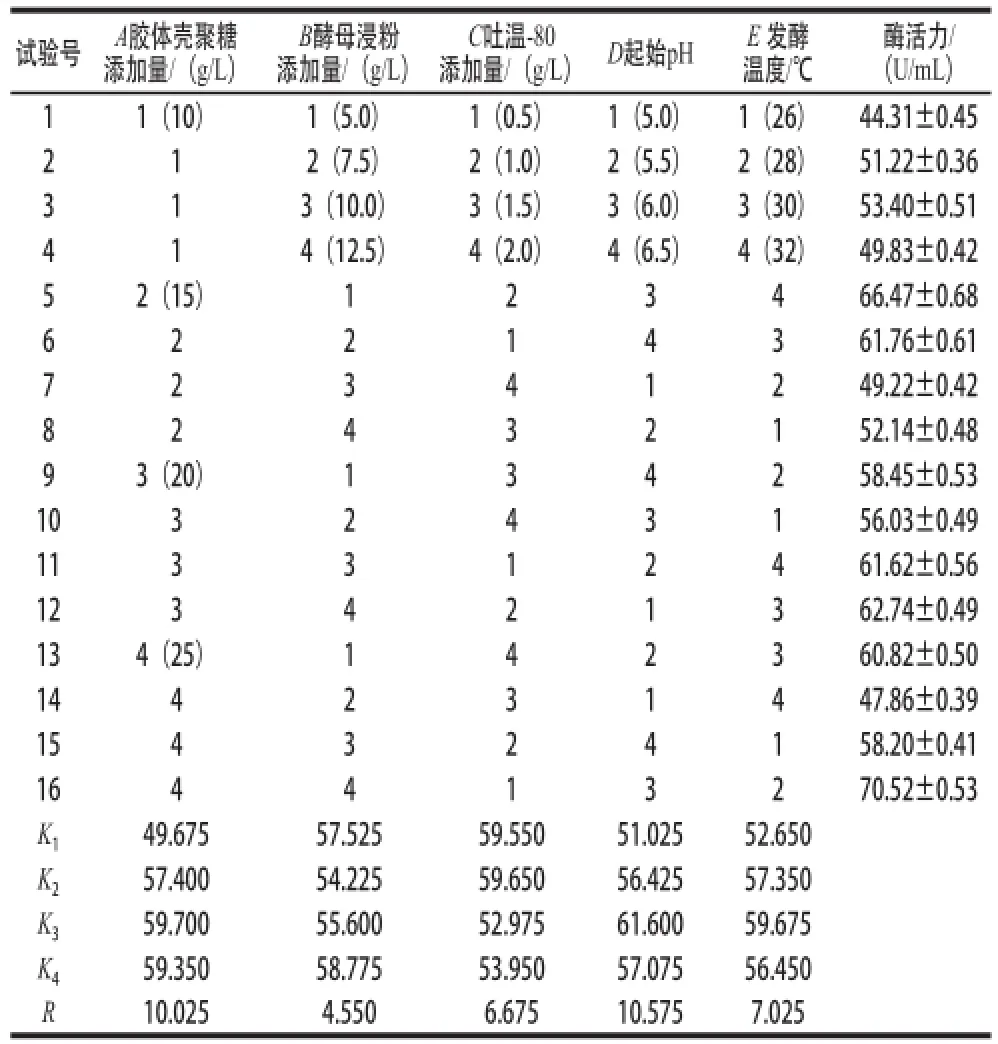
表3 产壳聚糖酶发酵条件的正交试验优化方案及结果Table3 Orthogonal array design with experimental results of chitosanase activity for the optimization of fermentation conditions
2.4产壳聚糖酶发酵过程曲线
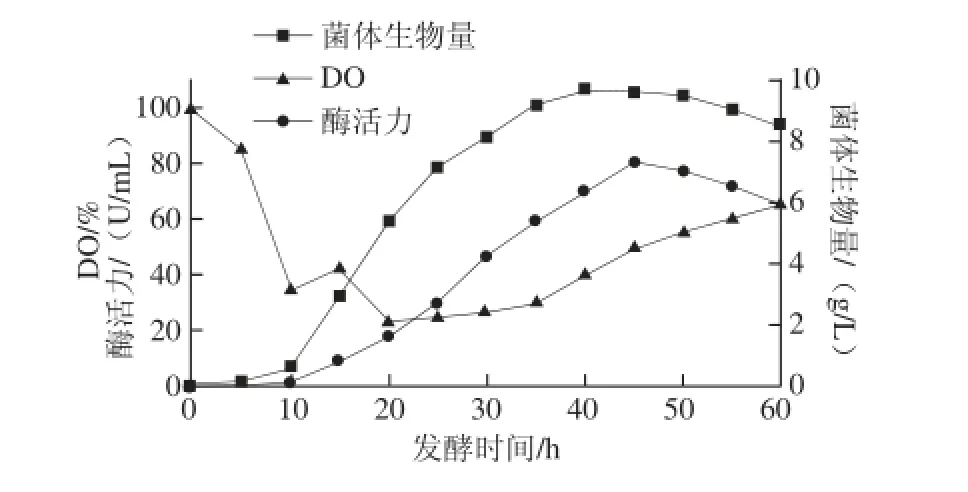
图8 菌株amyP216发酵过程中菌体生物量和壳聚糖酶活力曲线Fig.8 Growth curves of strain amyP216 showing biomass yield and chitosanase activity
采用优化后的培养基和培养条件,用5 L罐进行分批发酵,控制温度为30 ℃,流加NaOH控制pH值在6.0,结果如图8所示。菌体在10 h进入对数生长期,30 h后生长速率减慢,约在35 h进入稳定生长期,菌体呼吸强度减弱,培养系统DO逐步回升,菌体生物量在40 h达到最高值9.68 g/L;壳聚糖酶伴随菌体生长开始合成,在菌体生长进入稳定期后仍可继续合成一段时间,属于延续合成型酶,在45 h壳聚糖酶活力达到最高值80.60 U/mL,比摇瓶发酵酶活力达到峰值时间提前(摇瓶发酵酶活力达到峰值大约在60 h左右),随着培养的进行,菌体老化、酶活力下降,应及时终止发酵。
3 结 论
莫哈韦芽孢杆菌是枯草芽孢杆菌近缘菌种,多具有产生抗真菌活性肽的能力,在农业生物防治方面具有较好的应用前景,已成为近年来研究较为热点的菌属[19-20]。本研究自烟台海岸带沙质土壤中分离到1株高产壳聚糖酶细菌,经生理生化及16S rDNA鉴定为莫哈韦芽孢杆菌,目前国内外尚鲜见关于莫哈韦芽孢杆菌产壳聚糖酶的相关报道。
通过单因素试验确定了菌株amyP216产壳聚糖酶发酵培养基的合适碳、氮源和表面活性剂,同时发现发酵温度和pH值对壳聚糖酶的合成有较大影响;通过正交试验确定了最佳发酵条件。采用最优的发酵条件在5 L发酵罐上进行分批发酵,酶活力最高可达80.60 U/mL,产酶性能较好,且在发酵第1天就检测到壳聚糖酶活性,45 h达到产酶高峰,和以往报道产酶菌株[21-24]相比,产酶效率更高,发酵周期更短。后续研究将在此优化基础上,采用诱变育种及分子生物学等方法对产酶菌株进行改造,并运用发酵调控技术和补料手段,进一步提高壳聚糖酶的活性。
[1] YIN H, DU Y, ZHANG J. Low molecular weight and oligomeric chitosans and their bioactivities[J]. Current Topics in Medicinal Chemistry, 2009, 9(16): 1546-1559. DOI:10.2174/156802609789909795.
[2] 王秀武, 杜昱光, 白雪芳, 等. 壳寡糖对肉仔鸡肠道主要菌群、小肠微绒毛密度、免疫功能及生产性能的影响[J]. 动物营养学报, 2003,15(4): 32-35. DOI:10.3969/j.issn.1006-267X.2003.04.007.
[3] 马镝, 吴元华, 赵秀香, 等. 壳寡糖的制备、分离分析方法及在农业上的应用[J]. 现代农药, 2007, 6(2): 1-5. DOI:10.3969/ j.issn.1671-5284.2007.02.001.
[4] 曾嘉, 郑连英. 通过酶促反应制备壳寡糖[J]. 食品与发酵工业, 2002,27(10): 1-4. DOI:10.13995/j.cnki.11-1802/ts.2001.10.001.
[5] THADATHIL N, VELAPPAN S P. Recent developments in chitosanase research and its biotechnological applications: a review[J]. Food Chemistry, 2014, 150: 392-399. DOI:10.1016/j.foodchem.2013.10.083.
[6] 韩宝芹, 杨菊林, 刘万顺, 等. 壳聚糖酶的分离纯化及性质研究[J]. 中国海洋大学学报(自然科学版), 2006, 36(2): 255-260. DOI:10.3969/j.issn.1672-5174.2006.02.016.
[7] 黄惠莉, 朱利平. 壳聚糖酶的研究进展[J]. 食品工业科技, 2012,33(6): 439-443. DOI:10.13386/j.issn1002-0306.2012.06.106.
[8] WANG S L, CHEN S J, WANG C L. Purifi cation and characterization of chitinases and chitosanases from a new species strain Pseudomonas sp. TKU015 using shrimp shells as a substrate[J]. Carbohydrate Research,2008, 343(7): 1171-1179. DOI:10.1016/j.carres.2008.03.018.
[9] TAE K E, KANG M L. Characteristics of chitosanases from Aspergillus fumigatus KB-1[J]. Archives of Pharmacal Research, 2003,26(12): 1036-1041. DOI:10.1007/BF02994755.
[10] YAMADA T, HIRAMATSU S, SONGSRI P, et al. Altermative expression of a chitosannase gene produces two different proteins in cells infected with Chlorella virus CVK2[J]. Virology, 1997, 230(2): 361-368. DOI:10.1006/viro.1997.8486.
[11] 王艳君, 卓少玲, 陈盛, 等. 产壳聚糖酶菌株的筛选、鉴定及酶学性质分析[J]. 微生物学通报, 2012, 39(12): 1734-1745. DOI:10.13344/ j.microbiol.china.2012.12.003.
[12] SINHA S, TRIPATHI P, CHAND S. A new bifunctional chitosanase enzyme from Streptomyces sp. and its application in production of antioxidant chitooligosaccharides[J]. Applied Biochemistry and Biotechnology, 2012, 167(5): 1029-1039. DOI:10.1007/s12010-012-9546-6.
[13] 阎贺静, 刘畅, 时月, 等. 碳源对烟曲霉WHSW-01产壳聚糖酶的诱导条件优化[J]. 食品与发酵工业, 2015, 41(5): 110-115. DOI:10.13995/ j.cnki.11-1802/ts.201505020.
[14] RIVAS L A, PARRO V, MORENO-PAZ M, et al. The Bacillus subtilis 168 csn gene encodes a chitosanase with similar properties to a Streptomyces enzyme[J]. Microbiology, 2000, 146(Pt11): 2929-2936. DOI:10.1099/00221287-146-11-2929.
[15] SUN Yuying, ZHANG Juquan, WANG Shujun. Heterologous expression and effi cient secretion of chitosanase from Microbacterium sp. in Escherichia coli[J]. Indian Journal of Microbiology, 2015, 55(2): 194-199. DOI:10.1007/s12088-014-0505-5.
[16] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社,2001: 43-65; 364-398.
[17] 曹凤鸣, 杨小红, 马鸣超, 等. 枯草芽孢杆菌近缘种群鉴定方法研究进展[J]. 微生物学通报, 2014, 41(5): 968-974. DOI:10.13344/ j.microbiol.china.130421.
[18] 段妍, 韩宝芹, 董文, 等. 产壳聚糖酶菌株发酵条件优化及壳聚糖酶的分离纯化研究[J]. 海洋科学, 2009, 33(1): 1-7.
[19] 谢永丽, 高学文. 可可西里低温适生拮抗芽孢杆菌的筛选鉴定及脂肽化合物分析[J]. 应用生态学报, 2013, 24(1): 149-155. DOI:10.13287/j.1001-9332.2013.0156.
[20] 时涛, 彭建华, 刘先宝, 等. 橡胶树内生细菌多样性初探及拮抗菌株的筛选[J]. 中国森林病虫, 2011, 30(2): 5-9. DOI:10.3969/ j.issn.1671-0886.2011.02.002.
[21] LIANG T W, HSIEH J L, WANG S L. Production and purification of a protease, a chitosanase, and chitin oligosaccharides by Bacillus cereus TKU022 fermentation[J]. Carbohydrate Research, 2012, 362:38-46. DOI:10.1016/j.carres.2012.08.004.
[22] CHENG C Y, LI Y K. An Aspergillus chitosanase with potential for large-scale preparation of chitosan oligosaccharides[J]. Biotechnology Applied Biochemistry, 2000, 32 (Pt3): 197-203. DOI:10.1042/ BA20000063.
[23] CHEN Y Y, CHENG C Y, HUANG T L, et al. Chitosanase from Paecilomyces lilacinus with binding affinity for specific chitooligosaccharides[J]. Biotechnology Applied Biochemistry, 2005,41(Pt2): 145-150. DOI:10.1042/BA20040041.
[24] NGUYEN A D, HUANG C C, LIANG T W, et al. Production and purification of a fungal chitosanase and chitooligomers from Penicillium janthinellum D4 and discovery of the enzyme activators[J]. Carbohydrate Polymers, 2014, 108(8): 331-337. DOI:10.1016/ j.carbpol.2014.02.053.
Isolation, Identification of Bacillus mojavensis amyP216 and Optimization of Its Fermentation Conditions for Enhanced Chitosanase Production
FENG Zhibin1, XUE Yu1, CHEN Guozhong1, ZHANG Juan2, LUO Le1, CHENG Shiwei1
(1. College of Life Science, Ludong University, Yantai 264025, China;2. College of Agriculture, Ludong University, Yantai 264025, China)
Bacterial strains were isolated from coastal sandy soil collected in Yantai, Shandong province, and were initially screened to obtain 5 chitosanase-producing strains by transparent circle method. Further secondary screening provided a strain producing the highest chitosanase activity named amyP216. The strain amyP216 was identifi ed as Bacillus mojavensis based on morphological, physiological and biochemical characteristics and 16S rDNA sequence analysis. The fermentation conditions of amyP216 for chitosanase production were optimized by one-factor-at-a-time and orthogonal array designs. The results showed that the maximum chitosanase activity of 80.60 U/mL, which was increased by 2.2 folds as compared to that before optimization (36.20 U/mL), was obtained when the fermentation was carried out at 30 ℃ for 45 h in a 5-L auto-controlled fermentor using optimized culture medium containing 20 g/L colloid chitosan, 12.5 g/L yeast extract powder and 1.0 g/L Tween-80 at initial pH 6.0. Therefore, the strain amyP216 has potential application in the industrial production of chitosanase.
Bacillus mojavensis; chitosanase; chitosan oligosaccharide; isolation and identification; optimization of fermentation conditions
10.7506/spkx1002-6630-201619029
TS264.2
A
1002-6630(2016)19-0171-06
冯志彬, 薛钰, 陈国忠, 等. 1 株产壳聚糖酶细菌的分离、鉴定和发酵条件优化[J]. 食品科学, 2016, 37(19): 171-176.
DOI:10.7506/spkx1002-6630-201619029. http://www.spkx.net.cn
FENG Zhibin, XUE Yu, CHEN Guozhong, et al. Isolation, identification of Bacillus mojavensis amyP216 and optimization of its fermentation conditions for enhanced chitosanase production[J]. Food Science, 2016, 37(19): 171-176. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619029. http://www.spkx.net.cn
2015-10-26
山东省农业重大应用技术创新项目(鲁财指2014-38)
冯志彬(1977—),男,讲师,硕士,研究方向为微生物发酵与酶催化。E-mail:fengzhibin257@163.com

