绿色木霉纤维二糖水解酶基因的克隆及其在乳酸菌中的表达与鉴定
王翠艳,王玉华,朴春红,刘俊梅,2,胡耀辉,任大勇,*,于寒松,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.国家大豆产业技术研发中心加工研究室,吉林 长春 130118)
绿色木霉纤维二糖水解酶基因的克隆及其在乳酸菌中的表达与鉴定
王翠艳1,王玉华1,朴春红1,刘俊梅1,2,胡耀辉1,任大勇1,*,于寒松1,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.国家大豆产业技术研发中心加工研究室,吉林 长春 130118)
采用乳酸菌表达系统进行绿色木霉纤维二糖水解酶基因cbhⅡ的表达研究。参照GenBank上发表的绿色木霉(Trichoderma viride)cbhⅡ基因(GenBank登录号:M55080)设计引物并通过聚合酶链式反应克隆获得其cDNA序列长1 441 bp。为了达到表达分泌该酶的目的,在其基因上游序列前添加了大小为80 bp的信号肽序列。进一步通过生物信息学方法将密码子按照乳酸菌的偏好性进行了优化,通过全基因合成获得了优化后的cbhⅡ基因。将该基因与穿梭表达载体pMG36e连接, 构建原核表达载体pMG36e-S-cbhⅡ;利用电转化方法将其转入乳酸乳球菌NZ3900感受态细胞中构建重组乳酸菌,纯化的重组菌蛋白通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳检测,得到一条约为53 kD的目的蛋白条带,与预期大小相符;利用3,5-二硝基水杨酸法测定培养基上清液中水解纤维素酶的活力达到16.7 U/mL,菌体裂解液上清液和菌体沉淀几乎没有酶活力。结果表明,纤维二糖水解酶基因信号肽序列被乳酸乳球菌正确识别,并成功实现了胞外表达。
绿色木霉;纤维素酶;cbhⅡ基因;乳酸乳球菌;酶活力
纤维素酶主要由外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等组成,还有很高活力的木聚糖酶[1]。由于纤维素酶可以应用于食品、纺织等行业,所以其产量的提高备受国内外人士关注,它将是继糖化酶、淀粉酶和蛋白酶后的第四大工业酶种,目前已在食品和环境行业得到了广泛应用[2]。但是,由于纤维素酶很难提纯,所以在实际应用中还会含有一些其他的酶类物质,比如半纤维素酶、蛋白酶等,且来自不同生物的纤维素酶的结构和功能也不同[3]。目前由于真菌产纤维素酶产量多、活性高,所以在实际生产中用的多是真菌纤维素酶,但是真菌难培养、发酵周期长、难以规模化,虽然细菌纤维素酶的产量与真菌相比有一定差距,但易培养、生长快、发酵时间短、稳定[4-5]。因此,寻找适宜的方法克隆来源于真菌的纤维素酶基因到细菌表达系统中,以便构建兼备细菌易培养、生长快和真菌高纤维素酶活力优点的工程菌。
目前,如何选育高产、高酶活力的工程菌成为纤维素酶基因工程的一个重要研究方向。本实验构建了一种高效纤维素降解菌,并克隆了纤维二糖水解酶基因cbhⅡ,进而构建乳酸菌表达载体pMG36e-S-cbhⅡ(S表示信号肽),得到了重组乳酸乳球菌纤维二糖水解酶基因工程菌。乳酸乳球菌是公认的安全益生菌,广泛存在于人体和动物肠道,有利于人体和动物的健康。本实验以乳酸乳球菌作为表达蛋白的受体菌,且由于在目的基因前添加了信号肽序列[6-8],使该蛋白实现了胞外分泌,为后期的实验操作奠定了基础。
1 材料与方法
1.1材料与试剂
1.1.1菌株及质粒
乳酸乳球菌NZ3900、大肠杆菌(Escherichia coli)JM109、表达载体pMG36e均由本实验室保存;纤维二糖水解酶基因cbhⅡ-S(S代表信号肽usp45)由生工生物工程(上海)股份有限公司合成。

图1 pMG36e图谱Fig.1 Map of expression vector pMG36e
1.1.2培养基
LB液体培养基及固体培养基;M17肉汤培养基;GM17培养基:M17培养基、葡萄糖5 g/L;GM17抗性培养基:在M17培养基中加入适量红霉素贮存液,使其最终质量浓度为20 μg/mL;GSGM17培养基:M17培养基、蔗糖0.5 mol/L、甘氨酸25 g/L、葡萄糖5 g/L;GM17MC恢复培养基:M17培养基、葡萄糖5 g/L、 MgCl220 mmol/L、CaCl22 mmol/L;溶液Ⅰ:0.5 mol/L蔗糖+100 mol/L甘油;溶液Ⅱ:0.5 mol/L蔗糖+100 mol/L 甘油+0.05 mol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)。
1.1.3工具酶和生化试剂
限制性内切酶、T4-DNA连接酶、Ex Taq DNA聚合酶、质粒提取试剂盒、DNA凝胶回收试剂盒 宝生物工程(大连)有限公司;蛋白质、DNA分子质量标准、M17肉汤培养基以及培养基成分、三羟甲基氨基甲烷(Tris(hydroxymethyl)aminomethane,Tirs)、SDS、EDTA、溴化乙锭、水饱和酚、氯仿-异戊醇(49∶l,V/V)、丙酮 北京鼎国生物技术有限公司;其他试剂均为国产分析纯。
1.2仪器与设备
ECM399型电转化仪 美国BTX公司;PCR仪美国应用生物系统公司;恒温振荡器 上海智城分析仪器制造有限公司;恒温水浴锅 北京市长风仪器公司;垂直电泳槽、凝胶成像仪 美国Bio-Rad公司;HHF1-SE260电泳仪 北京中西化玻公司;紫外-可见分光光度计、分析天平 日本岛津公司;超声波细胞粉碎机、干式恒温器 杭州瑞诚仪器公司;pH计 梅特勒-托利多有限公司;全自动高压灭菌锅 上海茸研仪器公司;SW-CJIF超净工作台苏净集团安泰公司;infinite M200酶标仪 瑞士Tecan公司;微量移液器 德国Eppendorf公司;MDF-290A超低温冰柜 日本三洋公司;高速冷冻离心机 上海离心机研究所。
1.3方法
1.3.1绿色木霉纤维素酶基因cbhⅡ的获得
参照GenBank上发表的绿色木霉纤维素酶cbhⅡ基因(GenBank登录号:M55080)设计引物并克隆获得该基因的cDNA序列,通过生物信息学方法将密码子按照乳酸菌的偏好性进行优化后[9-10](http://www.jcat.de/),送生工生物工程(上海)股份有限公司,通过全基因合成方法获得了优化密码子后的cbhⅡ基因,合成后经宝生物工程(大连)有限公司测序验证符合预期。
1.3.2纤维素酶基因cbhⅡ信号肽碱基序列的添加及酶切位点的设计
由于绿色木霉纤维二糖水解酶基因cbhⅡ在乳酸乳球菌中的表达是胞内表达,而后续研究需要工程菌表达方式为胞外表达,所以将cbhⅡ基因序列在合成前添加了信号肽usp45的序列[11];信号肽usp45在乳酸菌中的应用已经非常成熟,可以将外源基因进行表达分泌。同时,为了将添加了信号肽序列的目的基因与穿梭表达载体pMG36e连接[12],加入限制性内切酶酶切位点ClaⅠ和SphⅠ。
1.3.3引物设计
根据已经合成并测序正确的绿色木霉纤维二糖水解酶基因cbhⅡ序列,利用引物设计软件Primer Premier 5.0设计了引物Signal-cbhⅡ-Up:5’-ATGAAGAAAAA GATCATCAGTGCTATCTCA-3’和Signal-cbhⅡ-Down:5’-TTATAAAAATGATGGATTCGCATTT-3’,引物送至生工生物工程(上海)股份有限公司合成。
1.3.4重组表达质粒的构建
利用ClaⅠ和SphⅠ分别对测序正确的重组克隆质粒pMD18-T-S-cbhⅡ和表达载体pMG36e进行双酶切,分别回收目的条带并纯化,经T4连接酶在16 ℃连接过夜,转化E. coli JM109,在含有氨苄青霉素的LB固体培养基上进行培养;用质粒小提试剂盒提取质粒DNA,采用聚合酶链式反应(polymerase chain reaction,PCR)技术、双酶切法及基因测序进行鉴定,将重组表达成功的质粒命名为pMG36e-S-cbhⅡ。
1.3.5重组质粒转化乳酸乳球菌及阳性转化子的筛选
挑取乳酸乳球菌NZ3900划线培养的单菌落接种于5 mL GM17液体培养基中,30 ℃静置培养12 h,然后参照Holo等[13]的方法,稍作修改,制备乳酸乳球菌NZ3900感受态细胞;将测序正确的重组乳酸菌表达载体的质粒DNA,取1 μL加入到60 μL的感受态细胞中,混合均匀,然后转入到已经冰预冷的电击杯中,5 ms电击一次,电转化条件为25 μF、2 020 V、200 Ω,然后迅速加入960 μL冰预冷的GM17MC恢复培养基中,在30 ℃条件下静置复苏培养2 h,再取适量的菌液涂布于具有红霉素抗性的GM17固体培养基上,30 ℃培养24~48 h[14-15],待单菌落长出后,提取乳酸乳球菌质粒DNA,对质粒DNA进行PCR和酶切鉴定。
1.3.6重组质粒在乳酸乳球菌中的表达及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)检测
将经过鉴定正确的乳酸乳球菌并按体积分数1%的接种量接种于GM17培养基中,30 ℃静置培养,分别取培养不同时间的重组菌的培养基,离心后获得的上清液和经超声波裂解的菌体,分别采用SDS-PAGE方法及双酶切进行分析。
1.3.7重组乳酸乳球工程菌酶活力及菌体生长曲线的测定
分别挑取已分离纯化的单菌落至GM17液体培养基中,于30 ℃静置培养不同时间,分别收集经离心后的发酵液上清液、菌体超声裂解液上清液和菌体超声裂解液沉淀,测定纤维素酶活力。测定方法:采用微晶纤维素作底物[16-17],3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS)测定纤维素酶活力[18-19]。酶活力单位的定义为:在pH 5、50 ℃条件下,30 min内催化微晶纤维素水解生成1 μg葡萄糖的酶量为一个酶活力单位(U)。采用比浊法在600 nm波长处测定菌液的平均光密度(OD600nm)值,绘制菌体生长曲线。
2 结果与分析
2.1绿色木霉纤维二糖水解酶cbhⅡ基因的获得

图2 合成基因ccbbhhⅡ的PCR扩增结果Fig.2 Agarose gel electrophoresis of synthetic cbhⅡgene

图3 pMD18-T-S-cbh//PCR扩增和双酶切鉴定结果Fig.3 Identification of the recombinant vector pMD18T-S-cbhⅡ by PCR and double enzyme digestion
由生工生物工程(上海)股份有限公司合成经密码子优化并添加信号肽的基因,经PCR扩增及核苷酸序列测定后(图2)可知合成基因大小为1 521 bp,与预期结果相符。进一步送至宝生物工程(大连)有限公司测序,测序结果显示合成基因与设计的基因序列完全相符。将鉴定后序列完全正确的基因片段连接到pMD18-T克隆载体上,得到重组的克隆载体pMD18-T-S-cbhⅡ,转入E. coli DH5α,经过扩增后提取质粒,该质粒采用ClaⅠ和SphⅠ双酶切,PCR鉴定结果如图3所示,获得的基因片段大小与预期大小相符,表明已将纤维二糖水解酶基因cbhⅡ-S与载体pMD18-T连接成功。
2.2重组乳酸乳球菌表达载体pMG36e-S-cbhⅡ的构建及鉴定
将纤维素酶基因S-cbhⅡ与表达载体pMG36e连接,构建重组表达质粒pMG36e-S-cbhⅡ,构建结果如图4所示。重组质粒经过大肠杆菌克隆系统扩增并重新提取质粒后,经过双酶切和PCR扩增分析,可见一条约为1 521 bp的条带(图5),条带大小与预期一致。经过测序验证本实验成功地构建成了重组乳酸菌表达质粒pMG36e-S-cbhⅡ。
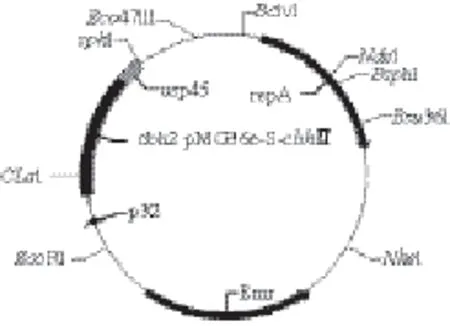
图4 重组乳酸乳球菌表达载体pMG36e-S-cbhⅡ结构Fig.4 Construction of expression vector pMG36e-S-cbhⅡ

图5 重组表达载体pMG36e-S-cbhⅡ的鉴定结果Fig.5 Identification of the expression vector pMG36e-S-cbhⅡ
2.3重组乳酸乳球菌转化子的鉴定
使用电转化方法将构建成功的表达质粒pMG36e-S-cbhⅡ导入到乳酸乳球菌NZ3900中,采用抗生素培养基筛选重组菌,结果见图6。为了进一步验证经过筛选的转化子是否为假阳性,提取筛选到的乳酸乳球菌质粒DNA,并对其进行PCR扩增和双酶切验证,结果如图7所示。以pMG36e-S-cbhⅡ/NZ3900质粒DNA为模板,经过PCR扩增及ClaⅠ、SphⅠ双酶切后均得到一条大小约为1 521 bp的特异性条带,进一步测序结果表明重组质粒pMG36e-S-cbhⅡ已成功转入NZ3900中,并获得了正确的乳酸乳球菌转化子pMG36e-S-cbhⅡ/NZ3900,保存菌种用于下一步工程菌的表达和酶活力分析实验。

图6 重组乳酸乳球菌转化子筛选Fig.6 Screening of recombinant Lactococcus lactis transformants

图7 阳性转化子pMG36ec-Sb-hcbhⅡ/NZ3900的鉴定结果Fig.7 Identification of the positive transformant pMG36e-S-cbhⅡ/NZ3900
2.4cbhⅡ基因在乳酸乳球菌中表达的SDS-PAGE分析
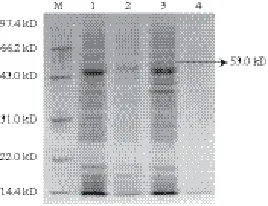
图8 重组子总蛋白的SDS-PAGE分析结果Fig.8 SDS-PAGE analysis of total protein from the positive recombinant transformant
为了验证cbhⅡ基因是否成功在乳酸乳球菌中获得表达,蛋白质是否分泌到胞外,分别提取重组乳酸乳球菌pMG36e-S-cbhⅡ/NZ3900菌体超声裂解沉淀、菌体超声裂解上清液及培养液上清液,分别进行SDS-PAGE电泳,以pMG36e/NZ3900做阴性对照。如图8所示,在泳道1、3的53 kD处有一条新的蛋白条带,而阴性对照pMG36e/ NZ3900则无该条带,与预期的结果一致。同时,在菌体超声裂解上清液及培养基上清液中未检测到目的蛋白(未给出图)。因此,结果表明,绿色木霉纤维二糖水解酶cbhⅡ基因在乳酸乳球菌中成功表达,且胞外表达的信号肽被乳酸乳球菌正确识别。
2.5重组乳酸乳球工程菌的酶学性质分析
采用DNS法,以微晶纤维素为底物,测定纤维二糖水解酶(cbhⅡ)活力,分别取不同培养时间的重组工程菌pMG36e-S-cbhⅡ/NZ3900的超声裂解菌体沉淀进行酶活力测定,结果见图9。重组菌株pMG36e-S-cbhⅡ/ NZ3900在培养0~20 h间,酶活力不断升高,培养到20 h时,酶活力达到最大值16.7 U/mL,20~28 h酶活力慢慢下降,说明在培养期间,纤维二糖水解酶在培养液中积累,在达到最高点后由于营养物质的消耗和部分酶失活,导致体系中的整体酶活力逐渐下降,因此确定培养20 h为重组菌获取重组酶的最佳培养时间。以上结果表明绿色木霉cbhⅡ基因前部的信号肽能够被乳酸乳球菌NZ3900正确的识别,并将重组酶分泌到胞外培养基中;而测定超声裂解的菌体上清液、超声裂解菌体沉淀几乎没有酶活力(未给出结果图);目前报道的工程菌,如绿色木霉纤维二糖水解酶在粟酒裂殖酵母中表达量为82.5 U/mL[20],在酿酒酵母中的表达量为7.71 U/mL[21],而在乳酸杆菌中的表达量为0.156 2 U/mL[22]。本研究克隆绿色木霉来源的纤维素酶基因到乳酸乳球菌表达系统中,构建了具有绿色木霉及乳酸菌NZ3900共同优点的工程菌,酶活力最高达到16.7 U/mL,与之前报道的工程菌相比有明显的优越性。

图9 重组菌的生长曲线及cbhⅡ酶活力Fig.9 Cellubiohydrolase activity and growth curve analysis of the recombinant strain
3 讨 论
绿色木霉是产纤维素酶活力最高的菌株之一,其中纤维二糖水解酶(cbhⅡ)是纤维素酶系中起关键作用的酶。本实验中所用纤维二糖水解酶基因cbhⅡ,是在前人研究的基础上[23],参照GenBank上发表的绿色木霉cbhⅡ的基因,经密码子偏好性优化合成的基因。因此在乳酸菌中得以表达并获得了较高的表达量。
乳酸乳球菌属于乳酸菌的代表菌种,是乳球菌属中最典型的一种兼性厌氧革兰氏阳性球菌。由于它易培养、生长速率快、安全性高等优点使其成为表达外源基因的最佳菌株。但与其他微生物如大肠杆菌、木霉菌等相比,对乳酸菌在分子生物学水平上的研究较晚。但是随着人们对乳酸菌各类表达调控元件的不断研究,陆续开发出了适用于乳酸菌的多种载体,如克隆载体、表达载体(分泌性表达载体、组成型表达载体)、整合载体等,从而使食品级乳酸菌工程菌的构建成为当代研究的热点[24]。
本实验克隆了绿色木霉纤维二糖水解酶基因cbhⅡ,同时与usp45信号肽连接,选用乳酸乳球菌为表达系统,pMG36e为表达载体,构建乳酸乳球菌工程菌,由于在cbhⅡ基因前端加了信号肽,不仅能使乳酸乳球菌能正常表达该基因,而且能使表达产物分泌到细胞外,这就为后期乳酸乳球菌作为发酵剂发酵豆渣纤维素的应用奠定了基础。
4 结 论
本实验为了验证绿色木霉纤维二糖水解酶基因cbhⅡ能否在乳酸乳球菌中成功表达,将鉴定正确的重组乳酸乳球菌制备为对数期的菌液种子,并按体积分数1%的接种量加入GM17液体培养基中培养,然后通过SDS-PAGE检测,得到了与预期一致的蛋白条带,证明了绿色木霉纤维二糖水解酶基因cbhⅡ在乳酸乳球菌中获得成功表达,同时对重组乳酸乳球菌转化子的培养液上清液、菌体裂解液上清液和菌体裂解液沉淀进行酶活力测定,并进行酶学性质分析,结果表明人工连接信号肽到cbhⅡ基因可以被乳酸乳球菌正确识别,并可将表达产物分泌到胞外。以上结果验证了本实验成功地获得了具有纤维二糖水解酶活力的乳酸乳球工程菌,且其分泌表达的重组纤维素酶具有相应的生物活性,从而为利用具有纤维素酶活性的乳酸乳球工程菌降解纤维素提供了理论依据。
[1] 阎伯旭, 齐飞, 张颖舒, 等. 纤维素酶分子结构和功能研究进展[J].生物化学与生物物理进展, 1999, 26(3): 233-237. DOI:10.3321/ j.issn:1000-3282.1999.03.012.
[2] 郝月, 杨翔华, 洪新. 纤维素酶的应用研究[J]. 青海科技, 2005, 12(3): 31-36. DOI:10.3969/j.issn.1005-9393.2005.03.010.
[3] MULAKALA C, REILLY P J. Hypocrea jecorina (Trichoderma reesei) Cel7A as a molecular machine: a docking study[J]. Proteins:Structure, Function, and Bioinformatics, 2005, 60(4): 598-605. DOI:10.1002/PROT.20547.
[4] 李方正. 纤维素降解菌的分离、鉴定及产内切纤维素酶基因工程乳酸菌的构建[D]. 泰安: 山东农业大学, 2011: 2-5.
[5] 孙喆, 鲍男, 王涛, 等. 纤维素酶来源的研究进展[J]. 吉林畜牧兽医,2014, 35(9): 22-25. DOI:10.3969/j.issn.1672- 2078.2014.09.006.
[6] 张艳丽, 聂春明, 周利伟, 等. 牛凝乳酶原基因在食品级乳酸乳球菌中的重组表达[J]. 食品科学, 2014, 35(7): 123-127. DOI:10.7506/ spkx1002-6630-201407025.
[7] LOIR Y L, NOUAILLE S, COMMISSAIRE J, et al. Signal peptide and propeptide optimization for heterologous protein secretion in Lactococcus lactis[J]. Applied and Environmental Microbiology, 2001,67(9): 4119-4127. DOI:10.1128/AEM.67.9.4119-4127.2001.
[8] van ASSELDONK M, RUTTEN G, OTEMAN M, et al. Cloning of usp45, a gene encoding a secreted protein from Lactococcus lactis subsp. lactis MG1363[J]. Gene, 1990, 95(1): 155-160. DOI:10.1016/0378-1119(90)90428-T.
[9] JIA Huiyong, FAN Guangsen, YAN Qiaojuan, et al. Highlevel expression of a hyperthermostable Thermotoga maritima β-xylanase in Pichia pastoris by codon optimization[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 78:72-77. DOI:10.1016/ J.molcatb.2012.02.009.
[10] FUGLSANG A. Lactic acid bacteria as prime candidates for codon optimization[J]. Biochemical and Biophysical Research Communications, 2003, 312(2): 285-291. DOI:10.1016/ j.bbrc.2003.10.120.
[11] 马超, 王丕武, 付永平, 等. 乳酸乳球菌食品级表达载体的改造[J].安徽农业科学, 2010, 38(19): 10247-10250. DOI:10.3969/j.issn.1009-4229-B.2010.04.018.
[12] TSENG W C, FANG T Y, CHANG K C, et al. Expression of Synechocystis sp. PCC6803 cyanophycin synthetase in Lactococcus lactis nisin-controlled gene expression system (NICE) and cyanophycin production[J]. Biochemical Engineering Journal, 2013,78(37): 114-119. DOI:10.1016/j.bej.2013.02.009.
[13] HOLO H, NES I F. High-frequency transformation, by electroporation,of Lactococcus lactis subsp. cremoris grown with glycine in osmotically stabilized media[J]. Applied & Environmental Microbiology, 1989, 55(12): 3119-3123.
[14] 任大勇, 李昌, 秦艳青, 等. 乳酸乳球菌高效电转化方法的建立[J]. 中国兽药杂志, 2012, 46(1): 5-9. DOI:10.3969/ j.issn.1002-1280.2012.01.002.
[15] 张玉兰, 柯晓静, 郭红敏, 等. 利用组成型表达载体pMG36e电转化乳酸乳球菌ML23的研究[J]. 河北农业大学学报, 2010, 33(4): 71-76. DOI:10.3969/j.issn.1000-1573.2010.04.015.
[16] 张煜, 刘刚, 余少文, 等. 里氏木霉纤维二糖水解酶Ⅱ在毕赤酵母中的高效表达[J]. 菌物学报, 2005, 24(3): 367-375. DOI:10.3969/ j.issn.1672-6472.2005.03.011.
[17] DASHTBAN M, MAKI M, LEUNG K T, et al. Cellulase activities in biomass conversion: measurement methods and comparison[J]. Critical Reviews in Biotechnology, 2010, 30(4): 302-309. DOI:10.310 9/07388551.2010.490938.
[18] GHOSE T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry, 1987, 59(2): 257-268. DOI:10.1351/pac198759020257.
[19] 王琳, 国生, 王林嵩, 等. DNS法测定纤维素酶活力最适条件研究[J].河南师范大学学报(自然科学版), 1998, 26(3): 66-69.
[20] 付永平, 宋冰, 王丕武, 等. 绿色木霉纤维二糖水解酶基因cbhⅡ的克隆及其在粟酒裂殖酵母中的表达[J]. 食品科学, 2012, 33(21): 164-168.
[21] 刘泽寰, 全艳彩, 唐根云, 等. 绿色木霉cbhⅡ基因的克隆及在酿酒酵母中的表达[J]. 华南理工大学学报(自然科学版), 2009, 37(6): 91-95. DOI:103321/jissn:1000-565x.2009.06.018.
[22] 赵莹. 酸性纤维素酶基因在大肠杆菌和乳酸杆菌的表达及其活性检测[D]. 长春: 吉林农业大学, 2008: 13-16. DOI:10.7666/ d.y1511940.
[23] 石矛. 纤维素酶工程菌的构建及表达[D]. 长春: 吉林农业大学,2008: 24-28. DOI:10.7666/d.y1511746.
[24] 阮孟斌, 朱明月, 周鹏. 外源基因在乳酸菌中的表达[J]. 应用与环境生物学报, 2004, 10(4): 526-529. DOI:10.3321/j.issn:1006-687x.2004.04.029.
Cloning, Expression and Identification of Trichoderma viride Cellobiohydrolase Gene in Lactic Acid Bacteria
WANG Cuiyan1, WANG Yuhua1, PIAO Chunhong1, LIU Junmei1,2, HU Yaohui1, REN Dayong1,*, YU Hansong1,*
(1. College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China;2. Division of Soybean Processing, Soybean Research & Development Center, Changchun 130118, China)
The expression of the cbhⅡ (cellobiohydrolase) gene from Trichoderma viride was studied by using Lactobacillus expression system. Primers were designed according to T. viride cbhⅡ gene (GenBank accession number: M55080) and the cbhⅡ gene cDNA was obtained by PCR method with a sequence length of approximately 1 441 bp. An 80 bp signal peptide sequence was inserted into the upstream gene for the secretory expression of the target protein. Then, the gene was optimized according to the codon usage of lactic acid bacteria for the synthesis of the whole cbhⅡ gene. The prokaryotic expression vector pMG36e-S-cbhⅡ was constructed through connection between the target gene and the shuttle vector pMG36e. Electrotransformation was used to obtain recombinant lactic acid bacteria in competent cells of Lactococcus lactis NZ3900. The recombinant protein displayed a molecular weight of approximately 53 kD as determined by sodium dodecyl sulfatepolyacrylamide gel electrophoresis, which is consistent with the expected size. The cellulase activity was 16.7 U/mL in culture supernatants by 3,5-dinitrosalicylic acid assay, and there was almost no activity in cell lysate precipitates or supernatants. These results showed that the signal peptide sequence was correctly identified by Lactococcus lactis and extracellular expression was achieved successfully.
Trichoderma viride; cellulase; cbhⅡ gene; Lactococcus lactis; cellubiohydrolase activity
10.7506/spkx1002-6630-201619024
Q7
A
1002-6630(2016)19-0141-06
王翠艳, 王玉华, 朴春红, 等. 绿色木霉纤维二糖水解酶基因的克隆及其在乳酸菌中的表达与鉴定[J]. 食品科学, 2016,37(19): 141-146. DOI:10.7506/spkx1002-6630-201619024. http://www.spkx.net.cn
WANG Cuiyan, WANG Yuhua, PIAO Chunhong, et al. Cloning, expression and identification of Trichoderma viride cellobiohydrolase gene in lactic acid bacteria[J]. Food Science, 2016, 37(19): 141-146. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201619024. http://www.spkx.net.cn
2015-12-27
国家现代农业(大豆)产业技术体系建设专项(CARS-04);吉林省重点科技攻关项目(20150204036NY)
王翠艳(1989—),女,硕士研究生,研究方向为食品科学。E-mail:1249137780@qq.com
任大勇(1979—),男,副教授,博士,研究方向为食品质量安全。E-mail:rdy79@163.com
于寒松(1979—),男,教授,博士,研究方向为豆制品加工与副产物综合利用。E-mail:yuhansong@163.com

