术后辅助治疗对早期单纯低分化宫颈鳞癌患者预后的影响
李昭昭,张春瑜,王新玲,夏 鸣
·论著·
术后辅助治疗对早期单纯低分化宫颈鳞癌患者预后的影响
李昭昭,张春瑜,王新玲,夏 鸣
背景部分学者认为,低分化影响宫颈癌根治术后患者的预后,但该类患者是否应行术后辅助治疗存在争议。目的探讨术后辅助治疗对早期单纯低分化宫颈鳞癌患者预后的影响。方法回顾性分析2002—2011年新疆医科大学附属肿瘤医院收治的103例早期单纯低分化宫颈鳞癌手术患者的临床资料。根据治疗方式,将患者分为辅助治疗组(手术+辅助治疗,40例)和对照组(单纯手术,63例)。记录并比较患者一般资料、手术情况、辅助治疗情况、术后并发症发生情况、放/化疗毒副作用、复发及生存情况。结果两组手术时间、盆腔淋巴结清扫数量、术中出血量比较,差异无统计学意义(P>0.05)。辅助治疗组术后单纯放疗患者17例,其中2例复发,1例死亡;术后单纯化疗患者10例,其中1例复发并死亡;术后放、化疗患者13例,随访期内未发现复发及转移征象。两组术后并发症发生率比较,差异无统计学意义(P>0.05)。辅助治疗组放疗毒副作用发生率前3位分别为放射性肠炎(25.0%,10/40)、骨髓抑制(37.5%,15/40)、放射性膀胱炎(5.0%,2/40),化疗毒副作用发生率前3位分别为骨髓抑制(32.5%,13/40)、胃肠道反应(25.0%,10/40)、肝功能损害(5.0%,2/40);2例患者因无法忍受放射性肠炎拒绝行最后1次腔内治疗,无一例患者因化疗毒副作用而中止治疗;无一例患者因放/化疗毒副作用而死亡。对照组复发率高于辅助治疗组(χ2=5.209,P=0.023)。对照组病死率高于辅助治疗组(χ2=4.111,P=0.043)。对照组无瘤生存率低于辅助治疗组(P<0.05);对照组总生存率低于辅助治疗组(P<0.05)。结论对Ⅰ~Ⅱ期单纯低分化宫颈鳞癌患者术后行辅助治疗是一种可行的方法,且辅助治疗的毒副作用经对症处理后均可逆转,患者可以耐受并获得较好的近、远期疗效。
宫颈肿瘤;放化疗,辅助;低分化;预后
李昭昭,张春瑜,王新玲,等.术后辅助治疗对早期单纯低分化宫颈鳞癌患者预后的影响[J].中国全科医学,2016,19(30):3662-3666.[www.chinagp.net]
LI Z Z,ZHANG C Y,WANG X L,et al.Effect of adjuvant therapy on prognosis of early simply low-differentiation cervical squamous cell carcinoma[J].Chinese General Practice,2016,19(30):3662-3666.
宫颈癌是亚洲女性最常见的妇科恶性肿瘤[1],是女性第四位最常见恶性肿瘤,在全世界范围内,宫颈癌每年发病人数约528 000例,死亡人数约26 000例,其总生存率排第七位[2-3]。对于早期〔国际妇产科联盟(FIGO)2009 ⅠA~ⅡB早期〕宫颈癌,首选治疗手段为根治性手术治疗[4]。针对低分化这一危险因素,术后辅助治疗能否改善患者预后、提高总生存率及无瘤生存率,应行何种辅助治疗,各研究结果存在争议[5-10]。因此,本研究回顾性分析新疆医科大学附属肿瘤医院2002—2011年收治的早期单纯低分化宫颈鳞癌手术患者的临床资料,对是否应行辅助治疗进行临床评价,现报道如下。
1 资料与方法
1.1一般资料回顾性分析2002—2011年新疆医科大学附属肿瘤医院收治的103例早期单纯低分化宫颈鳞癌手术患者的临床资料。纳入标准:(1)经病理活检证实为Ⅰ~Ⅱ期低分化宫颈鳞癌;(2)接受广泛全子宫切除术、盆腔淋巴结清扫术和/或单/双侧附件切除术。排除标准:(1)伴有其他危险因素(切缘阳性、淋巴结转移和宫旁浸润、浸润深度>1/2肌层、脉管瘤栓、肿瘤直径>4 cm)者[11];(2)资料不完整者;(3)因其他恶性肿瘤去世者。入选患者年龄22~68岁,平均年龄(44.0±9.2)岁;Ⅰ期39例,Ⅱ期64例;手术+辅助治疗40例(辅助治疗组),单纯手术63例(对照组)。
1.2治疗方法
1.2.1手术两组患者明确诊断后行开腹或腹腔镜广泛全子宫切除术、盆腔淋巴结清扫术,<45岁者行双侧输卵管切除术,必要时行双侧附件切除术,≥45岁者行双侧附件切除术。
1.2.2辅助治疗辅助治疗组患者接受术后辅助放、化疗,具体方案及剂量如下:(1)放疗方案:盆腔大野放疗(放疗剂量1.8 Gy/次,5次/周,共25次)+腔内放疗(7.0 Gy/次,1次/周,共3次)。采用美国肿瘤放射治疗协作组织(RTOG)放射损伤分级标准(0~Ⅳ度)评估放疗毒副作用[11]。(2)化疗方案:采用单纯铂类方案〔40~50 mg·(m2)-1·次-1,1次/周,1周为1个疗程,共6个疗程〕、紫杉醇联合顺铂(TP)方案〔紫杉醇135~175 mg·(m2)-1·次-1,1次/周,1周为1个疗程;顺铂(或卡铂、奈达铂)75 mg·(m2)-1·次-1,1次/21 d,21 d为1个疗程;共3~4个疗程〕、博来霉素+异环磷酰胺+顺铂(BIP)方案或博来霉素+依托泊苷+顺铂(PEB)方案。采用WHO抗癌毒副作用的分度标准(0~Ⅳ度)评估化疗毒副作用[11]。
1.3随访术后开始随访,术后1、3、6、12个月以门诊随访为主,此后部分患者每年门诊或住院复查,其余患者由本院随访办公室人员采用电话随访,1次/6个月,截止到2014-12-31。随访时间13~135个月,中位随访时间52个月。
1.4观察指标记录患者一般资料(包括年龄、结婚次数、初婚年龄、初产年龄、孕次、产次、民族、职业、文化程度、临床分期、手术方式等)、手术情况、辅助治疗情况、术后并发症发生情况、放/化疗毒副作用、复发及生存情况。
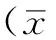
2 结果
2.1一般情况
2.1.1一般资料比较两组患者年龄、结婚次数、初婚年龄、初产年龄、孕次、产次、民族、职业、文化程度、临床分期、手术方式比较,差异均无统计学意义(P>0.05,见表1)。
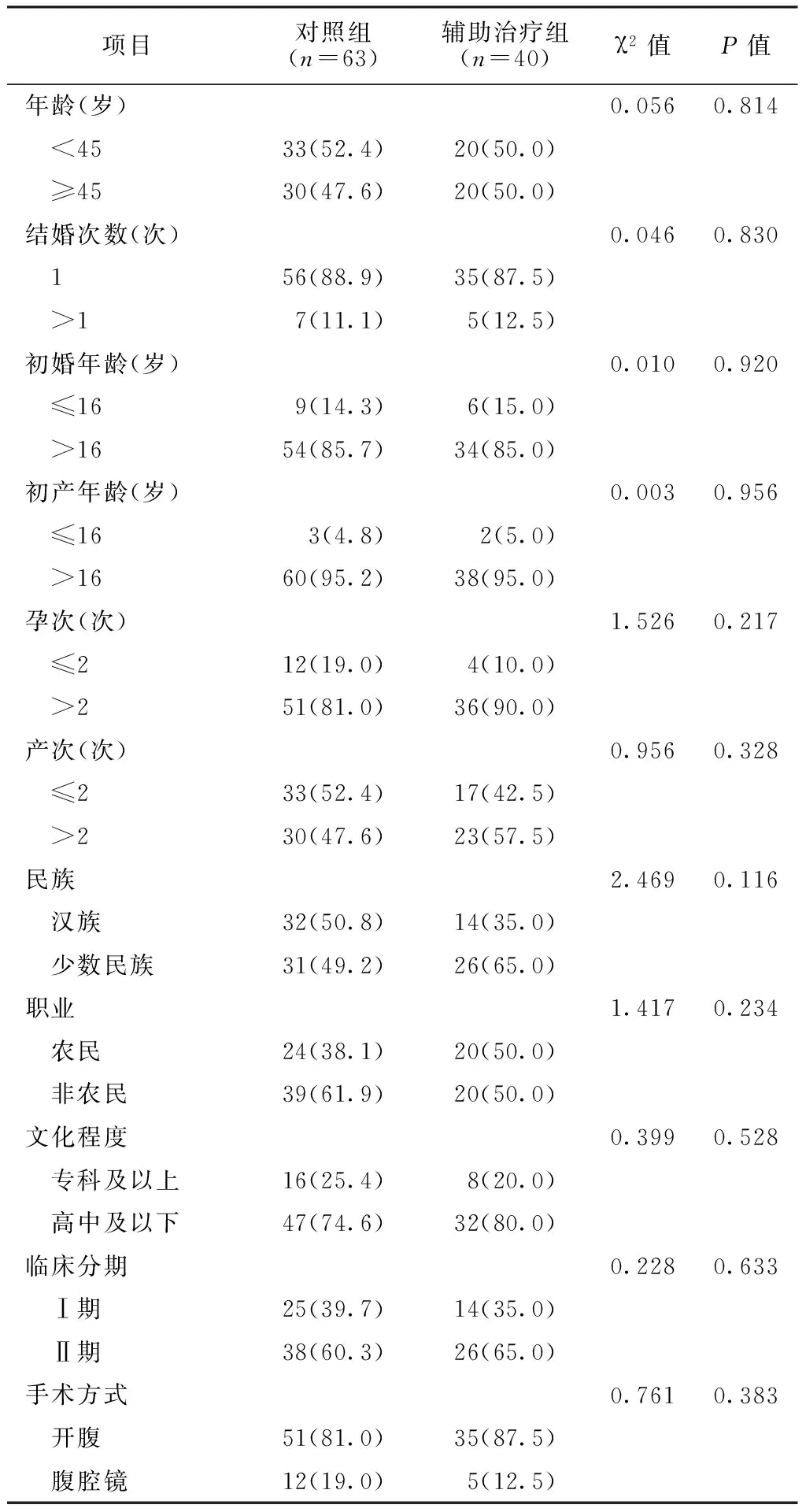
表1 两组患者一般资料比较〔n(%)〕
2.1.2手术情况所有患者手术时间120.0~300.0 min,平均(174.5±40.5)min;盆腔淋巴结清扫数量10~43枚,平均(22±8)枚;术中出血量10~1 400 ml,中位出血量为250 ml。辅助治疗组手术时间、盆腔淋巴结清扫数量、术中出血量分别为(176.3±36.4)min、(23±7)枚、(252.0±188.9)ml,对照组分别为(171.6±44.9)min、(21±7)枚、(258.6±184.1)ml。两组手术时间、盆腔淋巴结清扫数量、术中出血量比较,差异均无统计学意义(t=0.556、1.413、0.176,P=0.580、0.161、0.861)。8例患者术中出血量>800 ml,其中辅助治疗组3例、单纯手术组5例,均行输血治疗,无一例出现输血并发症。未发生肠道损伤及输尿管损伤等术中并发症。
2.1.3辅助治疗情况辅助治疗组术后单纯放疗患者17例,其中2例复发,1例死亡;术后单纯化疗患者10例,其中1例复发并死亡;术后放、化疗患者13例,随访期内未发现复发及转移征象。
2.2术后并发症发生情况两组术后并发症发生率比较,差异均无统计学意义(P>0.05,见表2)。
表2两组患者术后并发症发生率比较〔n(%)〕
Table 2Comparison of incidence rate of postoperative complication between the two groups
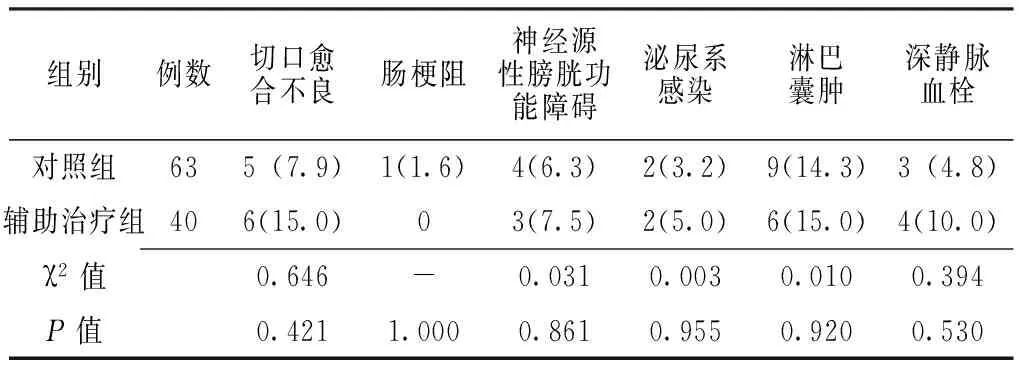
组别例数切口愈合不良肠梗阻神经源性膀胱功能障碍泌尿系感染淋巴囊肿深静脉血栓对照组635(7.9)1(1.6)4(6.3)2(3.2)9(14.3)3(4.8)辅助治疗组406(15.0)03(7.5)2(5.0)6(15.0)4(10.0)χ2值0.646-0.0310.0030.0100.394P值0.4211.0000.8610.9550.9200.530
注:-为Fisher′s确切概率法
2.3放/化疗毒副作用辅助治疗组放疗毒副作用发生率前3位分别为放射性肠炎(25.0%,10/40)、骨髓抑制(37.5%,15/40)、放射性膀胱炎(5.0%,2/40)。其中3例放射性肠炎者腹泻超过15 d,均经马应龙麝香痔疮膏及盐酸洛哌丁胺对症治疗后好转;3例骨髓抑制者为Ⅲ度骨髓抑制,给予粒细胞集落刺激因子升白治疗后好转;放射性膀胱炎者经金水宝等对症处理后好转。辅助治疗组化疗毒副作用发生率前3位分别为骨髓抑制(32.5%,13/40)、胃肠道反应(25.0%,10/40)、肝功能损害(5.0%,2/40)。其中3例骨髓抑制者为Ⅲ~Ⅳ度骨髓抑制,给予粒细胞集落刺激因子升白及白介素-11升血小板治疗后好转;2例胃肠道反应者严重呕吐,经5-羟色胺受体拮抗剂(昂丹司琼)对症治疗后好转;肝功能损害者经保肝治疗后好转。2例患者因无法忍受放射性肠炎拒绝行最后1次腔内治疗,无一例患者因化疗毒副作用而中止治疗;无一例患者因放/化疗毒副作用而死亡。
2.4复发及生存情况对照组有16例复发(25.4%),其中残端复发3例(死亡1例),盆腔复发7例(死亡5例),远处转移6例(均死亡);辅助治疗组有3例复发(7.5%),其中1例行术后化疗(复发后放弃治疗死亡),2例行术后放疗(1例复发后放弃治疗死亡)。对照组复发率高于辅助治疗组,差异有统计学意义(χ2=5.209,P=0.023)。对照组病死率为19.0%(12/63),高于辅助治疗组的5.0%(2/40),差异有统计学意义(χ2=4.111,P=0.043)。对照组无瘤生存率低于辅助治疗组,差异有统计学意义(χ2=5.209,P=0.023,见图1)。对照组总生存率低于辅助治疗组,差异有统计学意义(χ2=4.111,P=0.043,见图2)。
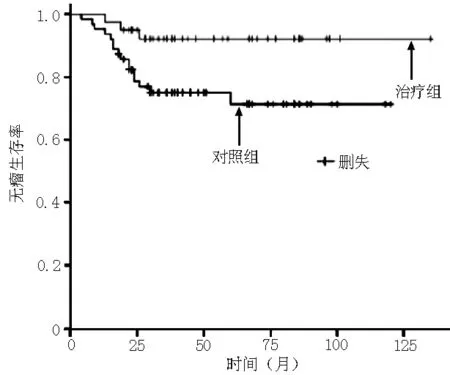
图1 两组患者无瘤生存曲线
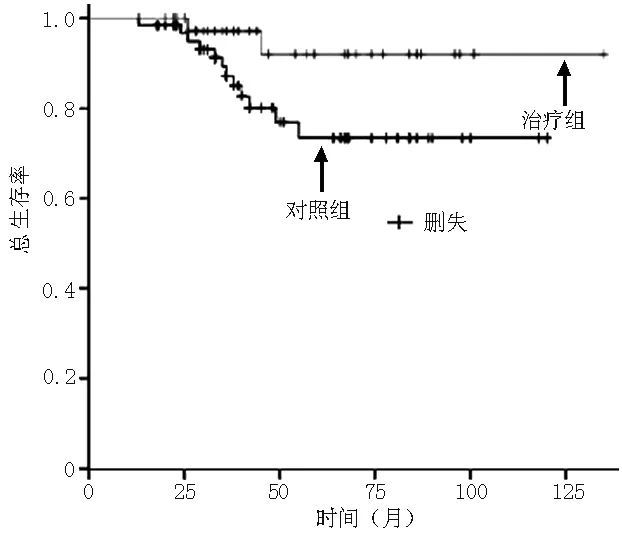
图2 两组患者总生存曲线
3 讨论
3.1早期宫颈癌治疗现状宫颈癌是女性最常见的恶性肿瘤之一,宫颈鳞癌是宫颈癌最常见的病理类型,占75%~80%[2]。目前公认的术后3个中危因素及3个高危因素分别为淋巴结转移、宫旁浸润、切缘阳性和肿瘤直径≥4 cm、脉管瘤栓、深肌层浸润,需要行术后辅助治疗[11]。但近20年,早期宫颈癌根治术后,约20%患者病死率仍未得到显著改善[12]。针对低分化这一危险因素,术后辅助治疗可否改善患者预后、提高总生存率及无瘤生存率,行何种术后辅助治疗尚无统一标准,2015年美国国立综合癌症网络(NCCN)指南亦未明确指出单纯低分化宫颈鳞癌是否应行术后辅助治疗[11]。有些学者认为,即使早期单纯低分化宫颈鳞癌根治术后患者预后较差,但辅助治疗并不能提高其无瘤生存率及总生存率,且多加一种治疗将导致更多的毒副作用及并发症,应慎重选择降低疾病复发风险的辅助治疗[8]。但另有一些学者主张行术后辅助化疗、术后辅助放疗或术后辅助放、化疗,以降低患者远处转移及残端复发的风险[8-10,13-15]。
3.2低分化可作为术后辅助治疗的指征目前国内外部分回顾性资料中,单纯低分化宫颈鳞癌患者复发率较高,组织学分化程度低,恶性程度高,侵袭能力强,较早便可发生深肌层浸润甚至盆腔淋巴结转移,常规宫颈癌根治术复发率及病死率较高,较易引起盆腔局部复发甚至淋巴结及盆腔外器官转移,难以达到根治目的[13-15]。本研究结果显示,对照组复发率、病死率高于辅助治疗组,对照组无瘤生存率、总生存率低于辅助治疗组,与ROGERS等[10]的研究结果一致,其对2篇随机对照研究进行Meta分析发现,治疗组与随访组的5年总生存率无差异〔RR=0.8,95%CI(0.3,2.4)〕,但治疗组5年无瘤生存率明显降低〔RR=0.6,95% CI(0.4,0.9)〕。
3.3术后辅助放、化疗的可行性ROGERS等[10]认为,伴有高危因素的早期宫颈癌术后患者首选治疗方案为辅助放疗,辅助放疗患者比单纯手术患者局部控制率及无瘤生存率高,预后好;但UNO等[13]认为,虽然辅助放疗可改善局部控制率及无瘤生存率,但对患者总生存率并无影响,故提倡在辅助放疗的基础上联合辅助化疗,可在控制局部复发的基础上预防远处转移,同时增强放疗敏感性。
低分化可引起深肌层浸润及淋巴结转移,甚至盆腔复发前即可出现淋巴结及远处转移,考虑可能与低分化生物学行为差,易出现微转移及跳跃性转移有关。本研究结果显示,17例术后单纯放疗患者中2例复发、1例死亡;10例术后单纯化疗患者中1例复发并死亡;术后放、化疗患者13例,随访期内未发现复发及转移征象;对照组16例(25.4%)复发患者中残端复发3例(死亡1例)、盆腔复发7例(死亡5例)、远处转移6例(均死亡);辅助治疗组3例(7.5%)复发患者中1例行术后化疗(复发后放弃治疗死亡)、2例行术后放疗(1例复发后放弃治疗死亡)。提示针对单纯低分化的术后患者,应在辅助放疗控制局部复发率的前提下,同时选择辅助化疗这一全身性治疗,既可有效消除盆腔微小病灶,亦可预防淋巴结转移及盆腔外器官转移。虽然宫颈癌术后患者盆腔血管大多已结扎,辅助化疗局部灌注量低,并非宫颈癌术后首选治疗方式,但针对伴有淋巴结转移、深肌层浸润、组织学低分化及特殊病理类型的宫颈癌患者仍推荐术后辅助化疗,可在提高局部控制率的同时,降低远处转移率,得到较好的远期生存期[14-16]。
3.4辅助治疗的毒副作用及耐受性评估本研究结果显示,两组术后并发症发生率无明显差异;辅助治疗组放疗毒副作用发生率前3位分别为放射性肠炎(其中3例腹泻超过15 d)、骨髓抑制(其中3例为Ⅲ度骨髓抑制)、放射性膀胱炎,化疗毒副作用发生率前3位分别为骨髓抑制(其中3例为Ⅲ~Ⅳ度骨髓抑制)、胃肠道反应(其中2例严重呕吐)、肝功能损害;2例患者因无法忍受放射性肠炎拒绝行最后1次腔内治疗,无一例患者因化疗毒副作用而中止治疗;无一例患者因放化疗毒副作用而死亡。国内张乃怿等[16]的研究发现,69例ⅠB1~ⅡA期宫颈癌术后低分化或非鳞癌患者行辅助化疗,出现骨髓抑制者33例,仅2例患者发生Ⅲ级白细胞减少,21例患者发生Ⅰ~Ⅱ级的胃肠道反应,1例患者发生化疗相关的肠梗阻,本研究结果与之相似。笔者认为,虽然辅助放、化疗有骨髓抑制、胃肠道反应、肝功能损害、放射性直肠炎及膀胱炎等毒副作用,对卵巢有一定损害,但这些损害在一定范围内均可逆,患者均可耐受,治疗结束后经对症处理可好转,对患者远期生存期及生活质量影响不大。
综上所述,对Ⅰ~Ⅱ期单纯低分化宫颈鳞癌患者术后行辅助治疗是一种可行的方法,且患者可以耐受辅助放、化疗的毒副作用,经对症处理后均可逆转,并获得较好的近、远期疗效。但本研究为回顾性研究,且收集样本例数较少,随访时间较短,术后辅助治疗的必要性及方案的选择尚需通过多中心的前瞻性随机对照试验进一步验证。
作者贡献:李昭昭进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;张春瑜、夏鸣进行试验实施、评估、资料收集;王新玲行质量控制及审校。
本文无利益冲突。
[1]PARK J Y,NGAN H Y,PARK W,et al.Asian society of gynecologic oncology international workshop 2014[J].J Gynecol Oncol,2015,26(1):68-74.
[2]SIEGEL R,MA J,ZOU Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(3):9-29.
[3]FERLAY J,SOERJOMATARAM I,DIKSHIT R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.
[4]PARK J Y,KIM D Y,KIM J H,et al.Outcomes after radicaI hysterectomy according to tumor size divided by 2-cm interval in patients with early cervical cancer[J].Ann Oncol,201l,22(1):59-67.
[5]张蕾,忙尼沙·阿不都拉,胡尔西旦·尼牙孜,等.早期宫颈癌患者预后影响因素研究[J].中国全科医学,2011,14(14):1517-1522.
ZHANG L,MANGNISHA A B D L,HUERXIDAN N Y Z,et al.Analysis of prognostic factors for patients with early stage cervical cancer[J].Chinese General Practice,2011,14(14):1517-1522.
[6]段传菊,张虹.早期宫颈鳞癌患者盆腔淋巴结转移的相关因素分析[J].现代妇产科进展,2014,23(11):860-863.
[7]WANG J,WANG T,YANG Y Y,et al.Patient age,tumor appearance and tumor size are risk factors for early recurrence of cervical cancer[J].Mol Clin Oncol,2015,3(2):363-366.
[8]LIU Y,ZHAO L J,LI M Z,et al.The number of positive pelvic lymph nodes and multiple groups of pelvic lymph node metastasis influence prognosis in stage ⅠA-ⅡB cervical squamous cell carcinoma[J].Chin Med J (Engl),2015,128(15):2084-2089.
[9]RAMIREZ P T,PAREJA R,RENDN G J,et al.Management of low-risk early-stage cervical cancer:should conization,simple trachelectomy,or simple hysterectomy replace radical surgery as the new standard of care?[J].Gynecol Oncol,2014,132(1):254-259.
[10]ROGERS L,SIU S S,LUESLEY D,et al.Radiotherapy and chemoradiation after surgery for early cervical cancer[J].Cochrane Database Syst Rev,2012(5):CD007583.
[11]KOH W J,GREER B E,ABU-RUSTUM N R,et al.Cervical cancer[J].J Natl Compr Canc Netw,2013,11(3):320-343.
[12]WRIGHT J D,GRIGSBY P W,BROOKS R,et al.Utility of parametrectomy for early stage cervical cancer treated with radical hysterectomy[J].Cancer,2007,110(6):1281-1286.
[13]UNO T,ISOBE K,YAMAMOTO S,et al.Postoperative radiation therapy for carcinoma of the uterine cervix[J].Radiat Med,2006,24 (2):91-97.
[14]WANG H,ZHU L,LU W,et al.Clinicopathological risk factors for recurrence after neoadjuvant chemotherapy and radical hysterectomy in cervical cancer[J].World J Surg Oncol,2013,11:301.
[15]高琴,张丹丹,白帆,等.紫杉醇联合铂类方案治疗中晚期宫颈癌患者的临床疗效及对血清CYFRA21-1、SCC-Ag的影响[J].疑难病杂志,2015,14(1):53-56.
[16]张乃怿,高雨农,燕鑫,等.具复发危险因素的ⅠB1~Ⅱ A期宫颈癌术后辅助化疗的疗效和安全性评价[J].实用妇产科杂志,2014,30(1):21-25.
ZHANG N Y,GAO Y N,YAN X,et al.Evaluation of the effectiveness and safety of postoperative chemotherapy for stage ⅠB1-ⅡA cervical cancer[J].Journal of Practical Obstetrics and Gynecology,2014,30(1):21-25.
(本文编辑:崔丽红)
Effect of Adjuvant Therapy on Prognosis of Early Simply Low-differentiation Cervical Squamous Cell Carcinoma
LIZhao-zhao,ZHANGChun-yu,WANGXin-ling,XIAMing.
Departmentof4thGynecologicSurgery,XinjiangMedicalUniversityAffiliatedTumorHospital,Urumqi830011,China
Correspondingauthor:WANGXin-ling,Departmentof4thGynecologicSurgery,XinjiangMedicalUniversityAffiliatedTumorHospital,Urumqi830011,China;E-mail:wangxinling0516@126.com
BackgroundSome studies suggested that low-differentiation effected the prognosis of patients after radical hysterectomy ofcervical cancer,but there was no evidence whether such patients demonded the adjuvant therapy.ObjectiveTo evaluate the effect of adjuvant therapy on prognosis of early simply low-differentiation cervical squamous cell carcinoma.MethodsA total of 103 patients of early simply low-differentiation cervical squamous cell carcinoma in Xinjiang Medical University Affiliated Tumor Hospital from 2002 to 2011 were enrolled for the retrospective analysis.The patients were divided into adjuvant therapy troup (surgery+adjuvant therapy,n=40) and control group (surgery alone,n=63).We recorded and compared the two groups′ general data,surgery,adjuvant therapy,postoperative complications,side-effects of radiotherapy/chemotherapy,recurrence and survival time.ResultsThere was no significant difference between the two groups in operative time,dissected lymph nodes and bleeding during operation (P>0.05).In adjuvant therapy group,2 of 17 cases accepted radiotherapy alone relapsed and 1 died;1 of 10 cases accepted chemotherapy alone relapsed and died;There were no recurrence and metastases in 13 cases accepted chemoradiotherapy and radiotherapy.There was no significant difference between the two groups in postoperative complications (P>0.05).In adjuvant therapy group,the top three side effects of radiotherapy were:radiation enteritis (25.0%,10/40),myelosupression (37.5%,15/40) and radiocystitis (5.0%,2/40);the top three side effects of chemotherapy were:myelosupression (32.5%,13/40),gastrointestinal reaction (25.0%,10/40),abnormal hepatic function (5.0%,2/40).2 patients refused the last intracavitary radiotherapy because of the heavy radiation enteritis.There were no patients discontinued adjuvant chemotherapy because of side effects,no patients died of side effects of radiotherapy/chemotherapy.The reccurence rate in control group was significantly higher than that in adjuvant therapy group (χ2=5.209,P=0.023).The mortality in control group was significantly higher than that in adjuvant therapy group (χ2=4.111,P=0.043).The tumor-free survival rate in control group was significantly lower than that in adjuvant control group (P<0.05).The overall survival rate in control group was significantly lower than that in adjuvant therapy group (P<0.05).ConclusionAdjuvant therapy after operation was feasible for the patients with simply low-differentiation cervical squamous cell carcinoma of stage Ⅰ to Ⅱ.The side effects of adjuvant therapy can be reversed by symptomatic treatment,and the patients can tolerate and get better short and long term curative efficacy.
Uterine cervical neoplasms;Chemoradiotherapy,adjuvant;Low differentiation;Prognosis
新疆维吾尔自治区自然科学基金资助项目(2013211A071)
830011 新疆乌鲁木齐市,新疆医科大学附属肿瘤医院妇外四科(李昭昭,张春瑜,王新玲);重庆医科大学第一临床学院(夏鸣)
王新玲,830011 新疆乌鲁木齐市,新疆医科大学附属肿瘤医院妇外四科;E-mail:wangxinling0516@126.com
R 737.33
A
10.3969/j.issn.1007-9572.2016.30.004
2016-03-23;
2016-08-05)

