腺苷脱氨酶活性分析方法研究进展
徐 然,齐艳菲,李优鑫
(天津大学 药物科学与技术学院,天津市现代药物传递及功能高效化重点实验室,天津化学化工协同创新中心,天津 300072)
腺苷脱氨酶活性分析方法研究进展
徐然,齐艳菲,李优鑫*
(天津大学药物科学与技术学院,天津市现代药物传递及功能高效化重点实验室,天津化学化工协同创新中心,天津300072)
腺苷脱氨酶(ADA)是一种核酸代谢酶,与机体细胞免疫活性有重要关系,在很多疾病中,ADA活性均表现异常。因此,越来越多的科研工作者聚焦于ADA活性与疾病关系的研究,并一致认为ADA活性分析对临床疾病的诊断与治疗具有非常重要的意义。该文综述了比色法、色谱法、适配体传感器等ADA活性分析方法的研究进展,以期为ADA的活性分析提供参考。
腺苷脱氨酶;活性分析;临床检测;色谱;适配体传感器
腺苷脱氨酶(Adenosine deaminase,ADA)是一种核酸代谢酶,与机体细胞免疫活性有重要关系[1]。ADA活性异常与多种疾病相关,如重症联合免疫缺陷疾病(SCID)、结核性胸膜炎、癌症(如乳腺癌、淋巴瘤和结肠癌、T细胞淋巴瘤等)等[1-4]。另外,ADA抑制剂也不断被研究,开发成抗癌与抗炎的药物[1,5]。因此,ADA活性分析对于疾病的临床诊断、治疗、病理学及药理学研究有非常重要的意义。
近年来,ADA活性分析新方法不断被开发,以提高ADA活性分析的准确度、灵敏度及专属性,满足临床检测及药理学、病理学研究的需求,但未见相关综述报道。本文综述了紫外分光光度法、比色法、化学发光法、氨气敏电极法、高效液相色谱、毛细管电泳以及适配体传感器等ADA活性分析方法的研究进展,以期为ADA的进一步研究及临床检测提供参考。
1 ADA活性测定原理及特点
生物组织中的ADA含量微乎其微,直接测定ADA含量非常困难。因此,临床上普遍通过测定ADA所催化的酶促反应速率(v)测定酶活性。ADA可通过不可逆的脱氨作用分别催化腺苷和脱氧腺苷形成肌苷和脱氧肌苷。由于ADA对腺苷的亲和性高,因此,腺苷常为ADA酶促反应的底物,可根据腺苷的消耗速率、产物肌苷或氨的生成率评估ADA的活性[1]。
但生物样品成分复杂,在分析其ADA活性时,腺苷与肌苷还可能参与其他代谢途径,如嘌呤核苷酸磷酸化酶(PNP)也广泛地存在于人体组织中,它可快速将肌苷转化成次黄嘌呤,若单独通过肌苷的生成率评估ADA活性,会产生较大的偏差[6-7]。Carlucci等[6]以肌苷与次黄嘌呤的生成量来评估正常人与SCID患者红细胞中的ADA活性。而Paul等[7]仅通过肌苷的生成分析T淋巴瘤细胞中ADA的活性,由于PNP也存在于T细胞中,肌苷是否被分解需要验证。因此,对于临床样品中ADA的活性分析,待测底物与产物是否进一步参与其他代谢需首先被考虑。
2 ADA活性分析方法
2.1紫外分光光度法
腺苷分子中的嘌呤环在265 nm处有特征吸收峰,而肌苷的特征吸收峰在250 nm处,通过直接测定ADA催化体系中265 nm处吸光度的降低,即腺苷浓度的减少速率,或测定250 nm处吸光度的升高,即肌苷浓度的生成速率,从而实现酶活性的测定[8-9]。最近,董佩杰等[10]基于该方法分析ADA活性,搭建了简单快速的抑制剂筛选平台。该法简便(只有一步反应),但检测信号易受干扰,主要有以下原因:①肌苷与腺苷的紫外吸收光谱有部分重叠;②对于复杂生物样品,体系中的其他蛋白、核苷酸等成分会对检测造成干扰;③一些生物样品中,PNP与ADA同时存在,会瞬间分解酶促反应产生的肌苷形成次黄嘌呤,而直接通过检测250 nm处吸光度的增强来分析ADA活性,会造成测定结果的偏差非常大。
2.2比色法
2.2.1波氏比色法底物腺苷在ADA催化下水解产生NH3后,在碱性条件下可与次氯酸钠、苯酚反应生成靛酚兰,其在628 nm处有特定吸收,通过比色法检测靛酚兰含量可评估ADA活性[11-12]。该方法应用广泛,如Pinnelli等[13]采用该方法分析了2型糖尿病患者血清中ADA活性与血糖状态之间的关系。Gandhi[14]和Bhushan[15]等分别采用该方法分析了ADA活性变化对结核性胸膜炎的诊断价值。
该方法所需试剂和仪器简单,无需预先去除蛋白质,从而得到了很广泛的应用。但易受外源性NH3的影响,与显色剂反应耗时,手工操作时间长,干扰因素多,不适宜全自动分析,并且由于吸收的干扰,不能用于红细胞中ADA活性的直接测定。
2.2.2酶联比色法腺苷经ADA反应后生成的NH3可在α-酮戊二酸和还原型辅酶Ⅰ(NADH)存在下,经谷氨酸脱氢酶(GLDH)催化发生氨化还原反应,生成谷氨酸和氧化型辅酶Ⅰ(NAD十),通过在340 nm处监测NADH的消耗率来评估ADA活性,也可通过测定反应体系中NADH的荧光变化速率来评估ADA活性[16-18]。该法可实现自动化分析,但易受外源性NH3的影响。
另外,另一产物肌苷的酶联比色法也被广泛用于ADA活性分析。如Oosthuizen和万雄萍等[19-20]报道了一种测定ADA活性的酶联比色法,其原理为:底物腺苷被ADA和PNP催化成次黄嘌呤后,经黄嘌呤氧化酶(XOD)催化,可将蓝色的2,6-二氯酚吲哚酚(DCIP,λmax=606 nm)还原成无色,通过测定606 nm处吸光度的变化可评估ADA活性。胡卫红和周美霞[21-22]等报道了另一种测定ADA活性的酶联比色法,其原理为:底物腺苷经ADA,PNP,XOD作用后,生成尿酸和H2O2,H2O2再经过氧化物酶(POD)催化的Trnider反应生成有色醌类化合物,通过测定其最大吸收波长处吸光度的上升速率(ΔA/min),即有色醌类化合物的生成速率来测定ADA活性。酶联法可实现自动分析,但需多步酶偶联反应,操作复杂,检测成本较高。
多种比色法已被制成试剂盒,并广泛应用于生物样品中ADA活性的分析。该方法与紫外分光光度法相比,能够避免几种核苷酸物质紫外吸收光谱部分重叠的干扰,同时也考虑了生物样品中酶促反应产物进一步被分解后对检测的影响。但该方法的检测灵敏度较低,所需酶反应较多,需要昂贵的酶联试剂,耗时较长,且存在滞后检测的现象[23]。
2.3化学发光法
基于化学发光法分析ADA活性的原理为:底物腺苷经ADA和PNP催化后可生成次黄嘌呤,再经XOD氧化生成尿酸和H2O2,H2O2与鲁米诺(Luminol SERVA)发生化学发光反应,其发光强度与次黄嘌呤含量成正比,由此可测定ADA活性。徐顺清等[24]基于上述原理报道了检测ADA活性的化学发光法,该法对癌性胸水及结核性胸膜炎的诊断鉴别有较好的实用价值。
此法需要发光测量仪,虽然灵敏度高,但重现性和准确度差,并且需多步酶联反应,耗时,成本较高,因此尚无进一步的应用进展。
2.4同位素法
同位素法的主要原理是以3H或14C标记的底物进行ADA酶促反应,通过测定标记的底物含量的变化来计算ADA活性。Niedzwicki等[25]用同位素法测定了人血浆中ADA的活性,以[8-14C]2′-脱氧腺苷为底物,酶促反应混合物经薄层色谱分离后进行放射性测定,通过测定产物的生成率计算ADA的活性。
同位素法虽灵敏度高、特异性强,但需要放射性的同位素标记,操作复杂,费用较高,不适合常规应用,且污染环境[26]。
2.5氨气敏电极法
腺苷经ADA反应后生成的NH3进入电极的气透膜内,渗入中介液薄层,改变中介液的pH值,从而使得指示电极发生改变。Hjemdahl-Monsen等[27]以氨气敏电极为指示电极,饱和甘汞电极为参比电极,通过测定NH3浓度从而间接测得ADA活性。李毓琦等[28]用该法测定人血中ADA的活性。之后,该课题组进一步采用该法测定孕妇羊水[29],以及大鼠胸腺、脾组织[30]中的ADA活性。
该法简单方便,检测时间短,无需特殊仪器和昂贵试剂,且不易受颜色及沉淀物质干扰,可用于临床诊断。但该法较难控制电极的响应信号和响应时间,且易受外源性NH3的干扰,未能推广使用。
2.6高效液相色谱法
近30年来,高效液相色谱技术(HPLC)发展迅速,并被应用于核苷酸与核苷的分离以及核苷酸代谢酶的测定。1977年,Uberti等[31]首次以强阳离子交换色谱柱分析人淋巴细胞与血红细胞中的ADA活性,由于人淋巴细胞中PNP的存在,因此肌苷会进一步转化为次黄嘌呤,基于分离的产物与底物,定量分析产物的生成速率进而评估ADA活性。随后,1978年,Hartwick等[32]用反相HPLC分析了人血红细胞中ADA的活性。Obata等[33]通过微透析技术将透析探针注入到小鼠的肠粘膜内,并灌注含腺苷的生理盐水,使ADA酶促反应在小鼠体内发生,后经HPLC分析透析液中腺苷与肌苷的含量并推算肌苷的生成量。该法首次提出体内酶促反应分析ADA的方法,但因只能定性分析ADA在体内的酶促反应,缺少活性定量标准而未能深入发展。Paul等[7]比较了HPLC法与光谱学法,指出了紫外分光光度法检测的不足,即酶的底物腺苷、产物肌苷的吸收光谱有重叠,另外ADA抑制剂在腺苷与肌苷的吸收光谱范围内也有吸收,单纯的光谱学检测缺少分离过程,检测结果受到很大干扰,而具有分离功能的HPLC法能更准确地分析ADA活性。Ni等[34]采用反相HPLC法研究了ADA的活性抑制剂。Schepp等[35]采用HPLC法测定ADA的活性,并探讨了ADA的缺失与抗体缺失和免疫调节异常的关系。此后,HPLC法被广泛应用于不同样品中核苷酸代谢的分析[26]。
HPLC法分析ADA活性,能够将ADA酶促反应的底物与产物完全分离并准确定量,可消除底物与产物检测的干扰。该法有较高的准确性与灵敏度。然而,该法也有很多不足,其样品前处理过程(如蛋白的完全沉淀,过滤与pH值的调节)复杂,而过酸过碱或是含有一定量蛋白的样品均会损坏色谱柱,且冲洗和平衡过程较耗时。
2.7毛细管电泳法
毛细管电泳(CE)具有分离效率高、样品消耗量小的特点,并且有多种运行模式,在酶分析领域有广泛的应用。本课题组的Bao等[36]在1992年首次提出了电泳介导微分析法(Electrophoretically mediated microanalysis,EMMA),随后毛细管电泳微型固定化酶反应器(Immobilizedenzyme reactors,IMERs)技术被提出。EMMA与IMERs方法的提出实现了毛细管柱上的酶分析。本课题组在此基础上不断地将毛细管电泳技术应用于酶分析领域[37],并完成了毛细管电泳中ADA与PNP连续分析的工作。
1995年,Sun等[38]通过自制的高效毛细管电泳在线监控了ADA酶促反应,首次将CE技术应用于ADA分析。该方法在一根毛细管上设4个检测窗口,其有效长度分别为35,66.5,97.5,129 cm。在电泳缓冲液中添加ADA后,腺苷在毛细管内运行的过程中会逐渐转化成肌苷,随着检测窗口长度的增加,肌苷的产生量逐渐增加。1996年,Saevels等[39]首先通过EMMA技术,以腺苷为底物测定了ADA的Km值。ADA与腺苷依次进入毛细管的进样端,由于ADA的电泳迁移率小于腺苷的电泳迁移率,当腺苷区带穿过ADA区带时,会生成产物肌苷。腺苷与肌苷被分离并依次经过检测窗口被检测,依据肌苷的生成来评估酶促反应速率。此后,EMMA技术分析ADA未得到进一步应用,直至2011年,Pei等[40]研究了CE分析ADA转化的4种模式即毛细管区带电泳(CZE)、胶束电动毛细管电泳(MEKC)、EMMA和IMERs。EMMA方法中,所有混合、酶促反应、分离与检测均可在毛细管内自动进行,整个分析过程简便、快速,无需复杂的样品前处理过程,是一种快速简便的酶分析方法。但是,已报道的EMMA技术分析ADA的研究中,ADA样品均是从牛脾脏纯化的酶,目前尚无直接分析生物样品中ADA活性的报道。可能是由于:①组织细胞或体液中成分较复杂,大量的生物基质与目标物质的分离较困难;②EMMA过程的整个反应时间较短,仅有几十秒的混合时间,在较短的时间内生物样品中ADA产物的产生量有限,不足以达到仪器的定量下限;③ADA分解腺苷的产物肌苷还会进一步被分解,使产物更难以被检测。因此,EMMA技术应用到临床样品中ADA的活性分析虽有很大发展前景,但也面临巨大挑战。本课题组正尝试改进EMMA方法,以期实现集细胞进样、孵育、分离、检测于一体的细胞中ADA的自动化分析。IMERs是将ADA固定到毛细管上,酶促反应以及基质与产物的分离在一根毛细管中进行,该技术也被用于基于ADA活性分析的抑制剂筛选[41-42],但这种固定的毛细管微反应器的稳定性受很多因素影响,如当电泳缓冲液的pH值大于8.0时,固定酶的化学键会遭到破坏。CZE与MEKC法在分析ADA过程中,ADA酶促反应在线下完成,操作中间步骤多、费时,但这两种方法的重现性相对较好。Carlucci等[6]则报道了线下酶反应、线上分析的MEKC方法检测人血红细胞中ADA的活性,并应用于SCID的检测。本课题组[43]也成功地实现了CZE模式同时测定生物样品中ADA与PNP的活性。
CE相对于其他方法如HPLC,检测灵敏度相对较低,而一些组织中ADA含量较少,尤其是一些疾病患者体内的ADA活性显著降低,酶促反应后产生产物的量更少。因此研究者们不断致力于开发新的CE方法以提高ADA分析的灵敏度。Adam等[44]建立了短暂毛细管等速电泳-毛细管区带电泳方法分析红细胞中ADA,通过预浓缩低浓度的大量样品而提高检测灵敏度,产物次黄嘌呤与肌苷的灵敏度可提高2个数量级。Iqbal等[45]通过高灵敏的反电极转化模式分析ADA酶促反应,先将大量的样品水溶液引入毛细管中,反转电极促使电渗反向,样品基质被推回到毛细管的进样端,达到合适的堆积效应后,电极转换到正模式,分析物被分离并被检测。该方法的富集因子高达10倍,能够有效地提高检测灵敏度。然而该方法只适于分析带同种电荷的分析物,且样品基质为中性物质,其应用受到限制。
毛细管电泳技术具有简便、快速,以及无需复杂样品前处理的特点,经过数十年的发展,可用于ADA的分析,但其方法学的改进及在实际临床样品分析中的应用仍在不断深入。
2.8腺苷适配体传感器法
适体(Aptamer)是一种功能化的可选择性结合小分子、蛋白质甚至是细胞的DNA或RNA,这些物质作为生物传感器材料已得到广泛应用。腺苷适配体传感器分析ADA活性的基本原理为:腺苷的适体对腺苷具有很高的亲和力,但对肌苷等其他物质的亲和力很低。有腺苷存在的情况下,适体与腺苷紧密结合,当加入ADA后腺苷被分解,紧密结构发生变化。腺苷适体的DNA片段会与其他分子结合,引起检测信号的改变,根据信号的变化评估腺苷的减少量,从而分析ADA活性。按照检测信号的不同将检测ADA的适配体传感器分为电化学、荧光和比色适配体传感器。
2.8.1电化学适配体传感器电化学适配体传感器法中,ADA加入前后腺苷适配体状态的改变可引起电化学信号的改变,从而测定ADA活性。如Zhang等[46]设计了一种电化学适配传感器分析ADA,将氯高铁血红素(Hemin)作为电化学标记物,并设计了Hemin的两段互补的适体DNA片段DNA1与DNA2,DNA2片段吸附在电极表面,DNA1可与腺苷紧密结合。有腺苷存在时,该体系会形成一个紧密结构,使Hemin的分裂适体分开。当体系中加入ADA后,腺苷转化为肌苷,而肌苷与DNA1的脱离使DNA1不被束缚,因此Hemin的两段分裂适体可以相互靠近易于与Hemin结合,从而得到其电化学响应。由于腺苷和电化学标记物Hemin存在着竞争关系,因此峰电流大小可以间接地反映出ADA的活性,其信号强度与ADA活性成正比,该方法可检测到0.2 U/mL的ADA。
2.8.2荧光适配体传感器荧光适配体传感器有较高的检测灵敏度,近年来,研究者们设计了多种高灵敏的荧光适配体传感器系统,用以分析ADA活性。Zhang等[47]提出电化学适配体传感器后,又设计了一种时间分辨荧光适配体传感器测定ADA。首先将DNA1通过生物素-抗生物素蛋白固定在链霉亲和素涂层的金属板上,腺苷存在时,腺苷适配体DNA1形成一个紧密堆积结构,加入ADA后,腺苷被催化成为肌苷,使DNA1转变为自由态。此时加入地高辛(DIG)修饰的DNA2,与DNA1杂交后,接在金属板表面,DIG与Eu-anti-DIG结合后,通过电子转移使铕离子Eu (Ⅲ)发射出荧光,继而通过荧光信号检测ADA的活性,该方法的检出限为2 U/L。随后,Zhang等[48]又改进了该方法,用辣根过氧化物酶修饰DNA2,将检测灵敏度提高到0.5 U/L。由于Eu (Ⅲ)的荧光寿命比背景信号更长,因而该方法可以消除背景荧光信号以及传感器自身信号的干扰。
随后,荧光分子信标技术被设计用来分析ADA,设计的传感器包括腺苷的适配体DNA1、与适配体DNA1互补的另外一条DNA2和能够发射荧光的片段3部分。当有腺苷存在时,适配体区域形成一个紧密的结构,不能产生荧光信号,加入ADA后,两段互补的DNA片段杂交,内嵌的嘧啶环产生荧光信号。张凯等[49]以DNA为模板,用以银纳米簇为信号指示器的荧光分子信标技术分析了ADA,其检测灵敏度可达0.05 U/L,分析过程的原理图如图1所示。
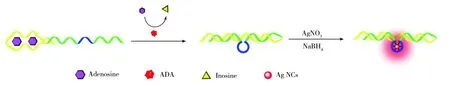
图1 以银纳米簇为信号指示器的荧光分子信标方法分析ADA的原理图[49]Fig.1 Schematic illustration of the fluorescent molecular beacon using silver nanoclusters as a signal indicator[49]
图2 碳纳米管-荧光核酸适配体传感器检测腺苷脱氨酶活性的原理[52]Fig.2 The principle of MWCNT-based fluorescence aptasensor for adenosine deaminase activity and inhibitor screening[52]
此外,采用荧光共振能量转移(FRET)技术作为适配体荧光传感器的信号转换方式也有大量文献报道,该方法通过供体荧光分子的激发,诱发受体分子发出荧光。He等[50]设计了一种磁辅助荧光比率法,利用水溶性阳离子多聚体(CCP)与荧光素之间的能量共振转移发射荧光信号,测定ADA活性。其中荧光素标记的单链DNA信号探针(ssDNA-F1)与末端生物素标记的腺苷适配体(Biotin-aptamer)互补,可形成双链DNA (Biobin-dsDNA-Fl),由于链霉亲和素对生物素具有很高的亲和性,链霉亲和素涂层的磁珠可以快速捕捉生物素标记DNA。未加ADA时,Biobin-dsDNA-Fl加入腺苷后解旋,ssDNA-F1信号探针在磁场作用下从待测溶液中分离,加入CCP时,不能发生从CCP到荧光素的能量共振转移。加入ADA后,腺苷水解,Biobin-dsDNA-Fl重新形成并附到磁珠上,加入CCP使其发生CCP到荧光素的有效的能量共振转移,继而可通过荧光光谱检测出ADA的活性。随后Wang等[51]设计合成了新型的荧光共轭聚合物,可以检测0.5 U/L的ADA。
通过纳米材料的荧光猝灭作用检测ADA活性也有很多文献报道,如Hu等[52]基于碳纳米管-荧光腺苷适配体平台检测ADA活性并筛选其抑制剂,其原理如图2所示。该法中,首先以荧光素标记适配体1和2两段片段(FAM-Apt-1和FAM-Apt-2),当无ADA时,腺苷与FAM标记的适配体片段1,2结合形成复合物,不能与碳纳米管结合,有较高的荧光信号,当体系中加入ADA后,腺苷被分解,FAM-Apt-1和FAM-Apt-2会吸附至碳纳米管上,荧光信号被猝灭。随着ADA的不断增加,荧光信号逐渐降低。该方法的检测灵敏度达0.2 U/mL。张亮亮等[53]设计了基于氧化石墨烯-核酸适配体平台的无标记荧光传感器技术,并应用于ADA的分析,与文献[52]方法相比,适配体DNA片段未被荧光标记,而是以SYBR green Ⅰ(SG)核酸嵌入染料为荧光指示剂,以氧化石墨烯为能量受体,猝灭荧光信号。另外氧化石墨烯的超强荧光猝灭能力较大地提高了该方法的检测灵敏度,其检出限可达0.025 U/mL。
最近,Xie等[54]设计了一种新型的腺苷适配体平台分析ADA。利用检测目标片段的“指数扩增反应”,能够检测到0.8 mU/L的ADA,在该类方法中灵敏度最高。
2.8.3比色适配体传感器比色适配体传感器方法主要是结合金纳米粒子技术对ADA进行分析,金纳米粒子的胶体溶液产生红色的可见光,在630 nm处有特征吸收峰,而金纳米粒子胶体溶液沉聚后,可产生蓝色的可见光,在520 nm处有特征吸收峰。根据这一特点,可通过可见光检测数值的变化分析ADA的活性。
Zhao等[55]在2008年首次提出了可见光适配体传感器分析ADA,将适配体固定到金纳米粒子上,通过加入ADA后金纳米粒子胶体溶液的颜色变化来检测ADA的活性。张亮亮等[56]对该方法加以改进,设计了无标记的金纳米粒子腺苷传感器,腺苷上的氨基会吸附到金纳米粒上,使金纳米粒子沉聚,产生蓝色可见光,而加入ADA后,腺苷转化成肌苷,不会发生此现象,金纳米粒子的胶体溶液产生红色可见光,从而检测ADA的活性。该方法的检出限为0.822 7 U/L。Cheng等[57]利用短的单链DNA分子能够保护金纳米粒子不发生聚合的特点,也设计了未修饰的金纳米粒子腺苷适配体传感器。当无ADA存在时,腺苷与其适配体结合成网状结构,金纳米粒子呈现蓝色,当体系中加入ADA后,腺苷会被分解,单链的DNA分子呈游离状保护金纳米粒子不聚集,呈现红色,原理如图3所示。但该方法的检出限为1.526 U/L,未能进一步提高ADA活性检测的灵敏度。
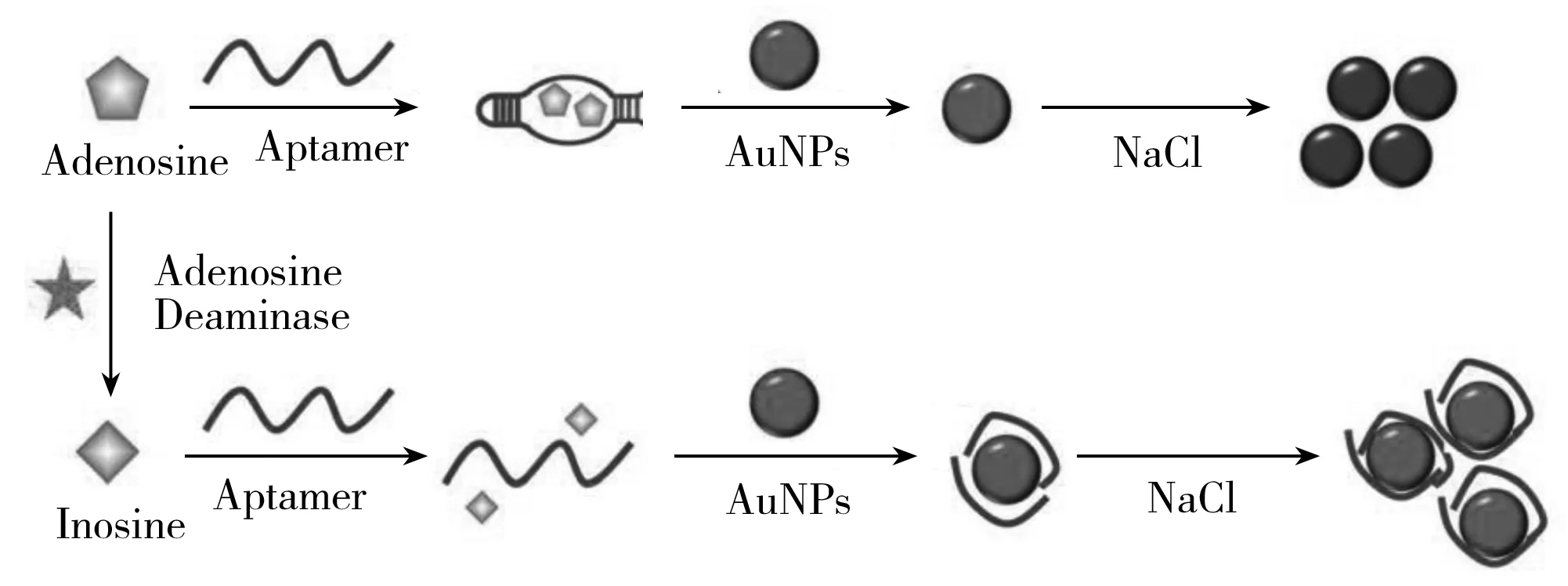
图3 金纳米粒子-比色适配体检测腺苷脱氨酶的原理[57] Fig.3 Scheme for the principle of a AuNP-based colorimetric aptasesor for ADA detection[57]
可见光适配体传感器不需要荧光标记过程和多步结合反应,检测简便、快速,但检测灵敏度远低于荧光适配体传感器。
适配体传感器的方法能够专属性地分析ADA的底物腺苷,从而间接检测ADA的活性。该方法有较低的检出限,远高于临床上要求的ADA临床检出值即4 U/L。然而,该方法并未真正应用到实际生物样品中ADA活性分析,与临床实际应用的结合尚待进一步研究。
3 结论与展望
腺苷脱氨酶是体内重要的核苷酸代谢酶,与很多疾病相关,对其活性分析具有重要的临床意义。本文聚焦ADA活性研究,综述了比色法、HPLC、CE和适配体传感器等技术分析ADA活性的研究进展。其中比色法是分析ADA的最常用方法,其简便、快速,但检测的灵敏度及准确度有很大不足。HPLC和CE等色谱技术基于样品的分离,能够准确地测定ADA的活性,不同的ADA活性分析模式不断被研究,并应用于多种临床样品的检测。近年来适配体传感器技术分析ADA活性也得到较快发展,是目前ADA分析最灵敏的方法,但该方法未被应用于实际样品中ADA活性的分析,其在临床上的应用尚有待进一步研究。
[1]Cortés A,Gracia E,Moreno E,Mallol J,Lluis C,Canela E I.Med.Res.Rev.,2015,35(1):85-125.
[2]Grunebaum E,Cohen A,Roifman C M.Curr.Opin.AllergyClin.Immunol.,2013,13(6):630-638.
[3]Salmanzadeh S,Tavakkol H,Bavieh K,Alavi S M.Jundishapur.J.Microbiol.,2015,8(3):1-5.
[4]Sakran M,Al-Duais M,Shalaby K,Kamis A.J.Mol.Pathophysiol.,2016,5(1):15-17.
[5]Ashraf M,Hussain M,Chima K K,Ayyaz S.Pak.J.Chest.Med.,2016,22(1):3-7.
[6]Carlucci F,Tabucchi A,Aiuti A,Rosi F,Floccari F,Pagani R,Marinello E.Clin.Chem.,2003,49(1):1830-1838.
[7]Paul M K,Grover V,Mukhopadhyay A K.J.Chromatogr.B,2005,822(1/2):146-153.
[8]Lupidi G,Marmocchi F,Venardi G,Cristalli G.Biochem.Mol.Biol.Int.,1997,43(6):1339-1352.
[9]Lu J,Grenache D G.Clin.Chim.Acta,2012,413(19/20):1637-1640.
[10]Dong P J,Zhang X G,Liu Y J,Tang P,Su Y,Su M S,Han X P,Shao N.Chin.J.Mod.Appl.Pharm.(董佩杰,张新国,刘英娟,唐鹏,苏媛,苏岷山,韩锡萍,邵男.中国现代应用药学),2015,32(11):1301-1305.
[12]Vielh P,Castellazzi M.J.Immunol.Methods,1984,73(2):313-320.
[13]Pinnelli V B,Jayashankar C A,Mohanty S,Asha G,Matha M M,Raghavendra D S.Int.J.Res.Med.Sci.,2016,4(1):131-134.
[14]Gandhi R V,Vora S D,Suthar D,Gohel T,Patel S.Ntl.J.Commun.Med.,2016,7(1):41-43.
[15]Bhushan M,Kumar R,Nigam P.Int.J.Adv.Med.,2016,3(1):92-96.
[16]Vaca G,Sanchez-Corona J,Olivares N,Medina C,Ibarra B,Cantu J M.Ann.Genet.,1979,22(3):182-184.
[17]Ellis G,Spooner R J,Goldbrrg D M.Clin.Chim.Acta,1973,47(1):75-87.
[18]He Z F,Chen J J,Luo X L,Wei W,Huang Y T,Yu G Q,Chen G L,Yang X B.Lab.Med.Clin.(何忠发,陈敬捷,罗雪林,韦炜,黄玉庭,俞广全,陈桂兰,杨小兵.检验医学与临床),2010,7(17):1859-1861.
[19]Oosthuizen H M,Ungerer J P,Bissbort S H.Clin.Chem.,1993,39(10):2182-2185.
[20]Wan X P,Zhan P P,Zhang K.Chin.J.Clin.Lab.Sci.(万雄萍,詹蓓蓓,张抗.临床检验杂志),1998,6:323-326.
[21]Hu W H,Wei X W,Wang C Y,Yao S Y,Wang H.Chin.J.Misdiagnostics(胡卫红,魏小文,王超要,姚尚彦,王华.中国误诊学杂志),2006,6(2):262-267.
[22]Zhou M X,Guan C Y,Chen X Y.Chin.J.Clin.Lab.Sci.(周美霞,管茶英,陈肖燕.临床检验杂志),2004,22(5):338-340.
[23]Bota A,Gella F J,Canalias F.Clin.Chim.Acta,2000,290(2):145-157.
[24]Xu S Q,Chen Z F,Shu B H,Zhou Y K.Chin.J.Antitubculosis(徐顺清,陈志飞,舒柏华,周宜开.中国防痨杂志),1997,19(4):183-185.
[25]Niedzwicki J G,Mayer K H,Abushanab E,Abernethy D R.Am.J.Hematol.,1991,37(3):152-155.
[26]Yegutkin G G.Crit.Rev.Biochem.Mol.,2014,49(6):473-497.
[27]Hjemdahl-Monsen C E,Papastathopoulos D S,Rechnitz G A.Anal.Chim.Acta,1977,88(2):253-259.
[28]Li Y Q,Wei S X,Zhang C S.J.SichuanUniv.:Med.Sci.(李毓琦,魏素萱,张崇淑.四川大学学报:医学版),1985,16(3):230-233.
[29]Wei S X,Li Y Q,Xiao Z F,Chen K Q,Xu C Y,Yang S Z,Xie S X,Zhao X W,Zhang C S.J.SichuanUniv.:Med.Sci.(魏素萱,李毓琦,肖志芳,陈开全,徐承银,杨式之,谢蜀祥,赵小文,张崇淑.四川大学学报:医学版),1988,19(3):249-251.
[30]Chen J,Li Y Q,Luo C H.WestChinaJ.Pharm.Sci.(陈静,李毓琦,罗春华.华西药学杂志),1990,5(3):145-148.
[31]Uberti J,Lightbody J J,Johnson R M.Anal.Biochem.,1977,80(1):1-8.
[32]Hartwick R,Jeffries A,Krstulovic A,Brown P R.J.Chromatogr.Sci.,1978,16(9):427-435.
[33]Obata T,Yamanaka Y.Comp.Biochem.Physiol.,1998,119(1):309-313.
[34]Ni H,Li Y H,Hao R L,Li H,Hu S Q,Li H H.Int.J.FoodSci.Technol.,2016,51:1168-1176.
[35]Schepp J,Bulashevska A,Mannhardt-Laakmann W,Cao H,Yang F,Seidl M,Kelly S,Hershfield M,Grimbacher B.J.Clin.Immunol.,2016,36:179-186.
[36]Bao J M,Regnier F E.J.Chromatogr.A,1992,608(1/2):217-224.
[37]Li Y X,Liu D N,Bao J J.J.Chromatogr.B,2011,879(1):107-112.
[38]Sun P,Hartwick R A.J.Chromatogr.A,1995,(2):279-285.
[39]Saevels J,Schepdael A V,Hoogmartens J.Electrophoresis,1996,17:1222-1227.
[40]Pei L,Xie L J,Lin Q,Ling X M,Guan Z,Yang Z J.Anal.Biochem.,2011,414(1):131-137.
[41]Ji X W,Ye F G,Lin P T,Zhao S L.Talanta,2010,82:1170-1174.
[42]Lin P T,Zhao S L,Lu X,Ye F G,Wang H S.J.Sep.Sci.,2013,36:2538-2543.
[43]Qi Y,Li Y,Bao J J.Anal.Biochem.,2016,506:31-44.
[44]Adam T,Sevcík J,Svagera Z,Fairbanks L D,Barták P.Electrophoresis,1999,20:564-568.
[45]Iqbal J,Müller C E.J.Chromatogr.A,2011,1218(29):4764-4771.
[46]Zhang K,Zhu X L,Wang J,Xu L L,Li G X.Anal.Chem.,2010,82(8):3207-3211.
[47]Zhang K,Xie M H,Zhou B,Hua Y R,Yan Z H,Liu H Y,Guo L N,Wu B,Huang B.Biosens.Bioelectron.,2013,41(6):123-128.
[48]Zhang K,Yang Q L,Zhang J,Fu L X,Zhou Y,Wu B,Xie M H,Huang B.Biosens.Bioelectron.,2013,42(5):87-92.
[49]Zhang K,Wang K,Xie M H,Zhu X,Xu L,Yang R L,Huang B,Zhu X L.Biosens.Bioelectron.,2014,52:124-128.
[50]He F,Yu M H,Wang S.Chin.Sci.Bull.,2009,54(8):1340-1344.
[51]Wang C,Tang Y L,Liu Y,Guo Y.Anal.Chem.,2014,86(13):6433-6438.
[52]Hu K,Huang Y,Wang S E,Zhao S L.J.Pharm.Biomed.,2014,95:164-168.
[53]Zhang L L.NewOpticalSensingMethodsforDetectingtheActivityofEnzymesBasedontheNanomaterialsandFunctionalNucleicAcids.Changsha:Hunan University (张亮亮.基于纳米材料和功能核酸的光学传感新方法用于酶活性检测.长沙:湖南大学),2006.
[54]Xie M X,Zhou S L,Mao Y D.Anal.Lett.,2015,48(12):1881-1891.
[55]Zhao W A,Chiuman W,Lam J C F,McManus S A,Chen W,Cui Y G,Pelton R,Brook M A,Li Y F.J.Am.Chem.Soc.,2008,130(11):3610-3618.
[56]Zhang L L,Zhao J J,Jiang J H,Yu R Q.Chem.Commun.,2012,48(89):10996-10998.
[57]Cheng F,He Y,Xing X J,Tan D D,Lin Y,Pang D W,Tang H W.Analyst,2015,140(5):1572-1577.
Research Progress for Analytical Methods of Adenosine Deaminase Activity
XU Ran,QI Yan-fei,LI You-xin*
(Collaborative Innovation Center of Chemical Science and Engineering,Tianjin Key Laboratory for Modern Drug Delivery and High-Efficiency,School of Pharmaceutical Science and Technology,Tianjin University,Tianjin300072,China)
Adenosine deaminase(ADA), a kind of catabolic enzymes toward nucleic acid,has a close relationship with cell immunocompetence.ADA activity is abnormal in many diseases.Therefore,more and more researchers have been focusing on research of the relationship between ADA activity and some diseases.Analysis of the ADA activity is considered to has a very important significance in clinical diagnosis and treatment of diseases.Currently,many reports about novel analysis methods of ADA activity have been published,but no relevant reviews have been reported so far.In this paper,analytical methods of ADA activity such as colorimetric,chromatography and adapter sensor methods,are summarized,which is expected to provide
for the analysis of ADA.
adenosine deaminase;activity analysis;clinical test;chromatography;adapter sensor
2016-04-25;
2016-05-07
国家自然科学基金(21375093);高等学校博士学科点专项科研基金(20130032120081);天津市应用基础与前沿技术研究计划青年项目(15JCQNJC43200)
李优鑫,博士,讲师,研究方向:电泳技术的开发等,Tel:022-27892820,E-mail:lyx@tju.edu.cn
综述
10.3969/j.issn.1004-4957.2016.09.026
O629.8;G353.11
A
1004-4957(2016)09-1209-08

