适用于高通量筛选的氢化可的松生物转化率快速检测方法研究
叶 松,王洪彬,凌 敏,桂书祺,毛淑红,路福平*
(1.工业发酵微生物教育部重点实验室,天津 300457;2.天津市工业微生物重点实验室,天津 300457;3.天津科技大学 生物工程学院,天津 300457)
适用于高通量筛选的氢化可的松生物转化率快速检测方法研究
叶松1,3,王洪彬1,2,3,凌敏1,3,桂书祺1,3,毛淑红1,2,3,路福平1,2,3*
(1.工业发酵微生物教育部重点实验室,天津300457;2.天津市工业微生物重点实验室,天津300457;3.天津科技大学生物工程学院,天津300457)
以浓硫酸显色反应为基础,通过分光光度计可见光双波长法测定氢化可的松转化率。利用朗伯比尔定律,结合三维数据建模二阶校正,建立了氢化可的松生物转化率的快速测定方法,回收率为96.9%~110.8%。验证实验显示,其测定结果与药典方法(高效液相色谱)具有很高的一致性,能够满足菌种高通量初筛检测的需求。该研究在该菌种高通量选育方面有良好的应用前景。
氢化可的松;生物转化率;双波长检测法;高通量筛选
甾体药物是仅次于抗生素的第二大类药物,在临床上具有极其重要的医药价值,通常在免疫调节、皮肤疾病治疗及生育控制方面有较好的作用[1-3]。其中,甾体药物氢化可的松(Hydrocortisone,HC)是一种肾上腺皮质激素类药物,具有抗炎、抗毒、抗过敏等作用[4-7],已被广泛用于治疗各种疾病[8-10]。此外,氢化可的松还是生产泼尼松等其他类高效皮质激素药物的基础原料[11]。在我国,氢化可的松是以17α-羟基孕甾-4-烯-3,20-二酮-21-醋酸酯(RSA)为底物,蓝色梨头霉(Absidiacoerulea)作为生产菌株,通过生物转化法进行大规模生产[12]。
但目前工厂所用菌种在转化过程中会产生约30%的副产物表氢化可的松(Epihydrocortisone,EHC)[12],这严重制约了HC转化率的提高,因此迫切需要通过菌种选育筛选出转化特异性更高的菌种。目前国内外尚无适合氢化可的松转化菌种选育的高通量筛选方法,主要的技术瓶颈在于缺乏适合的高通量产物检测技术[13]。氢化可的松和表氢化可的松主要的检测方法为高效液相色谱法[14],该法虽然准确可靠,但操作繁琐耗时,不适于高通量筛选[15]。本研究以浓硫酸显色反应为基础,通过可见光双波长检测来测定氢化可的松转化率,建立了一种便捷、灵敏和可靠的氢化可的松转化特异性的检测方法,在其菌种高通量选育方面有较好的应用前景。
1 实验部分
1.1试剂、材料与仪器
标准品:17-羟基-孕甾-4-烯-3,20-二酮-21-醋酸酯(RSA,纯度≥99%)、氢化可的松(11β,17α,21-三羟基-孕甾-4-烯-3,20-二酮,纯度≥99%)、表氢化可的松(11α,17α,21-三羟基-孕甾-4-烯-3,20-二酮,纯度≥99%)均由天津市津津制药厂提供;浓硫酸(上海生工有限公司);甲醇(Fisher公司)。
蓝色犁头霉(Absidiacoerulea)由天津科技大学应用微生物研究室菌种保藏中心提供。
斜面PDA培养基:土豆汁1 L,葡萄糖20 g,琼脂20 g。
发酵培养基:葡萄糖10.5 g,酵母膏2.3 g,玉米浆12.5 g,硫酸铵5.0 g,自来水1 L,pH 6.4~6.7。
1200高效液相色谱仪(美国安捷伦公司);UV-2201型紫外可见分光光度计(日本岛津公司);酶标仪(美国赛默飞世尔公司);超纯水装置(美国密理博公司);电子天平(德国梅特勒公司)。
1.2实验方法
1.2.1溶液制备氢化可的松标准溶液:精确称取氢化可的松标准品5 mg,加无水乙醇溶解后定容于10 mL容量瓶中,配成浓度为0.5 mg/mL储备液,在4 ℃下冷藏保存。
RSA、表氢化可的松标准溶液的配制方法同上。
1.2.2分光光度计多波长扫描分别取0.025 mg产物氢化可的松、副产物表氢化可的松和底物RSA与900 μL浓硫酸反应15 min,在可见光范围内做全波长扫描,扫描波长范围为400~710 nm。
1.2.3吸光度加和性实验同一批次,添加不同体积RSA,HC,EHC标准品溶液于96孔石英酶标板中,配成一系列具有不同RSA,HC,EHC含量的混合组分。同时再按照每一混合组分中RSA,HC,EHC的含量,分别对应地将RSA,HC,EHC标准溶液以单组分形式加入96孔石英酶标板的3个小孔中。待标准溶液中的无水乙醇完全挥发后,加入200 μL浓硫酸,反应15 min,分别在RSA,HC的最大吸收峰波长处测定单组分、混合组分的吸光度,并对测定结果进行吸光度加和性分析。
1.2.4基于朗伯比尔定律的HC转化率可见光双波长检测实验同一批次在RSA,HC的最大吸收峰波长处,测定不同质量HC,EHC,RSA单组分标准品与浓硫酸反应后络合物的吸光度,作3种标准品的络合物浓度与吸光度的关系曲线,得出K474 nmHC,K474 nmEHC,K474 nmRSA,K535 nmHC,K535 nmEHC,K535 nmRSA的值。同时,依据表1中HC不同含量(即HC的转化率),将RSA,HC,EHC标准溶液按换算体积加入上述96孔石英酶标板中,配成一系列的RSA,HC,EHC不同混合组分,保持总质量为0.025 mg。待无水乙醇挥发后,向每孔加入200 μL浓硫酸,反应15 min,分别在RSA和HC吸收峰最高的波长处测定吸光度。
1.2.5基于三维数据的拟合HC转化率可见光双波长检测法实验同一批次,将RSA,HC,EHC标准溶液按换算体积加入上述96孔石英酶标板中,配成一系列的RSA,HC,EHC不同混合组分,保持总质量为0.025 mg。待无水乙醇挥发后,向每孔加入200 μL浓硫酸,反应15 min,分别在RSA,HC吸收峰最高的波长处测定一系列混合组分的吸光度A1,A2。通过软件Sigmaplot,将转化率X、吸光度A1,A2数据拟合,得到这三组数据之间的数量关系公式。
1.2.6验证方法菌体的培养与转化:将斜面种子用无菌水制成孢子悬浮液(107个/mL),按5%接种量接入每孔装有3 mL发酵液体培养基的24孔深孔微生物培养板中,使用微孔振荡仪420 r/min培养36 h后,接48孔斜面板保存菌种,同时投入底物,进行催化转化。28 ℃下振荡培养24 h后,加入预先用乙醇溶解的底物(最终底物质量浓度为2.5 g/L),继续在相同培养条件下生物转化72 h。
转化产物的萃取与转化率分光光度计双波长检测:向发酵液中添加等体积的乙酸乙酯进行萃取,静置,取上层有机相6 μL于96孔石英酶标板中,待乙酸乙酯挥发后加入200 μL浓硫酸,反应15 min。按照可见光双波长法分别在RSA和HC吸收峰最高的波长处测定吸光度,通过公式计算得到HC的转化率。
转化率高效液相色谱检测法:色谱条件:采用C18柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水(70∶30),流量0.8 mL/min,进样量10 μL,柱温25 ℃;UV 242 nm检测。
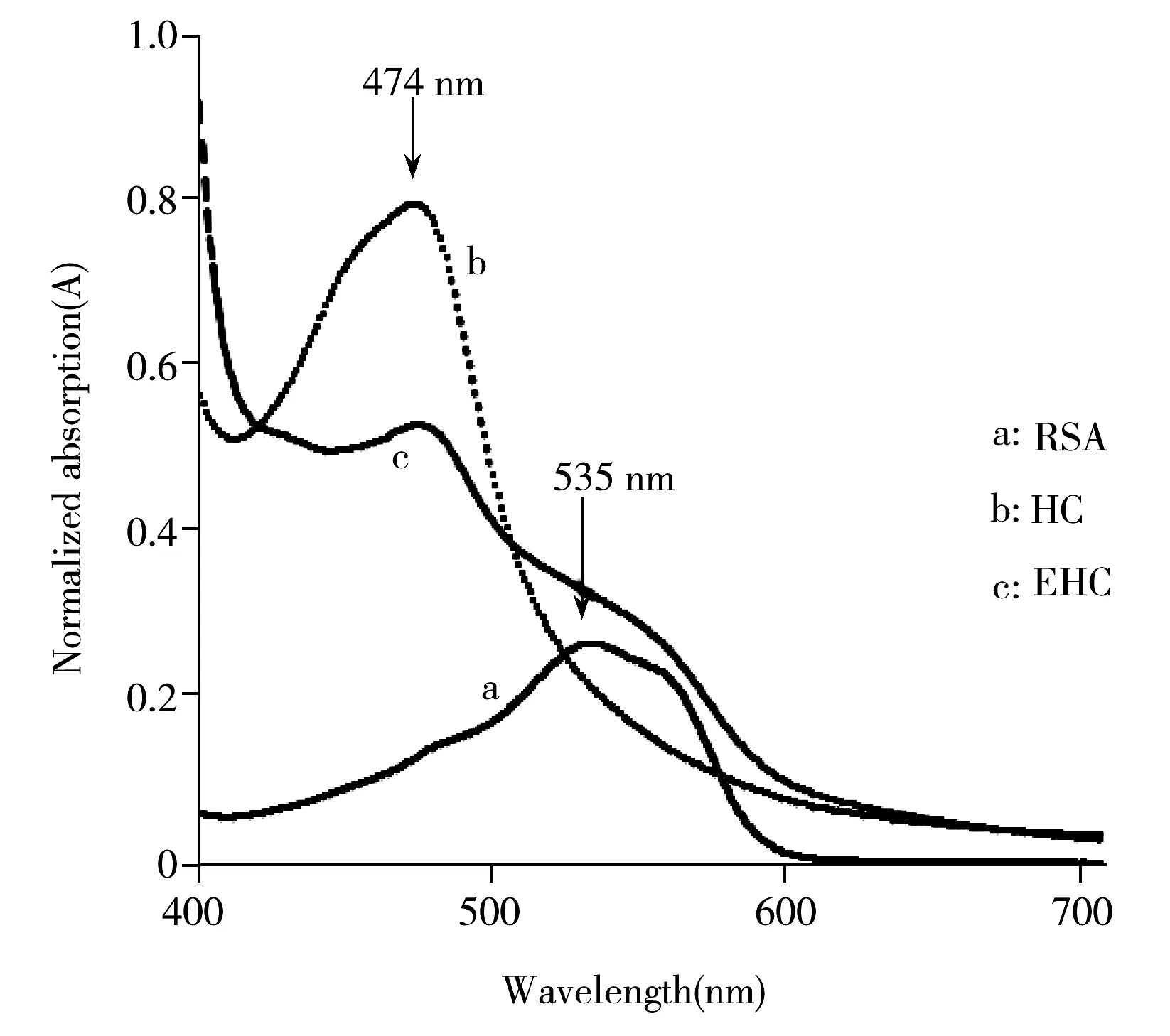
图1 不同标准品与浓硫酸反应络合物的可见光谱图Fig.1 Absorption spectra of the complex compounds of different standards
2 结果与讨论
2.1可见光最大吸收波长的测定
用双光束紫外可见分光光度计将HC,EHC,RSA单组分标准品与浓硫酸反应后的络合物于可见光波长范围内扫描,测得吸收曲线如图1所示。结果表明:HC在474 nm处有最大吸收峰,RSA在535 nm处有最大吸收峰,EHC在474 nm和535 nm处均有吸收。
2.2可见光测定线性特征的考察
以底物RSA、中间产物RS、主产物HC和副产物EHC作为标样绘制标准曲线,结果显示,在0.2×10-4~2.0×10-4mol/L浓度范围内,RSA,HC,EHC的络合物浓度与对应吸光度呈良好的线性关系。在波长474 nm处,其相关系数分别为0.997 1,0.996 4,0.996 6;在波长535 nm处,其相关系数分别为0.996 4,0.997 2,0.997 9。结果表明曲线线性良好,可用于定量分析。
2.3吸光度的加和性实验
不同系列单组分吸光度之和与混合组分吸光度之间的关系曲线分析结果显示,在波长474 nm处,混合组分的吸光度与各单组分吸光度之和的偏差较小,说明该波长下具有较好的加和性,大致可以满足A≈ARSA+AHC+AEHC。而在波长535 nm处,混合组分的吸光度与各单组分吸光度之和具有一定偏差,表现出的加和性不如波长474 nm处。
2.4基于理论推导的氢化可的松转化率的双波长测定方法
基于在波长474 nm处,3种物质的混合组分总吸光度与各单组分吸光度之间的加和性较好,根据朗伯比尔定律对HC转化率的双波长检测方法进行了理论推导。
蓝色犁头霉以RSA为底物进行生物催化转化,得到主产物HC(约70%),副产物EHC(约30%)。因此忽略蓝色犁头霉生物转化过程中极少量其他位置羟基化合物的影响,将HC作为主产物,EHC作为副产物,RSA作为底物进行检测。通过测定混合物在波长474 nm和535 nm处的吸光度A,根据朗伯比尔定律,可得公式(1):
A474 nm=K474 nmHC×CHC+K474 nmEHC×CEHC+K474 nmRSA×CRSA
A535 nm=K535 nmHC×CHC+K535 nmEHC×CEHC+K535 nmRSA×CRSA
(1)
假设1 mol RSA转化为HC和EHC的摩尔数分别为m和n,未转化的RSA的摩尔数则为(1-m-n);如果设RSA的投料浓度为C0,则转化3 d后,发酵液中:CHC+CEHC+CRSA=C0;设X=CHC/C0,Y=CEHC/C0,则:CRSA/C0=(1-X-Y),X为HC的摩尔转化率。代入公式(1)后可得公式(2):
A474 nm=K474 nmHC×C0X+K474 nmEHC×C0Y+K474 nmRSA×C0(1-X-Y)
A535 nm=K535 nmHC×C0X+K535 nmEHC×C0Y+K535 nmRSA×C0(1-X-Y)
(2)
已知在该检测方法中,RSA的投料量可换算为C0=1.96×10-4mol/L。根据“1.2.4”检测方法,同一批次,作出单组分HC,EHC,RSA标准品与浓硫酸反应后的络合物在波长474,535 nm处的浓度与吸光度标准曲线,得出:
K474 nmHC=0.540×104,K474 nmEHC=0.332×104,K474 nmRSA=0.076 1×104,K535 nmHC=0.136×104,K535 nmEHC=0.246×104,K535 nmRSA=0.196×104,将其代入公式(2),简化后即推导出HC转化率的计算公式(3):
X=(A474 nm-5.124×A535 nm+1.82)/1.508
(3)
同时,根据HC不同含量比(即HC转化率)配制的HC,RSA,EHC不同组分含量的混合标准品与浓硫酸反应15 min后,得到其在474,535 nm波长处的吸光度,根据上述公式计算出X值,结果见表1。

表1 初探方法实验结果Table 1 The result of proposed method tests
实验结果显示:X的计算值与实际值之间误差较大。在对混合样品进行多组分分析时,由于溶液中各种物质相互之间对可见光的吸收作用,从而导致分析结果不准确,误差很大。
2.5基于三维数据拟合的氢化可的松转化率的双波长测定方法
由于朗伯比尔定律测定方法的误差较大,提出一种非线性浓度校准模型的假设。通过标样数据估算出吸收校准参数,建立分析模型。
根据“1.2.5”方法,同一批次,得出不同HC含量(即HC转化率)的混合组分与浓硫酸反应后在474,535 nm波长处的吸光度,对HC转化率X,A474 nm,A535 nm数据进行拟合,得出三者之间的数量关系。
根据多次实验数据拟合三维数据图发现,当X的实际值介于0~1之间,无法得到较高的拟合度。因此对X进行分段拟合,最终发现选用X在0~0.6,0.6~1之间的数据分段拟合,拟合程度最高,相关系数均达0.99以上。
研究了X实际值在0.6~1之间时,X值与混合组分在474,535 nm处吸光度之间的关系,根据数据模拟了三维曲面,结果如图2A,得到X值的计算公式(4):
(4)
同时研究了X实际值为0~0.6时,X值与混合溶液在474,535 nm处吸光度之间的关系,根据数据模拟了三维曲面,结果如图2B,得到X值的计算公式(5):
(5)
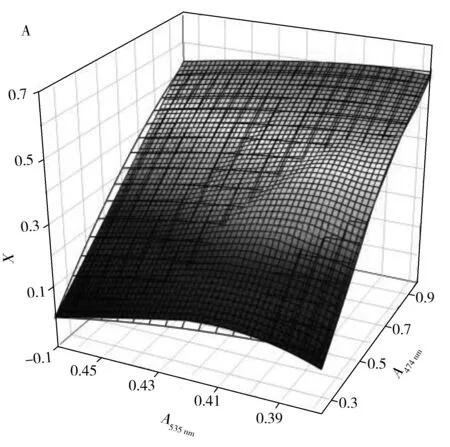
图2 氢化可的松转化率(X)与A474 nm和A535 nm的拟合曲线Fig.2 Fitting curves of hydrocortisone biotransformation rate(X) with A474 nm and A535 nmA.X:0~0.6;B.X:0.6~1
为验证模型的预测能力,对同一批号样品,保持总质量一定(0.025 mg),按照HC不同转化率配比RSA,HC,EHC的含量,进行回收率实验,结果如表2。结果表明回收率为96.9%~110.8%,证明模型有效,可对混合体系中HC的转化率进行较为精确的预测。
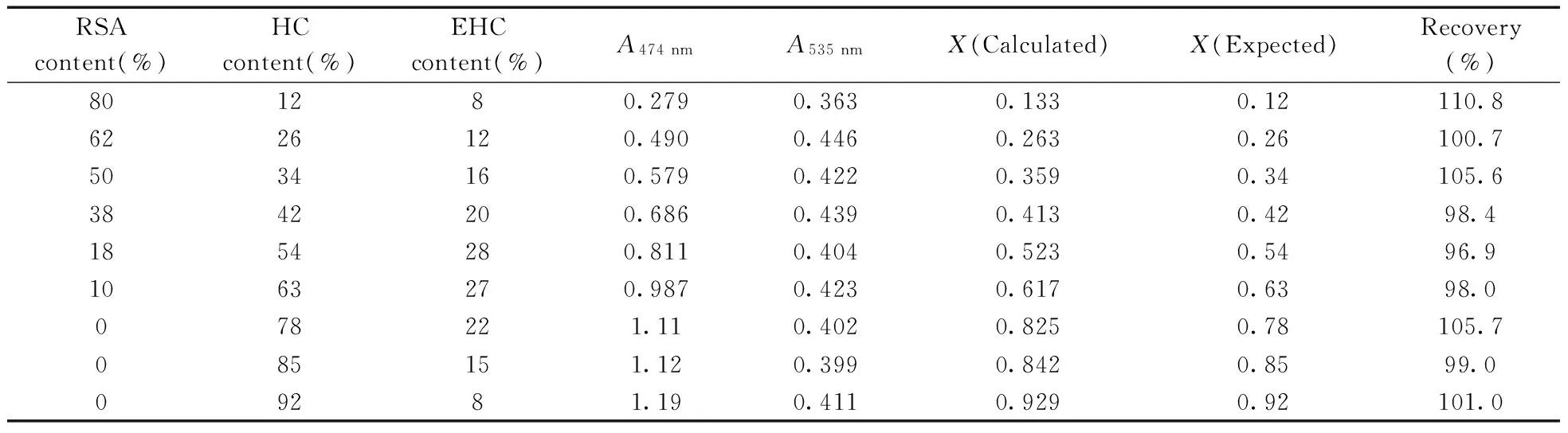
表2 回收率实验结果Table 2 The result of recovery tests
对多次重复实验的数据进行分析,发现K=(A474 nm-A535 nm)/A474 nm的值随HC转化率的增大而增大。因此,最终将检测方法确定为:在同一批次实验中,首先按照对一系列不同的标准品混合组分中X,A474 nm,A535 nm进行数据拟合,得出公式(4~5);再计算出一系列不同的标准品混合组分中,当X=0.6时,K=(A474 nm-A535 nm)/A474 nm的值K0;然后,按照“1.2.6”方法,将发酵液中待测试样在474,535 nm处的OD值代入公式K=(A474 nm-A535 nm)/A474 nm,比较计算出的K值与K0,将转化率在0~0.6之间的数据与0.6~1之间的数据分开;最后,将发酵液中待测试样在474,535 nm处的OD值,以不同的转化率区间,代入公式(4~5),计算出待测发酵液中HC的转化率,进而快速检测出发酵液中HC的转化率。
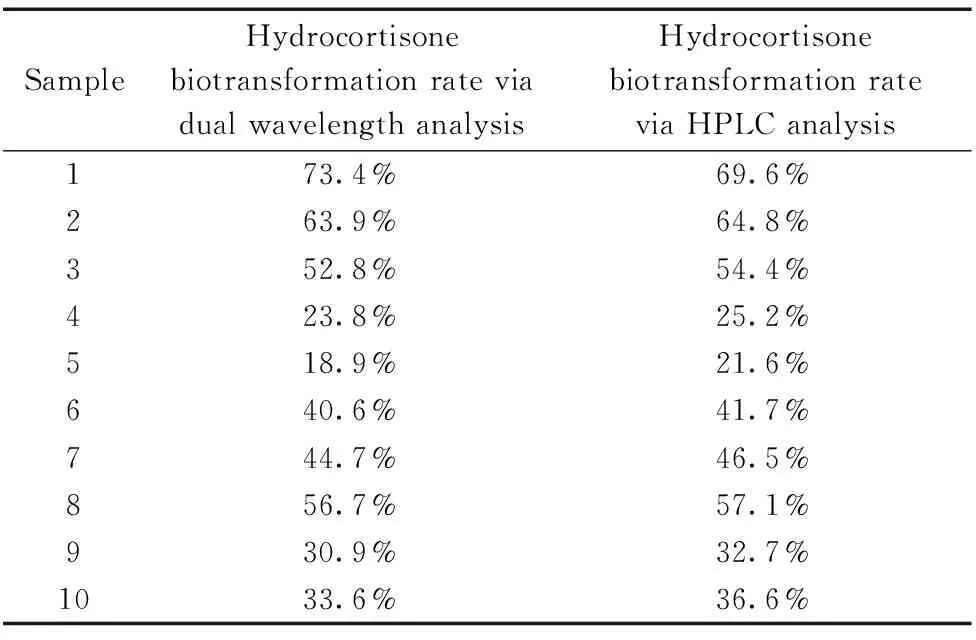
表3 方法验证实验结果Table 3 The result of feasibility verifying test
2.6氢化可的松转化率的双波长测定方法的考察与验证
选取实验室保存的具有不同转化特异性的10株蓝色犁头霉突变株,作RSA的生物转化,分别采用药典规定的HPLC法和可见光双波长检测法检测HC的转化率。两种方法对比结果见表3。发现HPLC方法与可见光双波长检测法的结果偏差不大。因此认为可见光双波长测定方法可用于HC转化率的粗略检测。
3 结 论
本文利用朗伯比尔定律,结合三维数据建模,对发酵液中氢化可的松的转化率进行了定量分析。实验表明,利用朗伯比尔定律,结合三维数据建模二阶校正相结合,可用于氢化可的松生物催化转化率的测定。测定结果与药典方法高效液相色谱法基本一致。该法操作简便,节约时间,效率高,适用于发酵液中氢化可的松转化率的快速检验,从而为高通量筛选高产氢化可的松的菌株提供了一种快速、有效的检测方法。
[1]Bhatti H N,Khera R A.Steroids,2012,77(12):1267-1290.
[2]Donova M V,Egorova O V.Appl.Microbiol.Biotechnol.,2012,94(6):1423-1447.
[3]Antje B,Anne M,Hans J K,Matthias K,Ronald M.FEMSMicrobiol.Lett.,2014,359(1):124-130.
[4] Howard W S,Joseph W B,Arnold Y.Clin.Ther.,1997,19(4):710-719.
[5]Wang J,Chen C Z,Li B A,Zhang J H,Yu Y T.EnzymeMicrob.Technol.,1998,22(5):368-373.
[6] Hany S,Peter Y,Ahmed M A,Nicholas B.ControlRelease,2010,149(2):175-181.
[7] Eliot F,Eva N,Astrid C,Hector M,Liuska P,Alejandro C,Roberto S L.Respir.Physiol,2000,120:61-69.
[8] Buning J W,Brummelman P,Koerts J,Dullaart R P F,Berg G,Klauw M,Tucha O,Wolffenbuttel B H R,Beek A.Psychoneuroendocrinol.,2015,55:36-47.
[9]Sarafoglou K,Addo O Y,Turcotte L,Otten N,Wickremasinghe A,Pittock S,Kyllo J,Lteif A N,Himes J H,Miller B S.J.Pediatr.,2014,164(5):1141-1146.
[10]Fleming L K,Rapp C G,Sloane R.Pediatr.Nurs.,2011,26:55-60.
[11]Restaino O F,Marseglia M,Diana P,Borzacchiello M G,Finamore R,Vitiello M,D’Agostino A,Rosa M D,Schiraldi C.Process.Biochem.,2016,51:1-8.
[12]Wang M,Guo Y W,Lu W Y,Bao H K,Du L X.J.Appl.Environ.Biotechnol.(王敏,郭亚文,卢文玉,包慧珂,杜连祥.应用与环境生物学报),2004,10(5):663-666.
[13]Toit E A D,Rautenbach M.J.Microbiol.Methods,2000,42(2):159-165.
[14]Shi F,Tan J,Chu J,Wang Y H,Zhuang Y P,Zhang S L.J.Microbiol.Methods,2015,109(1):134-139.
[15]Tan J,Chu J,Hao Y Y,Wang Y H,Yao S C,Zhuang Y P,Zhang S L.J.TaiwanInst.Chem.Eng.,2013,44(4):538-544.
A New Rapid Method for Hydrocortisone Biotransformation Rates Determination Applicable for High-throughput Selection System
YE Song1,3,WANG Hong-bin1,2,3,LING Min1,3,GUI Shu-qi1,3,MAO Shu-hong1,2,3,LU Fu-ping1,2,3*
(1.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,Tianjin300457,China;2.Tianjin Key Laboratory of Industrial Microbiology,Tianjin300457,China;3.College of Biotechology,Tianjin University of Science and Technology,Tianjin300457,China)
In this study,concentrated sulphuric acid was employed for the determination of hydrocortisone biotransformation rate,which could be monitored via dual wavelength analysis.A rapid and simple method for the determination of hydrocortisone biotransformation rate was developed by combining the well-known Lambert Beer law and the 3D data modeling method.The method recoveries were in the range of 96.9%-110.8%.The validation results,which were consistent with that of HPLC method,showed that the method could meet the needs for preliminary screening ofAbsidiacoeruleavia high-throughput system.This study has a good application prospect in breedingAbsidiacoeruleaof high specific biotransformation ability.
hydrocortisone;biotransformation rate;dual wavelength analysis;high-throughput selection
2016-02-17;
2016-03-30
国家高技术研究发展计划(863计划)项目(2011AA02A211)
路福平,博士,教授,研究方向:酶工程与应用微生物,Tel:022-60600160,E-mail:lfp@tust.edu.cn
10.3969/j.issn.1004-4957.2016.09.008
O657.3;TQ460.72
A
1004-4957(2016)09-1121-06

