硅胶柱与凝胶柱净化/气相色谱-质谱联用测定植物叶片中多环芳烃
包奋强,安海龙,惠亚梅,张祥雪*,夏新莉*
(1.北京林业大学 理学院,北京 100083;2.北京林业大学 林木育种国家工程实验室,北京 100083;3.中持依迪亚(北京)环境监测分析股份有限公司,北京 100192)
硅胶柱与凝胶柱净化/气相色谱-质谱联用测定植物叶片中多环芳烃
包奋强1,安海龙2,惠亚梅3,张祥雪1*,夏新莉2*
(1.北京林业大学理学院,北京100083;2.北京林业大学林木育种国家工程实验室,北京100083;3.中持依迪亚(北京)环境监测分析股份有限公司,北京100192)
建立了索氏提取-硅胶柱和凝胶柱净化/气相色谱-质谱联用(GC-MS)测定植物叶片中多环芳烃的分析方法。叶片中的多环芳烃经二氯甲烷-正己烷(体积比1∶1)索氏提取,提取液采用硅胶柱和凝胶柱两步净化(手填硅胶柱和GPC柱)后,进行GC-MS测定,根据保留时间和特征离子进行定性,内标法定量。方法检出限为0.025 1~5.80 ng/g,加标回收率为82.2%~130%,相对标准偏差不大于11%。该方法能有效去除植物叶片中的色素与油脂,适用于植物叶片中多组分多环芳烃的痕量分析,为测定植物组织内多环芳烃的含量提供了技术支撑。
索氏提取;硅胶柱;凝胶柱;多环芳烃;气相色谱-质谱联用(GC-MS);植物
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是含有2个或2个以上苯环的具有致癌、致畸和致突变作用的有机化合物,也是一类普遍存在大气环境中的有机污染物之一[1]。大气中PAHs的来源可分为天然源和人为源,其中人为源为主要来源,如煤炭燃烧、汽车尾气、钢铁和石油工业生产中的排放[2]。PAHs可通过食物链在动植物体内累积,从而严重危害人类健康[1]。
PAHs进入植物体主要有两种途径:土壤-植物体和空气-植物体[3]。土壤中PAHs与有机质紧密结合,不易被植物根部吸收而进入植物体。而空气-植物体是PAHs从空气通过气态和颗粒态沉降到叶片的蜡质表皮或通过气孔吸收进入植物体[4-5]。因此,空气-植物体是植物体富集PAHs的主要途径[6]。目前,有关PAHs含量测定的研究对象主要是非植物介质,如水体、沉积物和颗粒物等[7-10],也有研究分析了植物叶片中PAHs的含量特征,但测定植物叶片中PAHs含量的方法大多依赖于测定其他介质中PAHs的分析方法[11-13]。植物叶片,尤其是针叶树种如油松叶片,含有大量的脂类、蜡质和色素,已有方法很难消除这些成分的干扰。因此,建立通用和准确测定树叶中PAHs的分析方法很有必要。本文采用索氏提取,硅胶柱和凝胶柱双净化的前处理方式,以GC-MS对常见树种叶片中痕量多环芳烃进行分析检测。由于萘的实验背景值较高,且挥发性强、易降解,在环境中有很大的不确定性,所以本文对萘未作探讨。
1 实验部分
1.1仪器与试剂
气相色谱-质谱联用仪(美国Agilent,7890A GC-日本电子JMS-Q1000);RE-52AA旋转蒸发仪(日本EYELA);SE812氮吹仪(北京帅恩科技有限责任公司 );Tube Mill control研磨机(德国IKA公司);自制直径为15 mm×30 cm的层析柱以及直径为25 mm ×30 cm带沙板的层析柱。正己烷、二氯甲烷、丙酮、无水硫酸钠、层析用硅胶(0.63~0.1 mm)、层析用凝胶(200~400目)均为分析纯。

PAHs进样标:苯并(a) 蒽-D12溶液(溶剂为壬烷),浓度为10 μg/mL,用正己烷稀释成1 μg/mL作为工作溶液,上机测试前加入,用于跟踪样品前处理、分析过程的回收率。
PAHs净化标:苊烯-d10、菲-d10、荧蒽-d10、芘-d10、苯并(a) 芘-d12、苯并(g,h,i) 苝-d12混合溶液(溶剂为壬烷),浓度均为10 μg/mL,用正己烷稀释至1 μg/mL作为工作溶液,样品萃取前加入,用于GC-MS的定量分析。
1.2实验方法
1.2.1样品的提取称取5 g植物粉末加入玻璃纤维滤筒中,添加50 μL浓度为1 μg/mL的PAHs净化标后,将滤筒放入索氏提取器中,用200 mL正己烷-二氯甲烷混合溶液(1∶1)以每小时回流不少于4次的速度连续提取16~24 h。提取完成后,将提取液旋转蒸发浓缩,在45 ℃以下浓缩至1~2 mL,加入10 mL正己烷继续旋蒸,将溶剂完全转为正己烷,浓缩至1 mL左右,待净化。
1.2.2样品的净化手填硅胶柱:在层析柱(直径15 mm ×30 cm)底部垫石英棉,用10 mL正己烷冲洗内壁,湿法装柱,从下至上依次填充活化硅胶10 g和无水硫酸钠6 g,用60 mL正己烷淋洗硅胶柱。将浓缩好的样品转移至硅胶柱上。用25 mL正己烷洗脱,弃去洗脱液;再用80 mL正己烷-二氯甲烷混合溶液(4∶1)洗脱,收集洗脱液,整个洗脱过程淋洗速度为1滴/s。将洗脱液旋转蒸发浓缩至3 mL以下,准备下一步处理。
GPC柱:溶剂为正己烷-二氯甲烷混合溶液(1∶1),使用自带沙板直径为25 mm×30 cm的层析柱。将清洗好的凝胶装填到层析柱中,装填高度为20 cm,用100 mL混合溶剂淋洗GPC柱。将浓缩好的样品转移到GPC柱上,用50 mL混合溶剂洗脱,弃去洗脱液;再用100 mL混合溶剂洗脱,收集洗脱液。将洗脱液旋转蒸发浓缩至约1~2 mL,转移到氮吹管中氮吹至0.5 mL,在最终样品中加入50 μL 浓度为1 μg/mL的PAHs进样标,涡旋混匀后,待测。
1.2.3仪器条件气相色谱条件:使用DB-5MS(30 m×0.25 mm×0.25 μm) 毛细管柱,初始温度为50 ℃,保持2 min,以20 ℃/min升至200 ℃,保留2 min,再以4.5 ℃/min升至240 ℃,保留2 min,最后以2.5 ℃/min升至290 ℃,保留2 min。进样口温度为280 ℃,载气为高纯氦气(纯度99.999%)。进样体积1.0 μL,不分流进样。
质谱条件:EI 源,电子能量70 eV,传输线温度270 ℃,离子源温度250 ℃,检测器电压:-1 300 V,离子化电流:100 μA,扫描方式为选择离子监测(SIM)。
2 结果与讨论
2.1净化方法的优化
PAHs的净化方法一般有硅胶柱净化或硅胶和弗罗里硅土按照一定比例装填的层析柱净化,但均为一步净化。由于PAHs是半挥发性污染物,植物样品中PAHs的含量远远小于环境样品中的PAHs含量,但植物样品中含有大量色素和少量油脂杂质会干扰样品的测定,因此必须优化净化方法,尽可能完全去除杂质,以满足分析要求。本方法选择两步净化——硅胶柱净化和GPC净化。
硅胶是分析PAHs最适合的固相萃取吸附剂,应用硅胶柱净化样品中PAHs具有分离性能稳定、淋洗液用量少、净化效果明显等特点[14]。常用的1 g硅胶柱适用于土壤、沉积物等,但植物叶片含有大量的脂类和蜡质,易堵塞柱子。本文采用手填式硅胶(10 g)柱,既不易堵柱又具有一定的净化效果。但仅过硅胶柱,洗脱液为橙色且黏稠,不符合检测条件。
为使样品净化彻底,采用手填式凝胶(10 g)柱进一步渗透净化[15]。GPC柱能够将硅胶净化后剩余的油脂和色素完全除去,得到无色透明的洗脱液。因此,依次过硅胶柱和凝胶柱可使样品充分净化,得到可靠性强的测试结果。
2.2标准曲线的绘制
采用内标法定量,配制不同浓度的标准溶液(10,20,50,100,250,500,1 000 ng/mL),各浓度点均相应的含净化标和进样标各100 ng/mL。用标准物质与相应内标物质的峰面积之比(y)和标准溶液中标准物质与内标物质的浓度比(x)制作标准曲线,结果见表1。15种多环芳烃在10~1 000 ng/mL范围内线性良好,仪器检出限(IDL)和定量下限(IQL)分别为1.07~3.26 ng/mL和4.27~13.1 ng/mL。图1为多环芳烃的总离子流色谱图。
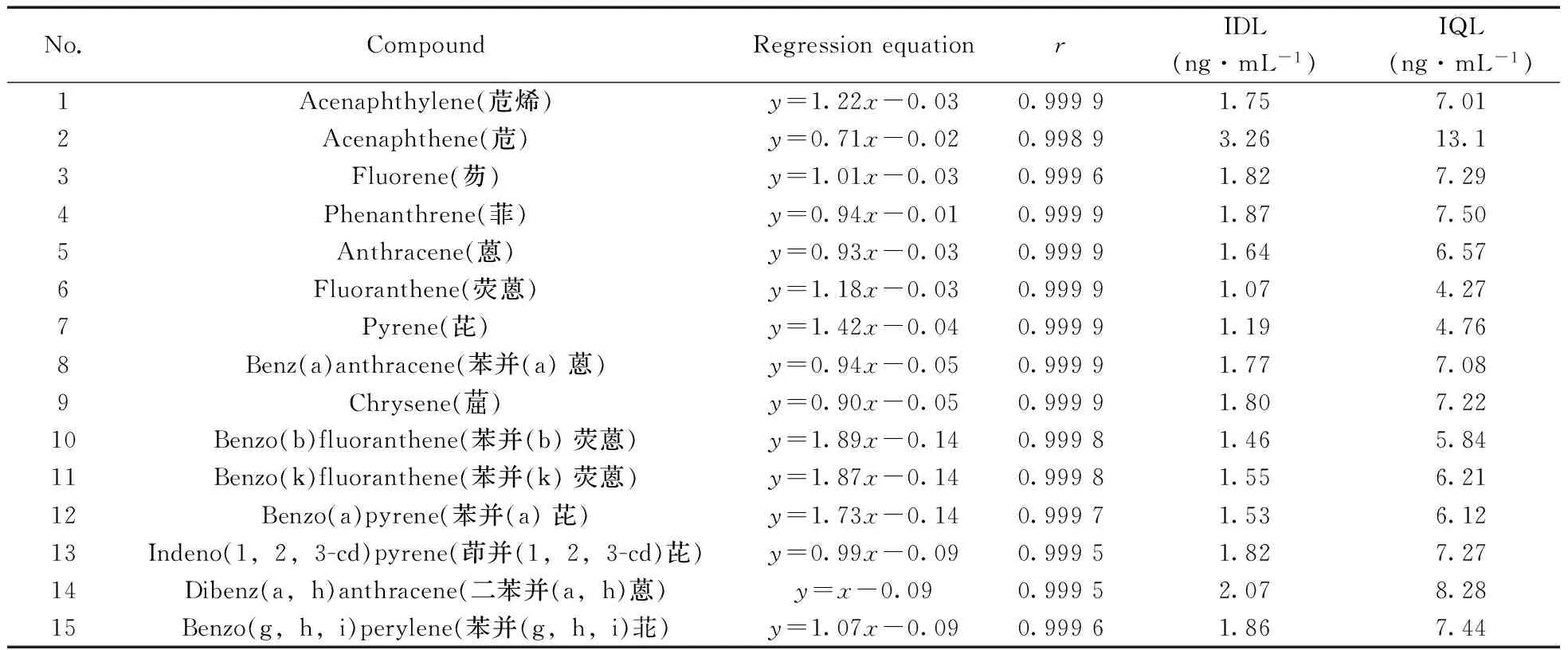
表1 15种PAHs的线性方程、相关系数(r)、仪器检出限(IDL)和定量下限(IQL)Table 1 Regression equations,correlation coefficients(r),instrument detection limits and quantitation limits of 15 PAHs
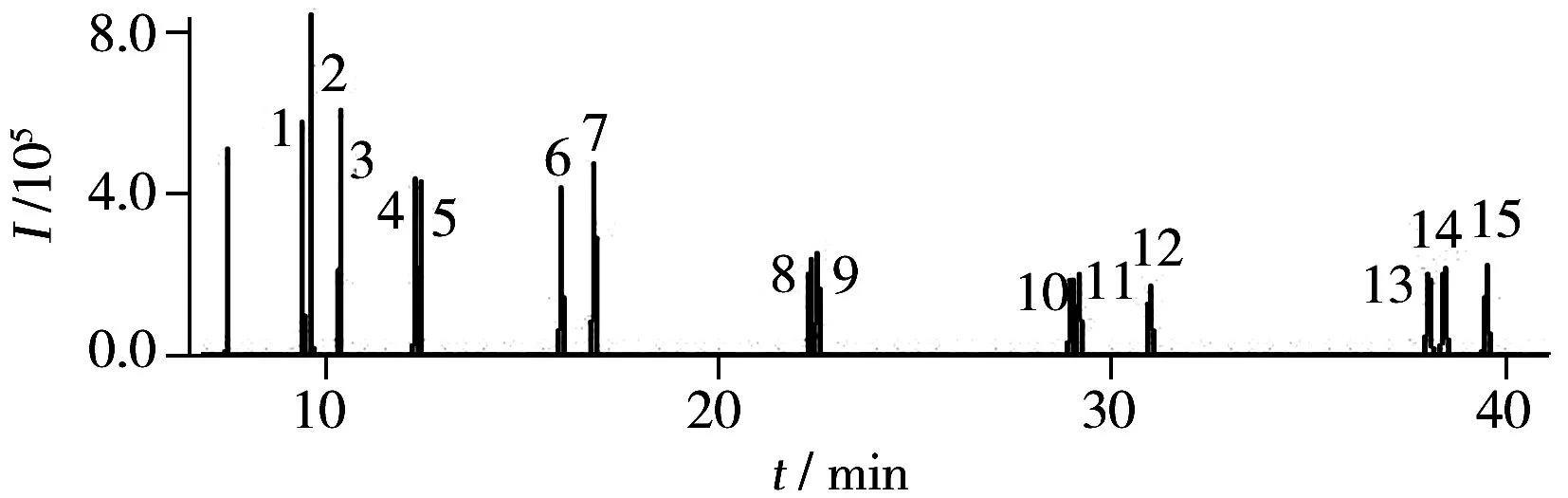
图1 标准溶液中15种PAHs的总离子流色谱图Fig.1 Total ion chromatogram of 16 PAHs standard solution the number(1-15) denoted was the same as that in Table 1
2.3精密度与准确度
在玻璃纤维滤纸中加入25 μL PAHs标准溶液(1 μg/mL)作为空白加标样品,按照本方法平行测定3次,计算目标物浓度平均值、回收率和相对标准偏差(RSD)(表2)。结果表明,标样溶液的加标回收率为82.2%~130%,RSD均为0.58%~11%。
使用植物叶片基质加标样品进行精密度和准确度实验,更能反映方法的性能。以实际树种紫叶李(Prunuscerasifera)叶片样品作为空白,叶片样品中加入250 μL PAHs标准溶液(1 μg/mL)作为叶片加标样品,按照本方法平行测定3次,结果见表2。结果表明,各化合物的加标回收率为46.7%~132%,RSD为2.4%~15%。与空白加标实验相比,叶片基质加标样品中PAHs的回收率范围变大,相对标准偏差较大。这些差异主要是因为低环PAHs属于易挥发的环境有机污染物,尤其是苊烯、苊、芴、菲、荧蒽以及芘在空白样品中均有检出,存在着不确定性。此外,实验发现叶片基质对分析物的基质效应既有增强,也有抑制。但所得结果与针对其他介质中PAHs的研究相近[10,16-17],在环境痕量分析可接受范围内[18]。
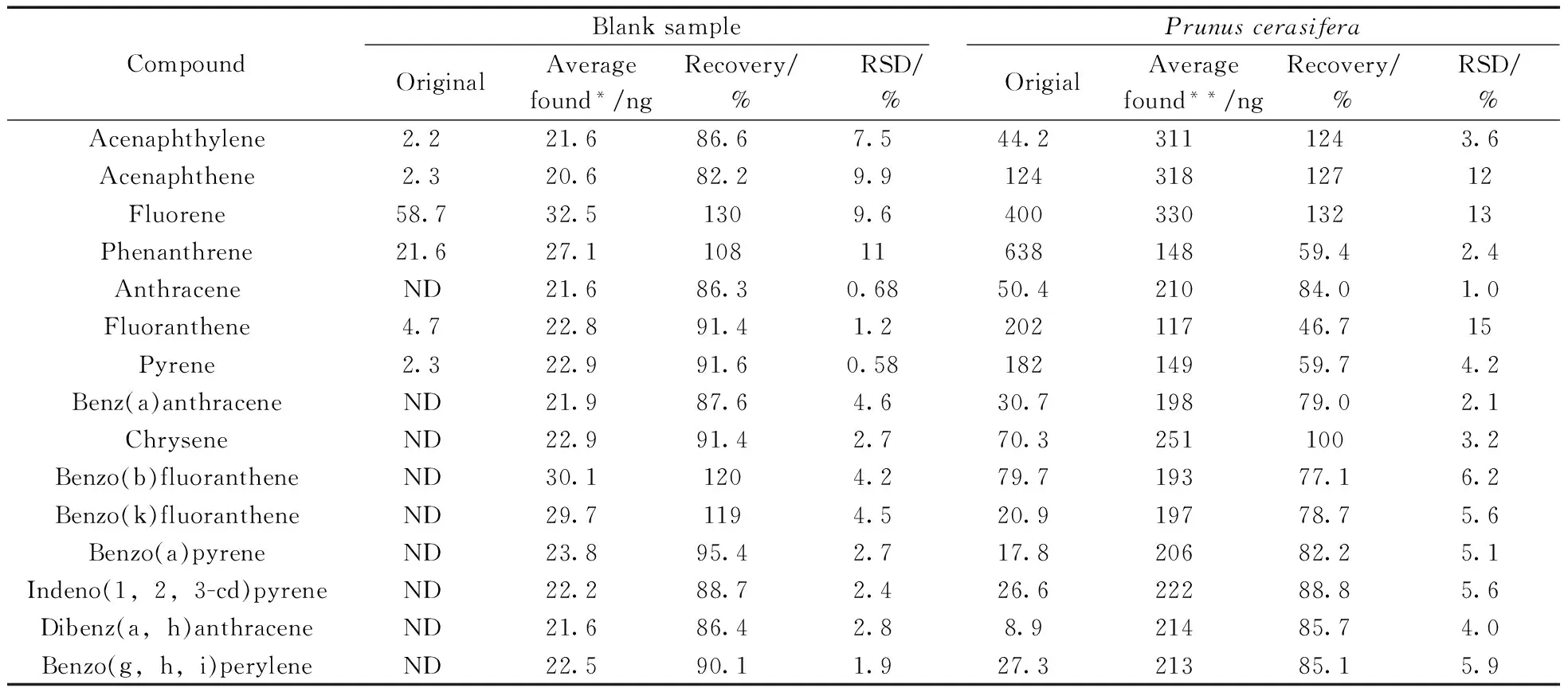
表2 空白及叶片样品中15种PAHs的加标回收率及相对标准偏差(n=3)Table 2 Recoveries and RSDs of 15 PAHs in blank and leaf samples(n=3)
*to deduct the value of the blank(为扣除空白的值),**to deduct the content of PAHs in plant leaves(为扣除植物叶片中PAHs的含量)
2.4方法检出限与定量下限
在5 g石英砂中加入5 μL PAHs标准溶液(1 μg/mL),共6份平行加标样品,按照本文前处理过程进行分析,获得6个平行样品中PAHs浓度,计算其标准偏差(SD),查找t值,并计算方法检出限MDL=t×SD,方法定量下限MQL=4 MDL,结果见表3。结果表明,方法检出限(MDL)和定量下限(MQL)分别为0.025 1~5.80 ng/g和0.101~23.2 ng/g。由于低环PAHs的背景较高,所以方法检出限偏高。
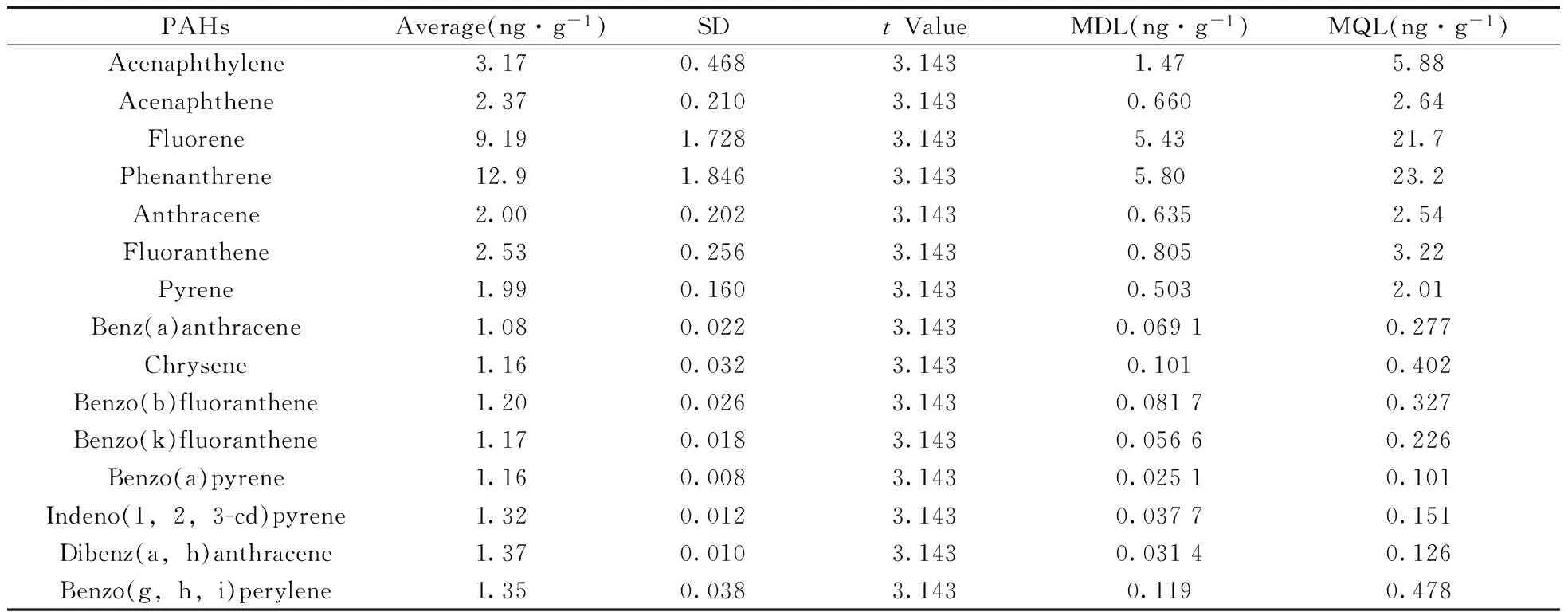
表3 15种PAHs的方法检出限及定量下限Table 3 The method detection limits and quantitation limits for 15 PAHs
2.5实际样品检测
采用本方法对采自北京市西直门北大街的圆柏(Sabinachinensis)、紫叶李(Prunuscerasifera)、油松(Pinustabuliformis)和毛白杨(Populustomentosa) 4种植物叶片样品中的15种多环芳烃进行检测。准确称取5 g植物叶片样品(干样品),按照上述优化方法进行前处理,上机测定,结果见表4。15种PAHs的总含量为 509.58~1 476.54 ng/g,其中4种树种叶片中总PAHs的含量依次为圆柏>紫叶李>油松>毛白杨,这可能与植物叶面结构[19]和叶脂含量[12]有关。
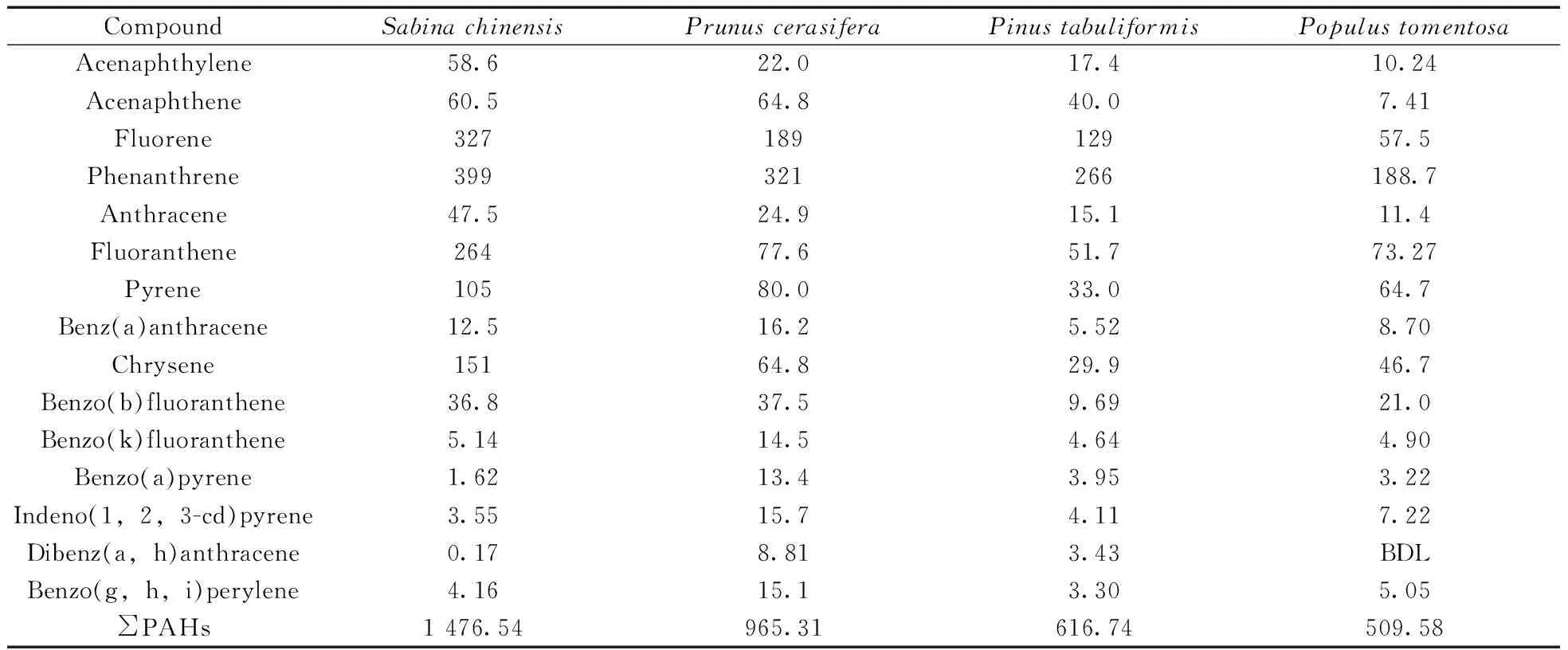
表4 实际样品中PAHs含量的测定结果(ng/g,干样品)Table 4 Determination results of PAHs(ng/g,dry sample) in different tree species leaves
BDL:below detection limit
3 结 论
本文建立了植物叶片样品中痕量多环芳烃的测定方法。该方法可有效去除杂质,定量准确,适用于常见树种叶片样品中15种PAHs的测定,为今后大批植物树种叶片中PAHs的测定提供了参考,具有一定的应用价值。
[1]Kim K H,Jahan S A,Kabir E,Brown R J C.Environ.Int.,2013,60:71-80.
[2]Yan B Z,Bopp R F,Abrajano T A,Damon C,Chillrud S N.Environ.Toxicol.Chem.,2014,33(5):985-992.
[3]Desalme D,Binet P,Chiapusio G.Environ.Sci.Technol.,2013,47(9):3967-3981.
[4]Mclachlan M S.Environ.Sci.Technol.,1999,33(11):1799-1804.
[5]Collins C,Fryer M,Grosso A.Environ.Sci.Technol.,2006,40(1):45-52.
[6]Barber J L,Thomas G O,Kerstiens G,Jones K C.Environ.Pollut.,2004,128(1/2):99-138.
[7]Deng X Y,Zhang D H,Li X G.Chin.J.Anal.Lab.(邓晓燕,张大海,李先国.分析试验室),2015,34(5):525-528.
[8]Wang D W,Zhao S M,Jin W,Shen Q Y,Hu P,Huang B,Pan X J.Chin.J.Anal.Chem.(王道玮,赵世民,金伟,沈秋莹,胡平,黄斌,潘学军.分析化学),2013,41(6):861-868.
[9]Liu B X,Zhao H S,Wang X J,Shen X E,Zhang D W,Shi A J.J.Chin.MassSpectrom.Soc.(刘保献,赵红帅,王小菊,沈秀娥,张大伟,石爱军.质谱学报),2015,36(4):372-379.
[10]Ai L F,Li W,Wang J,Ma Y S,Chen R C,Guo C H.J.Instrum.Anal.(艾连峰,李玮,王敬,马育松,陈瑞春,郭春海.分析测试学报),2015,34(5):570-575.
[11]Wang Y Q,Zuo Q,Jiao X C,Wu S P,Tao S.Environ.Sci.(王雅琴,左谦,焦杏春,吴水平,陶澍.环境科学),2004,25(4):23-27.
[12]Tian X X,Zhou G Y,Peng P A.Environ.Sci.(田晓雪,周国逸,彭平安.环境科学),2008,29(4):849-854.
[13]An H L,Liu Q Q,Cao X H,Zhang G,Wang H,Liu C,Guo H H,Xia X L,Yin W L.J.BeijingForestryUniv.(安海龙,刘庆倩,曹学慧,张罡,王慧,刘超,郭慧红,夏新莉,尹伟伦.北京林业大学学报),2016,38(1):50-58.
[14]Xu P J,Zhang T,Ren Y,Qi L,Yang W L,Huang Y R.J.Instrum.Anal.(许鹏军,张烃,任玥,齐丽,杨文龙,黄业茹.分析测试学报),2012,31(9):1126-1131.
[15]Wang J H,Guo C,Pang G F,Zhang Y B.J.Instrum.Anal.(王建华,郭翠,庞国芳,张艺兵.分析测试学报),2009,28(3):267-271.
[16]Sun R X,Ke C L,Lin Q,Shi F Q.J.Instrum.Anal.(孙闰霞,柯常亮,林钦,石凤琼.分析测试学报),2013,32(1):57-63.
[17]Wang C Y,Chu N Q,Xie T T,Mai J C,Li L X.J.Instrum.Anal.(王成云,褚乃清,谢堂堂,麦家超,李丽霞.分析测试学报),2013,32(12):1453-1459.
[18]HJ 646-2013.Ambient Air and Stationary Source Emissions-Determination of Gas and Particle-Phase Polycyclic Aromatic Hydrocarbons with Gas Chromatography/Mass Spectrometry.National Environmental Protection Standard of People's Republic of China(环境空气和废气—气相和颗粒物中多环芳烃的测定—气相色谱质谱法.中华人民共和国国家环境保护标准).
[19]Peng G,Tian D L,Yan W D,Zhu F,Liang X C.ActaEcol.Sin.(彭钢,田大伦,闫文德,朱凡,梁小翠.生态学报),2010,30(14):3700-3706.
Determination of Polycyclic Aromatic Hydrocarbons(PAHs) in Plant Leaf Samples by Silica Gel Column and Gel Column Purification/Gas Chromatography-Mass Spectrometry
BAO Fen-qiang1,AN Hai-long2,HUI Ya-mei3,ZHANG Xiang-xue1*,XIA Xin-li2*
(1.College of Sciences,Beijing Forestry University,Beijing100083,China;2.National Engineering Laboratory for Tree Breeding,Beijing Forestry University,Beijing100083,China;3.CSD IDEA(Beijng) Environmental Test and Analysis Co.,Ltd.,Beijing100192,China)
A method was developed for the analysis of polycyclic aromatic hydrocarbons(PAHs) in plant leaves by gas chromatography-mass spectrometry(GC-MS) based on silica gel column and gel permeation chromatography(GPC) purification.The target analytes in leaf samples were extracted with dichloromethane-hexane(1∶1,by volume) solution,purified with silica gel column and GPC column,analyzed by GC-MS,and then quantified by the internal standard method.The average recoveries of 15 PAHs were in the range of 82.2%-130% with relative standard deviations(RSD) not more than 11%.The detection limit(LOD) of this method varied from 0.025 1 ng·g-1to 5.80 ng·g-1.This method could effectively remove the pigment and oil in the plant leaves,suitable for the trace analysis of PAHs in leaf samples,and providing a technical support for the determination of content of PAHs in the plant tissues.
soxhlet extraction;silica gel column;gel permeation chromatography(GPC);polycyclic aromatic hydrocarbons(PAHs);gas chromatography-mass spectrometry(GC-MS);plant
2016-02-16;
2016-03-21
林业公益性行业科研专项(201304301)
张祥雪,教授,研究方向:生物物理,Tel:010-62338136,E-mail:zxx@bjfu.edu.cn
夏新莉,教授,研究方向:植物抗逆生理学,Tel:010-62336400,E-mail:xiaxl@bjfu.edu.cn
10.3969/j.issn.1004-4957.2016.09.021
O657.63;O625.15
A
1004-4957(2016)09-1185-06

