产脂肪酶极端丝状真菌的筛选及其酶学特性
金 鹏,党爱丽,雷湘南,Suren Singh,刘晓光,*,王正祥,路福平,*
(1.天津科技大学化工与材料学院,天津 300457;2.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457;3.南非德班理工大学应用科学学院,德班 4001)
产脂肪酶极端丝状真菌的筛选及其酶学特性
金鹏1,2,党爱丽2,雷湘南2,Suren Singh3,刘晓光1,2,*,王正祥1,2,路福平2,*
(1.天津科技大学化工与材料学院,天津 300457;2.天津科技大学生物工程学院,工业发酵微生物教育部重点实验室,天津 300457;3.南非德班理工大学应用科学学院,德班 4001)
从南非德班市及其周边地区采集的76个土样中筛选得到99株嗜碱丝状真菌和51株嗜热丝状真菌,利用橄榄油乳化法以及对硝基苯酚法筛选得到三株具有底物专一性的菌株F4-173、F4-262、F8-67,经ITS分子生物学鉴定方法分别鉴定为Aspergillusfumigatus、Penicilliumverrucosum、Penicilliumchrysogenum。其中,AspergillusfumigatesF4-173可专一性分解菜籽油,其最适作用条件40 ℃、pH8.0,PenicilliumverrucosumF4-262可专一性分解对硝基苯酚月桂酸酯,其最适作用条件为40 ℃、pH8.0,PenicilliumchrysogenumF8-67可专一性分解大豆油,其酶液最适作用条件为50 ℃、pH6.5。
脂肪酶,耐热,耐碱,底物专一性,酶学特征
脂肪酶(Lipase,EC 3.1.1.3)是一种酯键水解酶,能在油水界面上催化酯水解或醇解、酯合成、酯交换等有机合成反应[1]。因其来源丰富、稳定性好、种类繁多、可改造性强等被广泛应用[2]。尤其微生物来源的脂肪酶具有选择性、稳定性、底物特异性、功能多样性等特点,在洗涤剂、食品与饲料等工业生产及商业应用方面显示出巨大的潜能[3-4]。其中碱性脂肪酶的添加可降低洗涤用品对环境的污染而使其备受关注。国外报道的碱性脂肪酶产生菌主要有假单胞菌[5]、芽孢杆菌[6-7]、无色杆菌[8]、不动杆菌[9]、毛霉[10]、圆弧青霉[11]、假丝酵母[12]等。由于许多工业用酶的催化反应过程要求耐受较高的温度,因此可在高温环境中筛选在高温下有活性且热稳定性好的脂肪酶产生菌。
Jiao-Jiao Shangguan[13]测得在大肠杆菌中表达的Aspergillusfumigatus脂肪酶基因对短链酯尤其是对硝基苯酚乙酸酯的分解能力较强。Kamariah Long[14]测定了四种曲霉属菌种在非水相中对植物油的分解能力,从而确定了这四株菌的底物专一性。都是根据一种酶只能对一种底物或一类底物起催化作用,对其他底物无催化作用的底物专一性特点来实现对相应产酶菌株的筛选。
本研究以前期筛选自南非德班市的耐热、耐碱丝状真菌为基础,分别采用橄榄油乳化法和对硝基苯酚法筛选具有底物专一性的脂肪酶的产生菌,进一步通过酶学特征的分析,获得耐热、耐碱的脂肪酶。这将有利于发掘酶学特性优良的新型脂肪酶,为脂肪酶的工业化应用提供更多的候选资源和研究基础。
1 材料与方法
1.1材料与仪器
丝状真菌的分离物筛选自南非德班市及其周边地区,由本实验室和南非德班理工大学合作团队实验室共同保藏;聚乙烯醇、橄榄油国药集团化学试剂有限公司;菜籽油、花生油、大豆油市售油脂;对硝基苯酚索莱宝生物科技有限公司;对硝基苯酚丁酸酯(C4)、对硝基苯酚癸酸酯(C8)、对硝基苯酚月桂酸酯(C12)以及对硝基苯酚棕榈酸酯(C16)Sigma公司,分析纯;其它普通生化试剂国产分析纯;种子培养基(g/L)土豆200 g,蔗糖20 g;发酵培养基(g/L)豆粕粉30 g,可溶性淀粉10 g,橄榄油10 g,硫酸铵1 g,磷酸氢二钾2 g,硫酸镁0.1 g。
多功能酶标仪瑞士TUCAN公司;紫外分光光度计北京普析通用仪器有限责任公司;Axiostar plus光学显微镜德国Zeiss公司;PTC-200PCR仪美国MJ公司;HB-100恒温金属浴杭州博日科技有限公司;琼脂糖凝胶水平电泳系统北京六一仪器有限公司;凝胶成像仪美国SYNGENE;ZHWY211B控温摇床上海志诚设备厂。
1.2实验方法
1.2.1脂肪酶酶活的测定分别将前期筛选得到的99株嗜碱丝状真菌和51株嗜热丝状真菌由培养斜面接种到含有50 mL种子培养基的250 mL三角瓶中,于34 ℃和50 ℃及200 r/min条件下培养48 h,制成液体菌种,然后按2%的接种量转接到含有50 mL发酵培养基的250 mL三角瓶中,在34 ℃和50 ℃及200 r/min下进行发酵实验,每24 h取样测定发酵液中脂肪酶的活力。
1.2.1.1橄榄油乳化法测定脂肪酶活力按照中华人民共和国国家标准(GB/T 23535-2009)进行。在测定条件下,1 mL固体酶粉(或1 mL液体酶),1 min水解底物产生1 μmol的可滴定的脂肪酸,即为1个酶活力单位,以U/g(U/mL)表示。
取99株嗜碱丝状真菌34 ℃、200 r/min摇瓶培养96 h的发酵液和51株嗜热丝状真菌50 ℃、200 r/min摇瓶培养96 h的发酵液作为粗酶液,以橄榄油、菜籽油、花生油、大豆油四种油脂的乳化液为测定底物。
1.2.1.2对硝基苯酚法测定脂肪酶活力按照Thomas Vorderwullbecke对硝基苯酚法的改进方法进行测定[15],在测定条件下,1 mL固体酶粉(或1 mL液体酶),1 min释放出1 μmol对硝基苯酚,即为1个酶活力单位(U)。
取99株嗜碱丝状真菌34 ℃、200 r/min摇瓶培养96 h的发酵液和51株嗜热丝状真菌50 ℃、200 r/min摇瓶培养96 h的发酵液作为粗酶液测定脂肪酶活力,测定底物分别为对硝基苯酚丁酸酯、对硝基苯酚辛酸酯、对硝基苯酚月桂酸酯、对硝基苯酚棕榈酸酯。
1.2.2具有底物专一性的脂肪酶的筛选分别选取橄榄油和三种天然油脂(菜籽油、大豆油、花生油)的乳化液作为底物,按照1.2.1.1方法进行酶活力测定。选取4种对硝基苯酚类酯:对硝基苯酚丁酸酯(C4)、对硝基苯酚癸酸酯(C8)、对硝基苯酚月桂酸酯(C12)、对硝基苯酚棕榈酸酯(C16)作为底物,按照方法1.2.1.2测定脂肪酶酶活力。筛选具有底物专一性的脂肪酶。其中乳化液为4%聚乙烯醇溶液与油脂以3∶1(v/v)高速匀浆后的混合物。
1.2.3菌种鉴定
1.2.3.1形态学鉴定菌种经过一段时间培养后,观察菌落的生长状态,如菌落直径、菌落颜色、菌落质地、渗出液和反面颜色等,再通过挑取菌丝体做显微形态观察切片,于普通光学显微镜下观察,记录菌种的显微形态。
1.2.3.2ITS分子生物学快速鉴定分离物的鉴定采用分子鉴定法,方法按文献[16]进行,所得到的ITS序列经NCBI-BLAST(http://blast.ncbi.nlm.nih.gov/Blast.cgi)同源性比对,构建进化树,最终确定上述筛选到的菌株F4-173为Aspergillusfumigatus,F4-262为Penicilliumverrucosum,F8-67为Penicilliumchrysogenum。
1.2.4酶学特性
1.2.4.1最适作用温度根据1.2.2的实验结果确定最佳底物,在不同温度条件下(嗜热丝状真菌来源的脂肪酶的测定温度为30、40、45、50、55、60和70 ℃;嗜碱丝状真菌来源的脂肪酶的测定温度为20、30、35、40、45、50和60 ℃),分别按照1.2.1.1和1.2.1.2的方法,菌株AspergillusfumigatusF4-173、PenicilliumverrucosumF4-262和PenicilliumchrysogenumF8-67的发酵液作为粗酶液,在不同温度下对其酶活进行测定,最大的酶活作为100%,其他的实际酶活除以最大酶活的百分数为相对酶活,并绘制温度-相对酶活曲线。
1.2.4.2最适作用pH分别以菌株AspergillusfumigatusF4-173、PenicilliumverrucosumF4-262和PenicilliumchrysogenumF8-67的发酵液作为粗酶液,在不同pH条件下(嗜热丝状真菌来源的脂肪酶的测定pH为5.0、6.0、6.5、7.0、7.5、8.0和9.0;嗜碱丝状真菌来源的脂肪酶的测定pH为6.0、7.0、7.5、8.0、8.5、9.0和10.0),pH调节所用的缓冲液为磷酸氢二钠-磷酸二氢钾(pH5.0~9.0)和甘氨酸-氢氧化钠(pH10.0)缓冲液。按照方法1.2.1.1、1.2.1.2测定脂肪酶活力,并绘制pH-相对酶活曲线。
1.2.4.3金属离子对脂肪酶活性的影响分别以菌株AspergillusfumigatusF4-173、PenicilliumverrucosumF4-262和PenicilliumchrysogenumF8-67的发酵液作为粗酶液,分别在反应体系中添加1 mmol/L的金属离子Fe2+、Ca2+、K+、Zn2+、Mg2+、Na+和Cu2+,按照1.2.1.1、1.2.1.2方法测定脂肪酶活力,研究其对脂肪酶活力的影响。
1.3数据处理
本文测得的ITS序列通过NCBI网站比对,通过MEGA 6.06 构建系统进化树,相关实验均设置三个平行实验,数据分析借助Origin 8.0软件处理完成,统计分析采用F检验法进行。
2 结果与分析
2.1产脂肪酶菌株的筛选及其底物专一性的测定
2.1.1橄榄油乳化法测定不同来源的脂肪酶的底物专一性根据1.2.1.1所示方法测定粗酶液的脂肪酶酶活力,部分测定结果如表1所示。

表1 采用橄榄油乳化法测定不同丝状
由表1可知,F4-173可专一性分解菜籽油,菌株F8-67可专一性分解大豆油。其生长状况如图1所示,F4-173在PDA平板上培养,菌丝的颜色有绿色,分生孢子梗直立,顶端球形膨大,分生孢子串生于小梗顶端,辐射状排列,单个的孢子球形,可初步鉴定为曲霉[17]。F8-67在PDA平板上培养,会产生大量的蓝绿色孢子,在显微镜下,无明显的特征,因此根据菌落形态可初步判定为青霉[18]。

图1 F4-173和F8-67菌落形态和显微结构Fig.1 Colony morphology and microstructure of the F4-173 and F8-67
2.1.2对硝基苯酚法测定不同来源的脂肪酶的底物专一性根据1.2.1.2所示方法测定粗酶液的脂肪酶酶活力,部分测定结果如表2所示。

表2 对硝基苯酚法测定不同丝状真菌来源的
由表2可知,F4-262可专一性分解对硝基苯酚月桂酸酯,其生长状况如图2所示,F4-262在PDA平板上培养,会产生大量的蓝绿色孢子,根据生长状况以及显微镜下观察菌丝、菌落形态可初步判定为青霉[18]。

图2 F4-262菌落形态和显微结构Fig.2 Colony morphology and microstructure of the F4-262
按照方法1.2.3.2,扩增菌株的ITS序列,在NCBI-BLAST网站进行同源性比对,利用MEGA 6.06构建菌株的ITS基因系统进化树。结果表明,F4-173为Aspergillusfumigatus,F4-262为Penicilliumverrucosum,F8-67鉴定为Penicilliumchrysogenum。由图3可见,Aspergillusfumigatus与Penicilliumverrucosum、P.chrysogenum虽然属于不同的属,但是遗传距离相对较近。
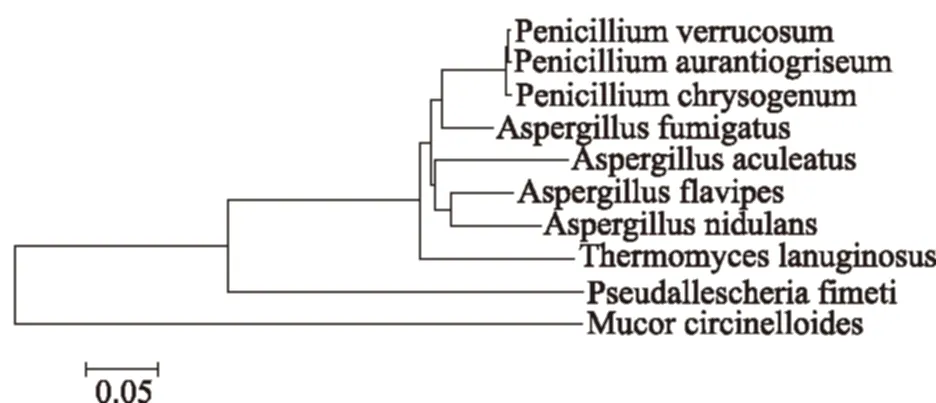
图3 菌株Aspergillus fumigatus、Penicillium verrucosum、P. chrysogenum的进化树Fig.3 Phylogenetic tree of Aspergillus fumigatus,Penicillium verrucosum,P. chrysogenum
相对于报道比较多的细菌和酵母来说,除了产脂肪酶的耐热丝状真菌中疏棉状嗜热丝孢菌的研究较多[17-18]以外,具有专一性分解某类底物的产耐碱、耐热脂肪酶丝状真菌的报道较少。Paola Panizza[19]筛选得到Pseudomonassp.突变体,可专一性分解长链(C18)底物,Karel Stransky[20]测得Geotrichumsp.只对甘油三酯的sn-1(或sn-3)有特殊的水解能力,Matheus HM Avelar[21]从蓖麻子的种子中筛选得到可以催化分解植物油的脂肪酶,其对菜籽油的分解能力可达(96.1±2.3) U/g。由于菜籽油中含有的胆固醇很少或几乎不含,适合于需控制胆固醇摄入量的人食用,但菜籽油中介酸含量较高,关于其是否会引起心肌脂肪陈菊和心脏受损暂时还存在很大争议,本研究中PenicilliumverrucosumF4-173可专一性分解菜籽油,降低人们关于菜籽油食用的疑虑。
2.3酶学特征初步分析
2.3.1酶的最适作用温度在pH=7.5测定不同温度对AspergillusfumigatusF4-173,PenicilliumverrucosumF4-262和PenicilliumchrysogenumF8-67的酶液的影响。
结果如图4所示,在一定的温度范围内,随着温度的升高,酶活力不断升高,达到最适作用温度后,酶活力随着温度的升高不断减小。在50 ℃时,嗜热丝状真菌LichtheimiaramosaF8-67的酶液的酶活力最高,随着温度的升高或降低,酶活力快速下降,在30 ℃和70 ℃时,相对酶活力降为不足10%;嗜碱丝状真菌AspergillusfumigatusF4-173和PenicilliumverrucosumF4-262酶液的最适作用温度均为40 ℃,随着温度的升高,酶活力均快速下降,但温度降低至35 ℃时,其酶活力仍能保持在70%以上。

图4 温度对不同来源脂肪酶活力的影响Fig.4 Effects of temperature on the activity of lipases from different fungi
2.3.2最适作用pH在40 ℃条件下,测定不同的pH对嗜碱丝状真菌AspergillusfumigatusF4-173和PenicilliumverrucosumF4-262酶液的影响,在50 ℃条件下,测定不同的pH对嗜热丝状真菌PenicilliumchrysogenumF8-67的酶液的影响,结果如图5所示。

图5 pH对不同来源的脂肪酶活力的影响Fig.5 Effects of pH on the activity of lipases from different fungi
由图5可知,随着pH的增加,酶活力在不断增加,达到酶的最适作用pH后,酶活力的大小随着pH的增加而不断减小,PenicilliumchrysogenumF8-67酶液的最适作用pH为6.5,在pH6.5周围,酶活力变化较快,AspergillusfumigatusF4-173和PenicilliumverrucosumF4-262在pH8.0的条件下酶活力最高,在pH6.5~9.0范围内测定脂肪酶酶活力,酶活力仍能达到60%以上。
2.4.3金属离子对酶活力的影响在40 ℃、pH8.0条件下,测定终浓度为10 mmol/L的金属离子对嗜碱丝状真菌AspergillusfumigatusF4-173和PenicilliumverrucosumF4-262酶液的影响,在50 ℃、pH6.5条件下,测定测定终浓度为10 mmol/L的金属离子对嗜热丝状真菌PenicilliumchrysogenumF8-67的酶液的影响。
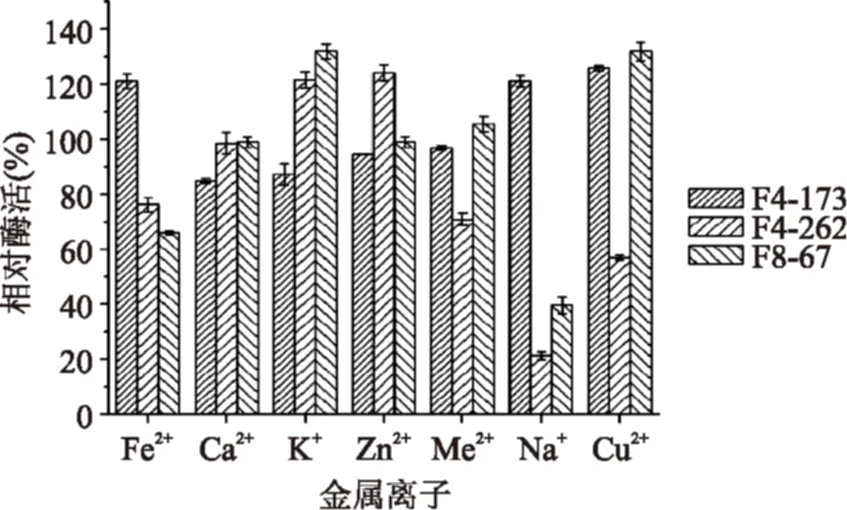
图6 不同金属离子对酶活力的影响Fig.6 The influence of metal ions on the activity of lipases from different fungi
结果如图6所示,有些金属离子能增强酶活力,如K+、Cu2+对PenicilliumchrysogenumF8-67来源的脂肪酶的活力有促进作用,Fe2+、Cu2+对AspergillusfumigatusF4-173产生的脂肪酶的酶活有增强作用,K+、Zn2+对菌株PenicilliumverrucosumF4-262产生的脂肪酶有增强作用;有些金属离子对酶的活力有抑制作用,如Na+对PenicilliumchrysogenumF8-67产生的脂肪酶酶活有抑制作用,K+、Ca2+对菌株AspergillusfumigatusF4-173来源脂肪酶的酶活有抑制作用,如Na+对菌株PenicilliumverrucosumF4-262来源脂肪酶的酶活有抑制作用。
3 结论
本研究获得3株菌在极端环境下生长良好,Aspergillusfumigatus所产脂肪酶可专一性分解菜籽油,其最适作用条件是40 ℃、pH8.0,Penicilliumverrucosum可专一性分解对硝基苯酚月桂酸酯,其最适作用条件为40 ℃、pH8.0,Penicilliumchrysogenum可专一性分解大豆油,其酶液最适作用条件为50 ℃、pH6.5。
此3株产脂肪酶的丝状真菌的报道较少。它们发酵产生的粗酶液可在耐热、耐碱环境下分解底物,对进一步的菌种改造、操作方便、降低成本起到了非常重要的作用。本研究中对这3株菌产酶酶学特性的初步分析,为丝状真菌来源的脂肪酶开发提供了研究基础。
[1]Abhishek Kumar Singh,Mausumi Mukhopadhyay. Overview of Fungal Lipase:A Review[J]. Applied Biochemistry and Biotechnology,2012,166:486-520.
[2]汪小锋,王俊,杨江科,等. 微生物发酵生产脂肪酶的研究进展[J]. 生物技术通报,2008(4):47-53.
[3]Chung Hong Tan,Pau Loke Show,Chien Wei Ooi. Novel lipase purification methods-a review of the latest developments[J]. Biotechnology Journal,2015,1(10):31-44.
[4]Jing Su,Fengli Zhang,Wei Sun,et al. A new alkaline lipase obtained from the metagenome of marine spongeIrciniasp.[J]. World Journal of Microbiology and Biotechnology,2015,31:1093-1102.
[5]Badgujar KC,Pai PA,Bhanage BM. Enhanced biocatalytic activity of immobilizedPseudomo-nascepacialipase under sonicated condition[J]. Bioprocess and Biosystems Engineering,2016,39(2):211-221..
[6]Goomber S,Kumar A,Singh R. Point mutation Ile137-Met near surface conferred psychrophi-lic behaviour and improved catalytic efficiency toBacilluslipase of 1.4 subfamily[J]. Applied Biochemistry and Biotechnology,2016,178(4):753-765
[7]Khurana J,Kumar R,Kumar A,et al. New insight into oldBacilluslipase:solvent stable mesophilic lipase demonstrating enzyme activity towards cold[J]. Molecular Microbiology and Biotechnology,2015,25(5):340-348.
[8]Toshifumi Miyazawa,Tomoyuki Yukawa,Takashi Koshiba,et al. Enzymatic resolution of 2-phenoxy-1-propanols through the enantioselective acylation mediated byAchromobactersp. lipase[J]. Biotechnology Letters,2001,10(23):1547-1550.
[9]Wang H,Zhong S,Ma H,et al. Screening and characterization of a novel alkaline lipase from Acinetobacter calcoaceticus 1-7 Isolated from bohai bay in china for detergent formulation[J]. Brazilian journal of microbiology,2012,43(1):148-156.
[10]Canilho N,Jacoby J,Pasc A,et al. Isocyanate-mediated covalent immobilization ofMucor-mieheilipase onto SBA-15 for transesterification reaction[J]. Colloids and Surfaces B:Biointerfaces,2013,112:139-145.
[11]Zhongbiao Tan,Jianfang Li,Minchen Wu,et al. Enhancing the thermostability of a cold-active lipase fromPenicilliumcyclopiumby in silico design of a disulfide bridge[J]. Applied Biochemistry and Biotechnology,2014,173:1752-1764.
[12]Wikmark Y,Engelmark Cassimjee K,Lihammar R. Removing the active site flap in Lipase A fromCandidaantarcticaproduces a functional enzyme without interfacial activation[J]. Chembiochem,2015,[Epub ahead of print].
[13]Jiaojiao Shangguan,Yuqiang Liu,Fujun Wang,et al. Expression and characterization of a novel lipasefrom Aspergillus fumigatus with high specific activity [J]. Applied Biochemistry and Biotechnology,2011,165:949-962.
[14]Kamariah L,Huda H N,Azlina M D,et al. Substrate specificity of lipases from four species of Aspergillus towards hydrolysis of homoacid triacylglycerols and vegetable oils in non-aqueous system[J]. Journal of tropical agriculture and food science,2006,34(1):103-109.
[15]江慧芳,王雅琴,刘春国. 三种脂肪酶活力测定方法的比较与改进[J]. 化学与生物工程,2007,24(8):72-75.
[16]陈源源,陈浩,石贵阳,等. ITS序列在酵母批量分子鉴定中的适用性[J]. 食品与发酵工业,2012,38(4):11-14.
[17]Madsen JK,S rensen TR,Kaspersen JD,et al. Promoting protein self-association in non-glycosylatedThermomyceslanuginosuslipase based on crystal lattice contacts [J]. Biochimica et Biophysica Acta,2015,12:1914-1921.
[18]Avila-Cisneros N,Velasco-Lozano S,Huerta-Ochoa S,et al. Production ofthermostablelipaseby Thermomyces lanuginosus on solid-state fermentation:selective hydrolysis of sardine oil [J]. Applied Biochemistry and Biotechnology,2014,11(5):1859-1872.
[19]Panizza P,Cesarini S,Diaz P,et al. Saturation mutagenesis in selected amino acids to shift Pseudomonas sp. acidic lipase Lip I. 3 substrate specificity and activity[J]. Chemical Communications,2015,51(7):1330-1333.
[20]Stránsky K,Zarevúcka M,Kejík Z,et al. Substrate specificity,regioselectivity and hydrolytic activity of lipases activated from Geotrichum sp.[J]. Biochemical Engineering Journal,2007,34(3):209-216.
[21]Avelar M H M,Cassimiro D M J,Santos K C,et al. Hydrolysis of vegetable oils catalyzed by lipase extract powder from dormant castor bean seeds[J]. Industrial Crops and Products,2013,44:452-458.
Isolation and preliminary characterization of lipases from fungi in extreme environments
JIN Peng1,2,DANG Ai-li2,LEI Xiang-nan2,Suren Singh3,LIU Xiao-guang1,2,*,WANG Zheng-xiang1,2,LU Fu-ping2,*
(1.College of Chemical Engineering and Materials Science,Tianjin University of Science and Technology,Tianjin 300457,China;2.Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;3.Department of Biotechnology & Food Technology,Faculty of Applied Sciences,Durban University of Technology,Durban 4001,South Africa)
From 76 soil samples,collected in South Africa,99 basophilic filamentous fungi strains and 51 thermophilic filamentous fungi strains were screened. Two measuring methods,including olive oil emulsification and p-NPP,had been used to test the activity of lipase and three filamentous fungi strains had been selected for hydrolyzing special substrate. They were F4-173,F4-262 and F8-67,identified asAspergillusfumigatus,Penicilliumverrucosum,Penicilliumchrysogenumby the method of ITS,respectively. The result showed that the strain F4-173 could hydrolyze canola oil and its optimal temperature and pH were 40 ℃ and 8.0,the strain F4-262 could hydrolyze p-nrophenyl laurate and the optimal temperature and pH of the enzyme were 40 ℃ and 8.0,the strain F8-67 could only hydrolyze soybean oil and its optimal temperature and pH value for lipase activity were 50 ℃ and 6.5 respectively.
lipase;heat-resistance;alkali-resistance;substrate specificity;enzymatic characteristics
2016-02-22
金鹏(1976-),女,副教授,研究方向:工业酶制剂与工业微生物,E-mail:jinpeng@tust.edu.cn。
刘晓光(1963-),男,教授,研究方向:丝状真菌,E-mail:liu_xg@tust.edu.cn。
路福平(1967-),男,教授,研究方向:应用微生物与酶工程,E-mail:lfp@tust.edu.cn。
国家自然科学基金国际(地区)合作与交流项目(31461143026);天津市国际交流与合作项目(14RCGHSY00181)。
TS201.3
A
1002-0306(2016)18-0213-06
10.13386/j.issn1002-0306.2016.18.032

