钙离子与pH诱导鲤鱼卵肽纳米颗粒的形成
黄 海,李八方,曾名湧,*
(1.钦州学院食品工程学院,广西钦州 535011;2.广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535011;3.中国海洋大学食品科学与工程学院,山东青岛 266003)
钙离子与pH诱导鲤鱼卵肽纳米颗粒的形成
黄海1,2,李八方3,曾名湧3,*
(1.钦州学院食品工程学院,广西钦州 535011;2.广西北部湾特色海产品资源开发与高值化利用高校重点实验室,广西钦州 535011;3.中国海洋大学食品科学与工程学院,山东青岛 266003)
探讨钙离子和pH诱导鲤鱼卵肽(Carp egg peptide,CEP)形成纳米颗粒的条件及稳定纳米颗粒空间结构的作用力。通过浊度检测初步筛选CEP纳米颗粒形成条件,用粒径分析和电镜观察方法确认纳米颗粒的形成。通过次级键破坏实验分析稳定纳米颗粒空间结构的作用力,并通过红外光谱和圆二色谱分析CEP纳米颗粒形成后的空间结构变化。结果表明,当pH6.0~9.0时,CEP能与一定浓度的钙离子结合形成粒径20~100 nm的纳米颗粒,疏水作用和静电作用是稳定纳米颗粒的主要作用力,CEP形成纳米颗粒后伴随着β折叠的形成。CEP能够作为生物模板在温和条件下合成肽-钙纳米颗粒。
鲤鱼卵肽,纳米颗粒,空间结构改变
纳米颗粒是指纳米量级的微观颗粒,它被定义为至少在一个维度上小于100 nm的颗粒,具有高渗透性高和在人体肠道中的吸收率高的特点。有研究表明人体对物理方式纳米化的碳酸钙吸收效果显著高于普通碳酸钙[1]。因此纳米级矿物质将有望成为新型矿物质营养强化剂。目前纳米颗粒制备技术主要有粉碎和聚集两种。粉碎法指利用机械研磨、热分解、等离子蒸发、激光轰击等方法将大颗粒粉碎成纳米颗粒,需要精密复杂的设备,并且损耗大量的能量,成本较高。聚集法通过分子聚集成纳米颗粒,例如共沉淀、热液合成、表面活性剂介导合成等[2],然而由于残留化学试剂的毒性,许多聚集方法不适合营养强化剂的制备。近年来,受生物体生物矿化的启发,肽被用来作为生物模板在温和条件下合成金属纳米颗粒[3-4]。Zhang等在研究大豆分离蛋白时发现其能够与钙离子形成纳米颗粒[5],Wu等在研究鳀鱼肽铁复合物的结构时,观察到纳米颗粒的存在[6]。
鱼卵富含脂质、卵黄蛋白、矿物元素、维生素、类胡萝卜素等营养物质,但在常规的加工过程中,鱼卵往往被作为下脚料而废弃。水产加工副产物已经有大量的利用研究[7-8],而关于鱼卵的利用研究则较少。作者前期研究表明鲤鱼卵蛋白酶解物富含磷酸丝氨酸,具有较强的钙离子结合活性[9],通过酶解物制备的鲤鱼卵肽钙复合物具有促进体内钙吸收的活性[10-11]。本论文将对鲤鱼卵肽(carp egg peptide,CEP)在钙离子和pH诱导下形成纳米颗粒的条件、稳定纳米颗粒的作用力及其空间结构变化进行系统研究,揭示纳米颗粒形成的机制,为纳米型肽钙复合物类补钙制剂的开发提供理论依据。
1 材料与方法
1.1材料与仪器
鲤鱼卵购自山东美佳集团有限公司;D2O、DCl、NaODSigma公司;尿素、SDS上海生工;胰蛋白酶酶活190 kU/g,南宁庞博生物工程有限公司;实验所用其它试剂均为分析纯及以上。
JEM-1200EX透射电镜日本JEOL公司;MOS450/AF-CD圆二色谱仪法国Biologic公司;ZEN3600粒径分析仪英国Malvern公司;Nicolet iS10傅里叶变换红外光谱仪美国Thermo公司;UV-2550型紫外分光光度计日本岛津公司;BIO-RAD550酶标仪美国伯乐公司;PHS-3C型精密pH计上海雷磁仪器厂;DF-101S集热式恒温加热磁力搅拌器郑州长城科工贸有限公司;FDU-1200型 EYELA冷冻干燥机上海爱朗仪器有限公司;Millipore 超纯水系统美国Millipore仪器公司;GL-21M高速冷冻离心机湘仪离心机仪器有限公司;Laborata 4000旋转蒸发仪德国Heidolph公司。
1.2实验方法
1.2.1鲤鱼卵肽的制备按照Li等的方法略加改进[12]。鲤鱼卵脱脂后,先经0.1 mol/L NaOH处理2 h部分脱磷,然后用胰蛋白酶(温度49 ℃,加酶量3000 U/g,底物浓度2%,pH9.0)酶解12 h,于10000 r/min、4 ℃条件下离心20 min,将上清液过0.22 μm微孔滤膜。过滤后的酶解液缓慢注入到Chelex-100树脂层析柱中,控制流速3 mL/min,脱除酶解液中的金属离子。将收集的酶解液旋转蒸发浓缩后冷冻干燥即得鲤鱼卵肽(carp egg peptide,CEP)。
1.2.2浊度测定按照水质-浊度的测定(GB 13200-91)进行。浊度标准曲线如图1所示。配制0.5%,pH为6.0~9.0的CEP溶液,分别与2.5、5、7.5 mmol/L氯化钙反应,静置过夜,用同浓度的氯化钙水溶液为空白,于400 nm下测定吸光值,由标准曲线得出浊度。

图1 浊度标准曲线Fig.1 Standard curve of turbidity
1.2.3粒径分析将样品与氯化钙在一定条件下混合反应后,过0.22 μm滤膜,然后将样液注入DTS1060C样液池中,小心赶走气泡,置于粒径分析仪中检测,以此判断分散性(PDI)。测定参数设置为:光源He-Ne激光灯,波长633 nm,入射角173°,粘度1.0031,RI 1.330,(25±0.1) ℃,平衡时间60 s,每个样品扫描3次,取平均值。
1.2.4电镜分析将待测样液吸附在铜网上,自然风干5~10 min后用磷钨酸负染,自然风干后置于80 kV透射电镜上观察。
1.2.5稳定纳米颗粒作用力分析将形成纳米颗粒的CEP-Ca样液(0.5% CEP,pH7.0,5.0 mmol/L CaCl2)的pH分别调至2.0~9.0,静置过夜,测定溶液浊度;上述样液中加入尿素溶液,使尿素终浓度分别为0.25~2.00 mol/L,静置过夜,测定溶液浊度和电镜观察;上述样液中分别加入终浓度为0.01%十二烷基磺酸钠(SDS)溶液和2.5 mol/L 乙二胺四乙酸(EDTA)溶液,静置过夜,测定溶液浊度和电镜观察。
1.2.6红外光谱分析将样品用D2O溶解后,冷冻干燥,重复2次,以去除样品中的H2O。处理好的样品用D2O溶解,配成0.5% CEP溶液,用氘代的DCl和NaOD调节溶液pD。加入氯化钙重水溶液,使其与钙离子结合,形成CEP-Ca复合物。样液置于两片氟化钙窗片之间进行红外光谱分析。
1.2.7圆二色谱分析用超纯水配制0.5% CEP溶液,调节溶液pH,加入氯化钙,形成CEP-Ca复合物。样液置于光程为1 mm的石英比色皿中,25 ℃条件下采用圆二色谱仪进行光谱扫描。实验参数设定为:扫描波长190~300 nm,分辨率0.1 nm,带宽1.0 nm,扫描速度40 nm/min,每个样品扫描3次,取平均值。
2 结果与讨论
2.1纳米颗粒形成判断
溶液浊度是判断溶液颗粒大小的简单方法。判断依据为:以所有不加氯化钙的CEP溶液中的最小浊度为基准浊度,浊度至少上升50%,且不产生沉淀(静置一夜)[5]。
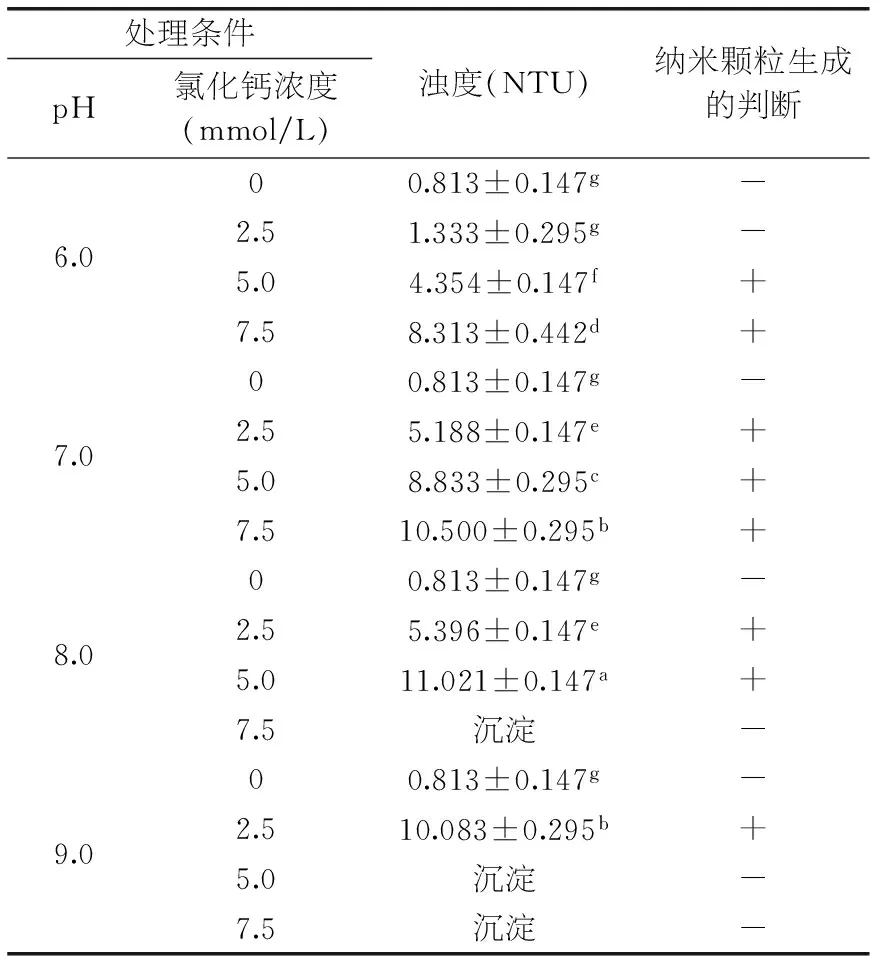
表1 CEP溶液在不同条件下的浊度
注:上标不同字母表示差异显著,p<0.05;表2同;+表示纳米颗粒可能形成,-表示没有形成。
由表1可知,CEP溶液的浊度在pH6.0~9.0范围内均无显著性差异,在此范围内单独调节pH并不能促进纳米颗粒形成。当加入氯化钙后,pH和氯化钙浓度均对纳米颗粒的可能形成产生影响。pH6.0~9.0范围内,纳米颗粒可能形成,且大小随着pH和氯化钙浓度上升而上升,但是超过某一范围将产生沉淀。
2.2纳米颗粒形成确认
在浊度实验基础上,筛选出可能形成纳米颗粒的条件,并在这些条件下制备“纳米颗粒”,用粒径分析仪测定粒径分布和用电镜观察颗粒形态,确定是否形成纳米颗粒。由表2可知,CEP在根据浊度实验筛选的结合条件均能形成粒径为25~115 nm的颗粒,分散性良好[13](PDI<0.4),且随着pH和钙浓度上升,颗粒粒径增大。电镜观察中也证实了纳米颗粒的形成,而且观测到的纳米颗粒直径与粒径分析仪测得的结果相吻合(图2)。

表2 CEP在不同制备条件下的纳米颗粒大小

图2 CEP-Ca的透射电镜图Fig.2 TEM images of CEP-Ca注:A:CEP(pH6.0,7.5 mmol/L CaCl2);B:CEP(pH8.0,5 mmol/L CaCl2);放大倍数:105×;图5、图6同。
CEP成分分析表明含有91.2%(w/w)的蛋白质和0.68%(w/w)的磷,相当于肽链中约每100个氨基酸就有2.6个是被磷酸化修饰,且主要是以磷酸丝氨酸形式存在[10]。磷酸基团的带电性赋予CEP结合钙离子的活性。蛋白质分子带负电是结合钙离子的化学基础,但是带电又导致分子间相互排斥,不利于纳米颗粒的形成。通过调节pH可以改变CEP的带电状况,而钙离子可以与负电基团结合而起到电荷屏蔽效应,从而诱导CEP-Ca纳米颗粒的形成。本实验中当把pH调节至6.0~9.0时,钙离子浓度控制在2.5~7.5 mmol/L时,CEP-Ca纳米颗粒可以形成。当进一步增加pH和钙离子浓度,会出现沉淀现象,这是由于Ca(OH)2沉淀所致。
2.3稳定纳米颗粒结构的作用力
纳米颗粒具有一定的空间结构,它的形成及稳定需要氢键、疏水作用、范德华力、静电相互作用等次级键作用力。为了确定哪些作用力对纳米颗粒的形成及稳定起作用,选择了破坏氢键的尿素、破坏疏水作用的十二烷基磺酸钠(SDS)、钙离子螯合剂乙二胺四乙酸(EDTA)以及调节pH对CEP-Ca(pH7.0,5.0 mmol/L CaCl2)纳米颗粒进行处理后静置过夜,以溶液浊度变化并结合电镜观察来判断纳米颗粒的解离情况。
2.3.1pH对纳米颗粒稳定的影响由图3可知,CEP-Ca纳米颗粒当pH降至6.0以下时会解离,表现为浊度迅速下降。实验还发现当pH升至9.0以上时,出现沉淀现象。pH由于改变体系的荷电情况而影响纳米颗粒的形成及稳定,当超出这个适宜的pH范围将阻碍纳米颗粒的形成或导致其解离。由此可见,静电相互作用是形成和稳定纳米颗粒的必要因素。

图3 pH对纳米颗粒分散液浊度的影响Fig.3 The influence of pH on theturbidity of the nanoparticle dispersions
由图3可知,CEP-Ca纳米颗粒的解离和形成并不完全同步。如CEP与5.0 mmol/L CaCl2分别在pH6.0、7.0、8.0形成的分散液浊度分别为4.354、8.833和11.021 NTU(表1),然而CEP在pH7.0,5.0 mmol/L CaCl2条件下形成纳米颗粒后,分散液pH调至8.0时,其浊度并不能升到11.021 NTU,而pH调至6.0时,其浊度也并不降到4.354 NTU,而均维持在初始水平附近(8.833 NTU)。这种现象说明CEP-Ca纳米颗粒在一定情况下一旦稳定形成,将难以解离或重新聚集,改变其特定空间结构需克服较大的自由能。
2.3.2尿素对纳米颗粒稳定的影响当加入尿素后,CEP-Ca纳米颗粒分散液的浊度显著下降,表明纳米颗粒发生了解离,然而即使将尿素浓度升到2.0 mol/L,也不能使纳米颗粒完全解离(图4和图5)。由于尿素破坏的是氢键,所以氢键参与了纳米颗粒的形成与稳定,但氢键与静电相互作用相比,影响较小。对沉淀体系的CEP-Ca也加入尿素进行实验,发现体系变澄清,但浊度检测依然表明存在纳米颗粒,由此确认氢键确实不是纳米颗粒形成的必要因素,但在颗粒聚集增大乃至沉淀过程中仍起到较大作用。
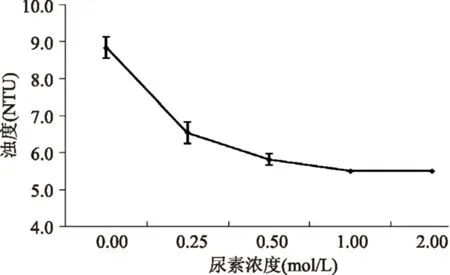
图4 尿素对纳米颗粒分散液浊度的影响Fig.4 The influence of urea on theturbidity of the nanoparticle dispersions

图5 2.0 mol/L尿素处理后CEP-Ca的透射电镜图Fig.5 TEM images of CEP-Caafter 2.0 mol/L urea treatment
2.3.3SDS对纳米颗粒稳定的影响SDS作为一种阴离子去污剂,是蛋白质的强变性剂,破坏稳定蛋白质空间结构的疏水作用和氢键。CEP-Ca纳米颗粒在0.01% SDS处理后立即形成沉淀,说明纳米颗粒快速失稳沉淀。尿素处理实验已证实氢键对纳米颗粒稳定性影响较小,由此可见,造成纳米颗粒快速失稳沉淀的主要原因是SDS破坏了纳米颗粒的疏水作用,而疏水作用是形成和稳定纳米颗粒的必要因素。
2.3.4EDTA对纳米颗粒稳定的影响EDTA是一种钙离子螯合剂,具有极强的钙离子结合能力,生成稳定的螯合物。实验表明,CEP-Ca分散液经2.5 mol/L EDTA处理后,浊度骤然降低,纳米颗粒完全解体,电镜观察呈无颗粒弥散状态(图6)。这说明钙离子直接参与了纳米颗粒的形成,是纳米颗粒的组成部分。
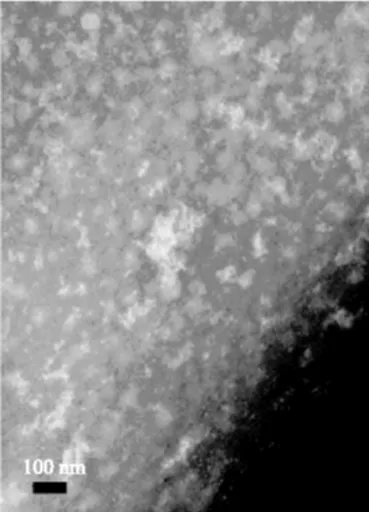
图6 EDTA处理后CEP-Ca的透射电镜图Fig.6 TEM images of IPP-Ca and CEP-Ca after EDTA treatment
2.4肽与Ca2+结合前后空间结构的变化
2.4.1红外光谱分析液体红外光谱是分析蛋白质二级结构变化的有效方法。通过分析蛋白质在红外光谱1700~1600 cm-1处的特征吸收带(酰胺Ⅰ带)的变化情况,可得到蛋白质二级结构变化的信息[14]。由图7可知,CEP在自然状况下(图7A)存在β折叠结构(1683、1636 cm-1),还有少量α螺旋(1651 cm-1)[15]和β转角(1605 cm-1)结构[16]。当加入钙离子或升高pH后,α螺旋结构吸收峰变小甚至消失,但β折叠结构吸收峰没有变化图7(B、C)。当CEP形成纳米颗粒后,1636 cm-1吸收峰显著升高并蓝移至1639 cm-1,表明β折叠结构增多(图7D)。这表明纳米颗粒的形成伴随着β折叠结构的形成。
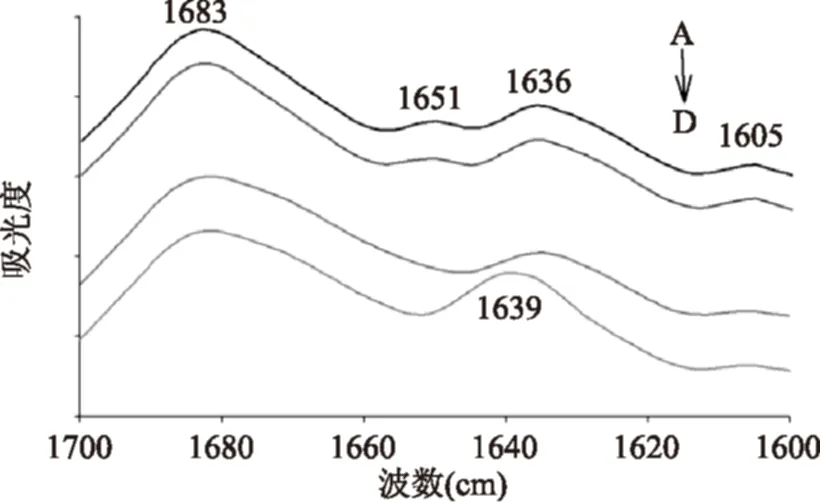
图7 CEP及CEP-Ca酰胺Ⅰ带红外吸收光谱Fig.7 Infrared spectra of amideⅠband of CEP and CEP-Ca注:A:0.5% CEP(pH5.0);B:0.5% CEP-Ca(pH5.0,5.0 mmol/L CaCl2);C:0.5% CEP(pH7.0);D:0.5% CEP-Ca(pH7.0,5.0 mmol/L CaCl2);图8同。
2.4.2圆二色谱分析圆二色谱能够灵敏检测蛋白质二级或三级结构的变化[17]。198 nm附近的正峰和218 nm附近的负峰是典型的β折叠结构形成的吸收峰,208 nm附近的负峰是α螺旋[6,18]。如图8所示,CEP在未形成纳米颗粒时,存在β折叠结构和α螺旋结构,这与红外光谱分析结果相吻合。当纳米颗粒形成时(图8D),208 nm处的负峰红移至216 nm现象,而这种现象是形成二级结构的特征,说明α螺旋结构转化为β折叠结构[5,19],这也证实当纳米颗粒生成时伴随着β折叠结构的形成。
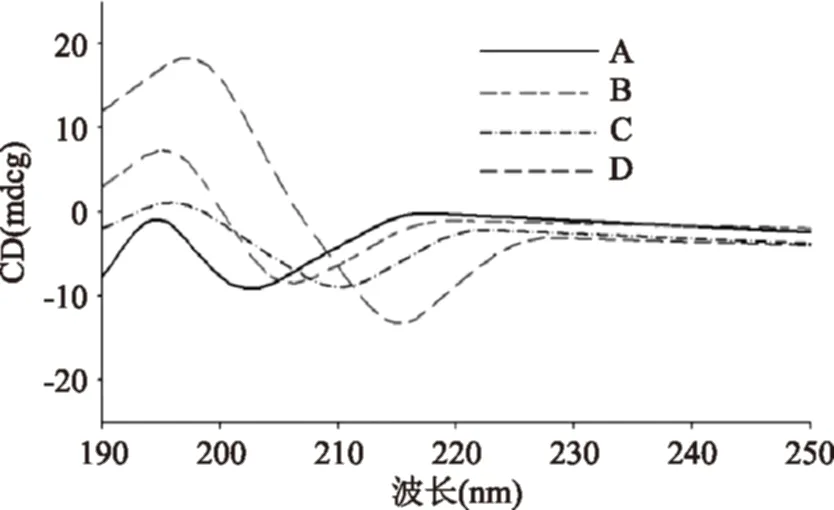
图8 CEP及CEP-Ca圆二色谱图Fig.8 CD spectra of CEP and CEP-Ca
纳米颗粒空间结构的形成及稳定需要借助静电、氢键、疏水作用等次级键,伴随着空间结构的改变。本实验研究表明静电和疏水作用是形成及稳定CEP-Ca纳米颗粒的主要次级键,氢键参与了纳米颗粒的形成,但不是其必要条件。空间结构分析表明纳米颗粒形成后伴随着α螺旋的减少或消失和β折叠的形成或增多。
通过上述实验结果,推测CEP-Ca纳米颗粒形成的过程机制为:由于磷酸基团酸性强于羧酸,磷酸丝氨酸残基上的磷酸基团首先电离,并抑制羧酸的电离,此时只能由磷酸基团结合钙离子。由于分子间排斥力大,而且1个钙离子只能与1个磷酸丝氨酸残基结合,无法在分子间形成盐桥,所以CEP与钙结合不会导致分子聚集产生纳米颗粒。当pH和钙离子浓度进一步升高,钙离子在优先饱和磷酸基团后,对其电荷产生屏蔽效应,使分子内及分子间斥力大大降低,在疏水作用和氢键作用下形成β折叠结构,同时羧酸电离并与钙离子结合,钙离子在两个羧酸根之间形成盐桥,进而构建网状结构,形成纳米颗粒。
3 结论
CEP能够在pH和钙离子诱导下形成纳米颗粒。当pH6~9时,CEP能与2.5~7.5 mmol/L的钙离子结合形成分散均匀、粒径20~100 nm的纳米颗粒,疏水作用、静电作用是稳定纳米颗粒的主要作用力,氢键参与了纳米颗粒的形成。当纳米颗粒形成后,空间结构发生了改变,表现为α螺旋的减少或消失和β折叠的形成或增多。本论文证实了CEP能够作为生物模板在温和条件下与钙离子形成肽-钙型纳米颗粒,因此CEP有望开发成纳米型肽-钙复合物类补钙制剂。
[1]Gao H,Chen H,Chen W,et al. Effect of nanometer pearl powder on calcium absorption and utilization in rats[J]. Food Chem,2008,109(3):493-498.
[2]Mohapatra M,Anand S. Synthesis and applications of nano-structured iron oxides/hydroxides-a review[J]. Int J Eng Sci Technol,2010,2:127-146.
[3]Galloway JM,Staniland SS. Protein and peptide biotemplated metal and metal oxide nanoparticles and their patterning onto surfaces[J]. J Mater Chem,2012,22:12423-12434.
[4]Tan YN,Lee JY,Wang DI. Uncovering the design rules for peptide synthesis of metal nanoparticles[J]. J Am Chem Soc,2010,132:5677-5686.
[5]Zhang J,Liang L,Tian Z,et al. Preparation andinvitroevaluation of calcium-induced soy protein isolate nanoparticles and their formation mechanism study[J]. Food Chem,2012,133:390-399.
[6]Wu HH,Liu ZY,Dong SY,et al. Formation of ferric oxyhydroxide nanoparticles mediated by peptides in anchovy(Engraulisjaponicus)muscle protein hydrolysate[J]. J Agri Food Chem,2013,61(1):219-224.
[7]Duan R,Zhang J,Du X. Properties of collagen from skin,scale and bone of carp(Cyprinuscarpio)[J]. Food Chem,2009,112:702-706.
[8]Kongsri S,Janpradit K,Buapa K. Nanocrystalline hydroxyapatite from fish scale waste:Preparetion,characterization and application for selenium adsorption in aqueous solution[J]. Chem Eng J,2013,215-216:522-532.
[9]Huang H,Li B,Liu Z,et al. Purification of an oligophosphopeptide with high calcium binding activity from carp eggs hydrolysate[J]. Food Sci Technol Res,2014,20(4):799-807.
[10]Huang H,Li B,Liu Z,et al. Effectiveness of carp egg phosphopeptide on inhibiting the formation of insoluble Ca saltsinvitroand enhancing Ca bioavailabilityinvivo[J]. Food Sci Technol Res,2014,20(2):385-392.
[11]黄海,李八方,刘尊英,等. 鱼卵肽钙复合物对大鼠体内促钙吸收作用的研究[J]. 食品工业科技,2014,35(3):331-335.
[12]Li Y,Huang H. Enzymatic preparation of carp roes’ hydrolysate with Ca-binding capacity[J]. Ad Mat Res,2012,554-556:1309-1317.
[13]Dragicevic-Curic N,Grafe S,Gitter B,et al. Surface charged temoporfin-loaded flexible vesicles:Invitroskin penetration studies and stability[J]. Inter J Pharma,2010,384(1-2):100-108.
[14]Lefèvre T,Subirade M. Structural and interaction properties of blactoglobulin as studied by FTIR spectroscopy[J]. Inter J Food Sci Technol,1999,34:419-428.
[15]Arrondo JLR,Muga A,Castresana J,et al. Quantitative studies of the structure of proteins in solution by Fourier-transform infrared spectroscopy[J]. Prog Biophy Molecular Bio,1993,159:23-56.
[16]Byler DM,Susi H. Examination of the secondary structure of proteins by deconvoluted FTIR spectra[J]. Biopolymers,1986,25:469-487.
[17]Wallace BA,Janes RW. Circular dichroism and synchrotron radiation circular dichroism spectroscopy:Tools for drug discovery[J]. Biochem Soci Transactions,2003,31:631-633.
[18]Correal DHA,Ramos CHI. The use of circular dichroism spectroscopy to study protein folding,form and function[J]. Afr J Biochem Res,2009,3:164-173.
[19]Allaoua A,Wang Z. Effect of succinylation on the physicochemical properties of soy protein hydrolysate[J]. Food Res Inter,2001,34:507-514.
Nanoparticles formation of carp eggs peptides induced by Ca2+and pH values
HUANG Hai1,2,LI Ba-fang3,ZENG Ming-yong3,*
(1.College of Food Engineering,Qinzhou University,Qinzhou 535011,China;2.Guangxi Colleges and Universities Key Laboratory of Development and High-value Utilization of Beibu Gulf Seafood Resource,Qinzhou 535011,China;3.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
To investigate the conditions of nanoparticles formation of carp egg peptide(CEP)induced by Ca2+and pH and to demonstrate the force of stabling their space structures. The conditions could be preliminary screened by turbidity testing and confirmed by particle size analysis and electron microscope observation. The forces of stabling nanoparticles could be determined through secondary bond destruction experiments and the changes of their space structures were studied using Fourier transform infrared spectroscopy(FTIR)and circular dichroism spectroscopy(CD). The results showed that nanoparticles whose diameters ranging from 20~100 nm were formed by CEP and Ca2+under pH6.0~9.0. The stabilities of the nanoparticles were mainly dependent on hydrophobic force and electrostatic force. Theβ-sheet formation was observed while CEP formed nanoparticles. CEP could be used as a biological template to synthesize peptide-calcium nanoparticles under mild conditions.
carp eggs peptides;nanoparticles;change of space structure
2016-03-30
黄海(1977-),男,博士,副教授,研究方向:水产品加工及资源利用,E-mail:jxfifagoal@163.com。
曾名湧(1965-),男,博士,教授,研究方向:水产品高值化利用,E-mail:mingyz@ouc.edu.cn。
国家自然科学基金(31101379);国家星火计划项目(2012GA740048)。
TS254.1
A
1002-0306(2016)18-0100-06
10.13386/j.issn1002-0306.2016.18.011

