添加非淀粉多糖酶对以干旱玉米为基础日粮的保育猪生长性能的影响
JonesCK,FrantzEL,BinghamAC,BergstromJR,DeRouchey J M,Patience J F
(1.堪萨斯州立大学谷物科学与工业系,曼哈顿66506;2.堪萨斯州立大学动物科学与工业系,曼哈顿66506;3.帕西帕尼帝斯曼集团营养产品部,新泽西州07054;4.爱荷华州立大学动物科技学院,美国埃姆斯50011)
中国·猪营养国际论坛
添加非淀粉多糖酶对以干旱玉米为基础日粮的保育猪生长性能的影响
JonesCK1,FrantzEL1,BinghamAC1,BergstromJR3,DeRouchey J M2,Patience J F4
(1.堪萨斯州立大学谷物科学与工业系,曼哈顿66506;2.堪萨斯州立大学动物科学与工业系,曼哈顿66506;3.帕西帕尼帝斯曼集团营养产品部,新泽西州07054;4.爱荷华州立大学动物科技学院,美国埃姆斯50011)
中国猪营养国际论坛是由美国动物科学学会、上海亘泰实业集团和上海优久生物科技有限公司联合主办,以“凝聚全球科研力量,驱动猪业创新思维”为宗旨,力邀全球一流的机构、专家和学者,倾力打造一个动物营养领域具有国际性、前沿性和权威性的论坛。该论坛每两年举办一届,聚焦行业发展中的热点、难点,通过专家学者和企业领导者之间进行开放建设性的学术探讨、理论研究和实践经验交流,整合全球动物营养领域最新的技术和研究成果,推动行业发展,创造和提升产业价值。
www.asaschina.org
试验选用360头猪(PIC 1050×337,初始体重5.85 kg)用于评估干旱玉米中添加或不添加非淀粉多糖酶对保育猪生长性能和营养物质消化率的影响。收集34个样品,找到具有代表性的正常和干旱玉米。所选其代表性的正常玉米容重为719.4 kg/m3,水分含量15.0%,木聚糖含量4.2%。所选代表性的干旱玉米容重为698.8 kg/m3,水分含量14.3%,木聚糖含量4.7%。断奶后10 d适应期,保育猪被随机分配至8个日粮组。试验选用2×4因素设计,主要因素为玉米(正常玉米、干旱玉米)和酶(不添加、100 mg/kg酶A、250 mg/kg酶B、100 mg/kg酶A+250 mg/kg酶B)。两种酶分别为β-葡聚糖酶、纤维素酶和木聚糖酶(酶A)或半纤维素酶和果胶酶(酶B)的混合物。断奶后10~35 d按照两阶段饲喂方式。断奶后30 d收集饲料和粪便样品测定营养物质的表观全肠道消化率。结果表明,正常和干旱玉米的营养成分相似,因此不同玉米类型或酶种类的各个处理间的差异很小。玉米类型和酶种类之间无交互作用(P>0.10)。整个阶段(10~35 d),试验处理对平均日增重和采食量无影响,但酶A有增加饲料转化率的趋势(P<0.10;0.74、0.69),主要是由于第2阶段(断奶后10~25 d)猪饲喂酶A提高了饲料转化率(0.76、0.72;P<0.05),从而改善木聚糖酶利用率。由此可见,干旱并不改变玉米中除木聚糖以外的非淀粉多糖含量,因此添加酶对保育猪生长性能影响较小。断奶后10~25 d饲喂含酶A的日粮提高了仔猪饲料转化率。
非淀粉多糖酶;玉米;干旱;酶;生长;猪
众所周知,干旱条件会降低谷物产量,降低其能量,从而影响动物生长性能。在旱情严重期,由于胚乳沉积减少,通常使谷粒越来越少且小(Zinselmeier等,1999)。粒数量是影响产量的主要因素,粒大小有可能会影响容重(Andrade等,2002)。粒数量由授粉决定(Andrade等,2002)。如果干旱导致授粉期缩短,胚胎形成后中止,会大大减少粒数量,降低作物产量(Zinselmeier等,1999)。同时,谷物粒形成期干旱会导致粒重量减轻(Çakir,2004)。水分限制使胚乳产量减少,从而可能改变胚乳/果皮比。因为谷物的果皮部分纤维含量高,因此该比例的变化可能改变谷物粒的营养组分,使其纤维成分含量变高,比如非淀粉多糖。
糖酶可能提高非淀粉多糖中碳水化合物的营养利用率(Jones等,2010)。市售非淀粉多糖酶在含有高水平非淀粉多糖的日粮中效果比玉米中好(Omogbenigun等,2004)。商业糖酶的效果在玉米-豆粕基础日粮表现不一致;然而,干旱玉米中非淀粉多糖的增加可能为酶提供一种经济模式(Dänicke等,1999)。本研究旨在研究干旱玉米中添加市售非淀粉多糖酶对保育猪生长性能和营养物质消化率的影响。
1 材料与方法
本试验方案由堪萨斯州立大学动物保护和使用委员会批准。本研究在曼哈顿堪萨斯州立大学早期隔离断奶中心执行。
1.1谷物组成和日粮生产收集并分析34个玉米样品,分为“正常型”和“干旱”两种玉米来源,用于日粮加工。选用的正常玉米容重为719.4 kg/m3,水分含量15.0%,β-葡聚糖含量0.77%,木聚糖含量4.2%,纤维素含量2.5%,半纤维素含量7.8%(表1)。正常玉米生长于平均降雨量83.5%的地区,正常平均土壤湿度(30cm,National Oceanic and Atmospheric Administration,2012a)。所选代表性的干旱玉米容重为698.8 kg/m3,水分含量14.3%,β-葡聚糖含量0.83%,木聚糖含量4.7%,纤维素含量2.5%,半纤维素含量7.6%。干旱玉米生长于平均降雨量58.0%的地区,低于平均土壤湿度(7.9 in.,National Oceanic and Atmospheric Administration,2012b)。根据美国联邦谷物检验局公布的谷物标准,这两种玉米均为马齿型2级玉米。
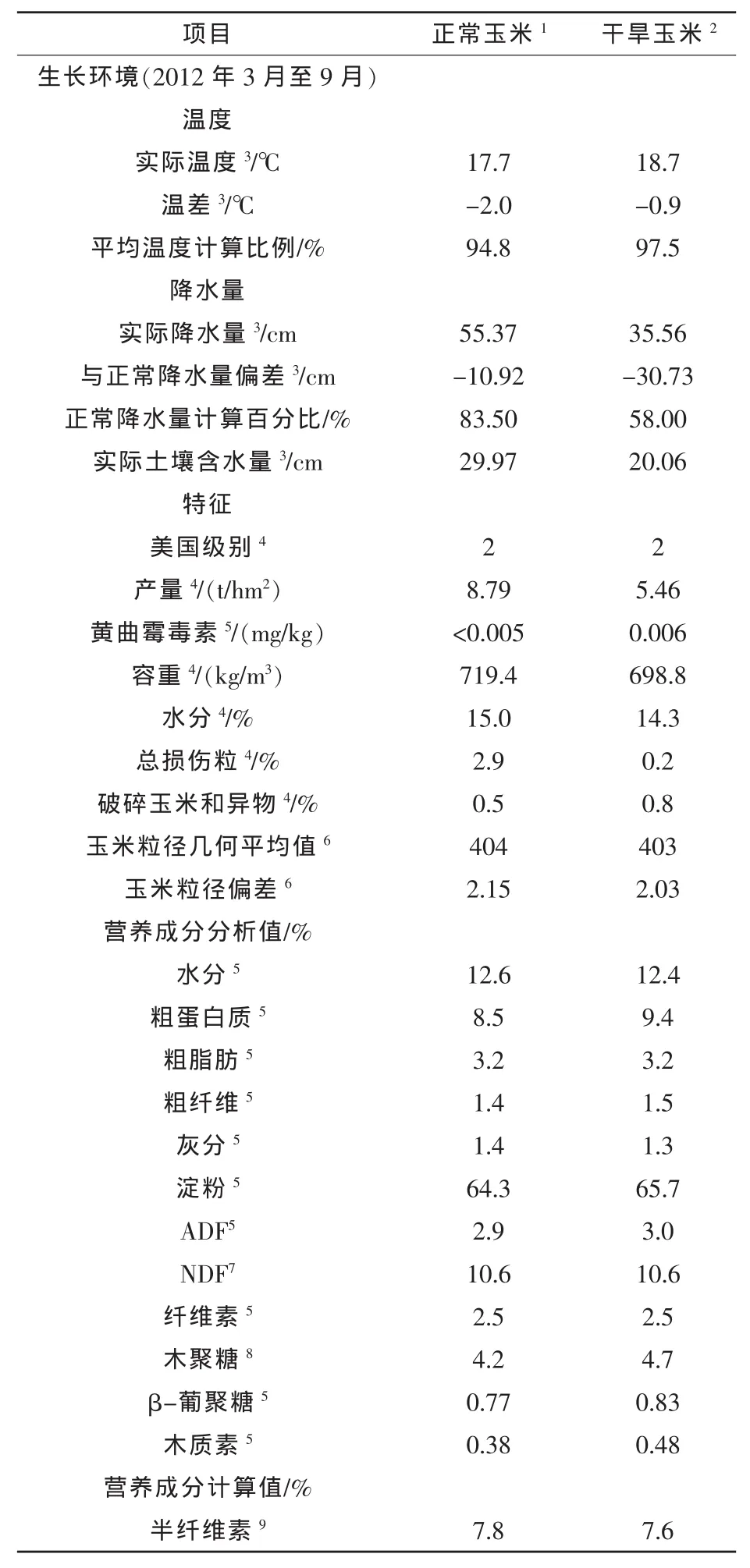
表1 玉米生长环境、特征和营养组成(原样)
在锤式粉碎机中将颗粒粉碎成相同的粒度,用于加工2个阶段保育猪日粮。试验有3阶段保育饲喂系统,第1阶段预试期饲喂基础日粮。所有日粮设计为相同的配方,给予相同的营养和酶以替代谷物(表2)。以粉料的形式饲喂8种日粮,按照2×4因素设计,主因素为玉米(正常、干旱)和酶添加量(无、100 mg/kg酶A、250 mg/kg酶B、100 mg/kg酶A+250 mg/kg酶B)。两种酶均为非淀粉多糖酶,酶A为70 U/kg β-葡聚糖酶、80 U/kg纤维素酶和270 U/kg木聚糖酶的混合物;酶B为50U/g β-葡聚糖酶,15000 U/g半纤维素酶和3000U/g果胶酶的混合物。
日粮含有0.4%的二氧化钛作为内标物,其概略养分和碳水化合物组成见表3。
1.2试验设计试验选用360头仔猪(PIC 1050×337,初始重5.85 kg,21日龄),进行25 d的生长和营养消化率试验。断奶时将猪分组(0 d),第1阶段为10 d预试期,饲喂基础日粮。10 d后,将猪称重,完全随机分配至8个日粮组。每栏5头猪,每个处理9个重复。自由采食和饮水。试验期按2阶段进行:第2阶段为断奶后10~25 d,第3阶段为断奶后25~35 d。断奶后第10、25和35 d记录猪体重和耗料量,用于计算平均日增重(ADG)、平均采食量(ADFI)和饲料转化率(G∶F)。
1.3数据分析使用SAS 9.3中GLIMMIX程序进行数据分析,主因素为固定因子,无随机因子。交互作用不显著(P>0.24),因此从模型中移除。正交对比包括酶添加和不添加(忽略酶种类和玉米种类),添加酶A和不添加酶(忽略玉米类型),添加酶B和不添加酶(忽略玉米种类),酶A+B和不添加酶(忽略玉米种类)。P<0.05表示差异显著,0.05<P<0.10表示有差异趋势。
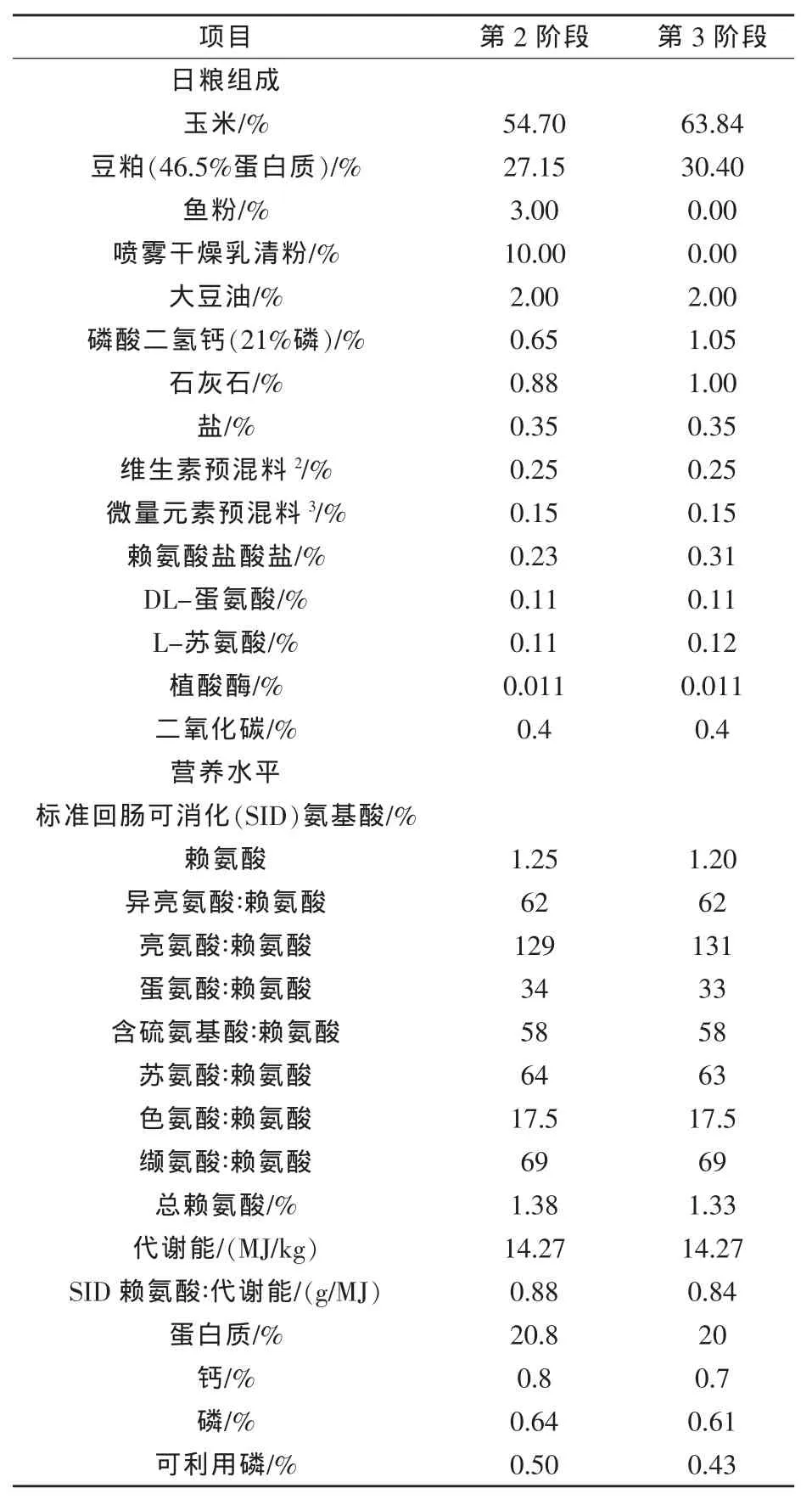
表2 日粮组成(计算值,饲喂基础)1
2 结果讨论
第2阶段,8种日粮总淀粉含量为34.8%~41.1%,纤维素为2.6%~3.1%,木质素为27.5%~32.2%,β-葡聚糖酶为0.42%~0.50%。受干旱影响玉米的日粮木质素含量较高,原因可能是正常玉米木质素含量为4.2%,而受干旱影响玉米木质素水平为4.7%。Bach Knudsen(1997)预测玉米和豆粕中木质素含量分别为42 g/kg和17 g/kg,这与本试验正常玉米木质素水平相似。正常玉米和受干旱影响玉米加工的日粮其他方面无差异。第3阶段,日粮总淀粉含量为40.2%~46.9%,纤维素为2.9%~3.5%,木质素为30.4%~35.5%,β-葡聚糖酶为0.49%~0.58%。同样除了木质素含量,两种日粮无差异。正常玉米和干旱玉米之间碳水化合物分析结果的相似性很令人吃惊,特别是考虑到两种玉米来源产量的极端差异。尽管受干旱影响玉米的某些营养成分发生改变,值得注意的是蛋白质和淀粉,其他代表着非淀粉多糖等营养组分的物质基本未受影响。产量和平均土壤水分含量的综合考虑,证实干旱玉米主要受水分影响。受精过程中干旱应激导致胚胎死亡,从而导致穗粒数减少(Çakir,2004;Grant等,1989)。然而,营养物质组成的相似性表明水分应激发生在吐丝期之前或期间。粒发育期水分应激可能不足以干扰胚乳沉积或影响胚乳/果皮比。两种玉米源非淀粉多糖相似性可能引起8种日粮含量相似。
玉米类型(正常、受干旱影响)不影响任何阶段猪的末体重、平均日增重、平均采食量和饲料转化率(P>0.10,表4)。同样的,玉米类型也不影响干物质、灰分、粗蛋白质和粗脂肪的表观全肠道消化率(P>0.10),但饲喂正常玉米日粮的猪粗纤维表观全肠道消化率明显比饲喂受干旱玉米日粮的猪高(P<0.05),这可能是由于受干旱玉米的木质素含量高。
不同玉米类型和日粮间由于其他的非淀粉多糖底物差异很小,因此添加酶并未影响猪的末重、平均日增重和平均采食量(P>0.10)。添加酶对10~25 d或25~35 d仔猪的饲料转化率没有影响(P>0.10),但对整阶段(10~35 d)饲料转化率有增加的趋势(P<0.10),添加酶A的日粮组饲料转化率最大。添加酶不影响干物质、粗脂肪和粗纤维的表观全肠道消化率(P>0.10),但对灰分表观全肠道消化率有显著影响(P<0.05)。研究表明非淀粉多糖对体外矿物质消化率有影响,尤其是半纤维素可以结合钙、镁、猛等必需矿物质元素(Mod等,1982)。然而,也有研究认为非淀粉多糖对猪矿物质元素利用率影响很小(Kerr和Shurson,2013;Kornegay和Moore,1986)。值得注意的是,添加酶A组灰分消化率增加,单独添加或与酶B混合添加时,其灰分消化率都比不添加酶要高(P<0.05)。同时,日粮中添加含有半纤维素酶的酶B,灰分消化率与不添加酶无差异(P>0.10)。可以预测添加酶可以提高氮消化率,因为非淀粉多糖使内源氮分泌增加,从而分泌菌体氮(Kerr和Shurson,2013;Borel等,1989)。然而,与不添加酶相比,添加酶B有降低蛋白质消化率的趋势这一现象无法解释(P<0.10)。因为添加酶对生长性能无影响,所以这个结果仍需要进一步确定。
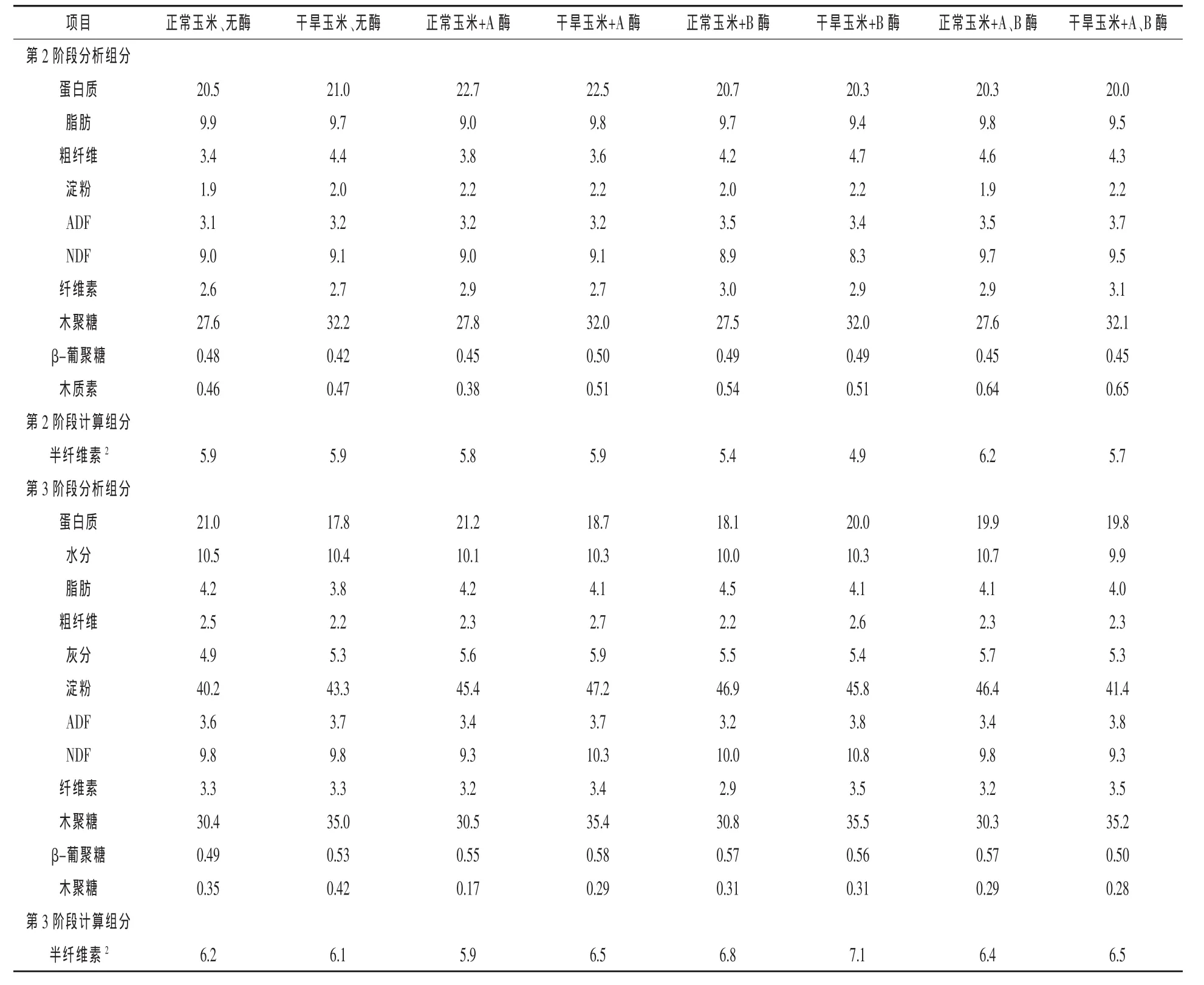
表3 保育猪日粮营养成分计算分析值%
正交对比试验发现,在生长性能方面,与不添加酶组相比,仅添加酶A有提高整体平均日增重的趋势(P<0.10),并明显提高10~25 d的饲料转化率(P<0.05)。这可能是由于日粮中木聚糖利用率提高,因为酶A中含有木聚糖酶,而酶B不含。有研究表明,玉米-豆粕型基础日粮中添加含有木聚糖酶的复合酶,能提高生长性能和营养物质消化(Yi等,2013;Fang等,2007)。与不添加酶组相比,添加酶A或酶A的复合物能提高灰分的表观全肠道消化率(P<0.05),但未发现对其他营养消化率有影响,(P>0.10)。
关于糖酶的作用机制并不是很清楚,结论也不一致(Bedford,2000)。日粮配方中含有小麦DDGS、黑麦或小麦等高纤维组分时,糖酶应该是最有效的处理方式(Emiola,2009;Omogbenigun等,2004)。多种复合酶在玉米豆粕基础日粮和玉米DDGS日粮中效果不佳。Jones等(2010)研究发现,在含有30%DDGS的玉米豆粕日粮中添加半乳糖苷酶、半乳甘露聚糖酶、β葡聚糖酶或木聚糖酶不能改善动物生长性能。Ji等(2008)和Li等(1996)发现添加β葡聚糖复合酶也不能提高猪生长性能,但Ji等(2008)发现干物质、粗蛋白质、粗纤维、粗脂肪和灰分的消化率有所提高。目前糖酶的功效可能取决于酶分解可利用底物数量。粗纤维底物组成和浓度可能在糖酶功效中起重要作用(Bedford,2000)。因此,在猪日粮中使用糖酶之前,应当对玉米粒组成作全面分析,包括木聚糖、β-葡聚糖、果胶、纤维素、木质素和半纤维素的浓度和比例。
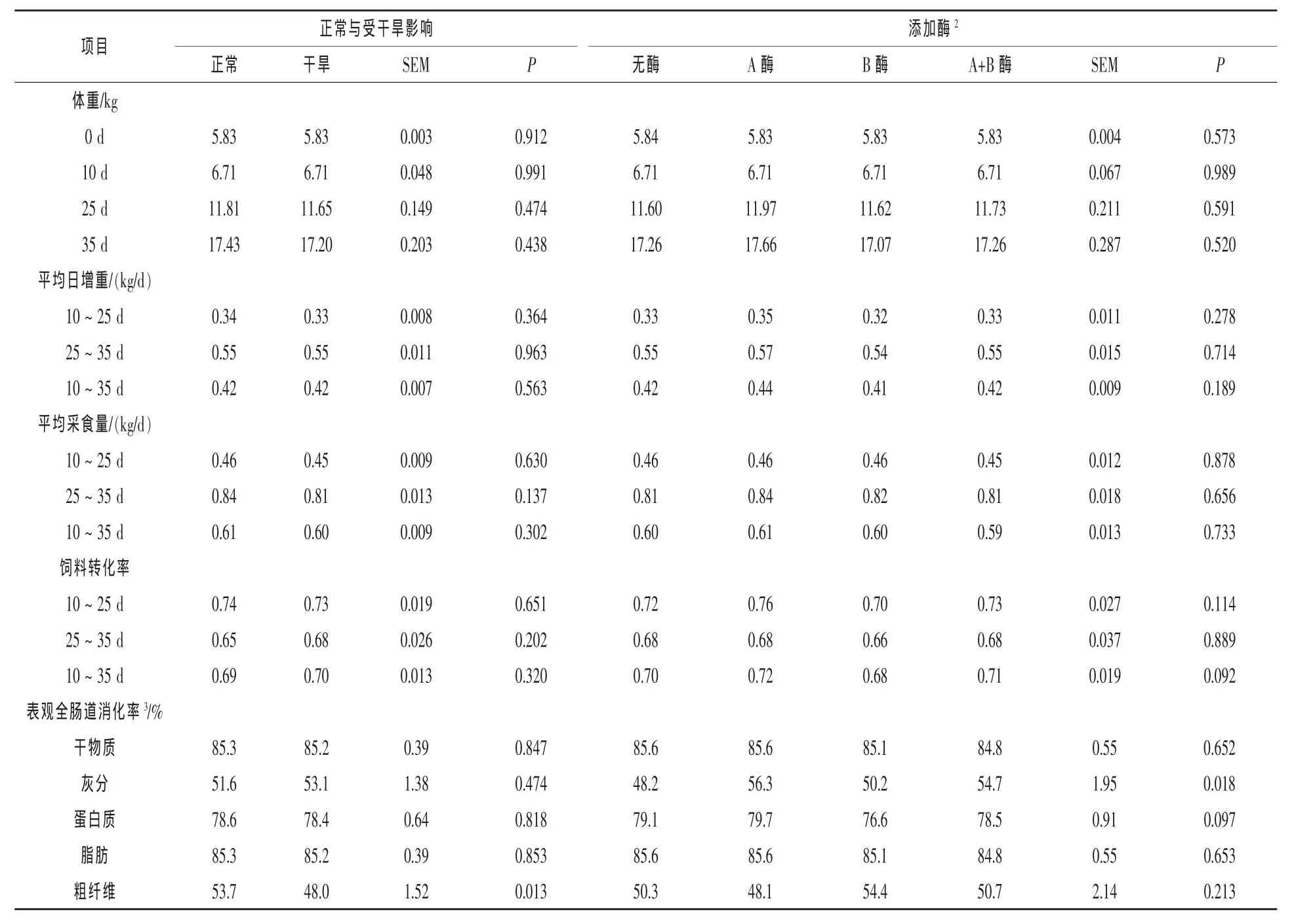
表4 干旱玉米和添加酶对保育猪生长性能和营养物质消化率的影响1
上述可见,正常和干旱玉米营养组成,以及两者对猪生长性能的影响相似。因为各日粮中非淀粉多糖底物含量相似,所以添加酶对保育猪生长性能影响较小;而对于断奶后10~25 d,饲喂添加酶A的日粮可以提高猪的饲料转化率,但还需要进一步研究,尤其是需要参考木聚糖底物的可利用性。
[1]American Society of Agricultural Engineers.Method of determining and expressing fineness of feed materials by sieving[J].ASAE standard S319.3.American Society of Agricultural Engineers,St.Joseph,MO.2003.
[2]Andrade F H,Echarte L,Rizzalli R,et al.Kernel Number Prediction in Maize under Nitrogen or Water Stress[J].Cropence,2002,42(4):1173~1179.
[3]AOAC.Official methods of analysis of AOAC International,18th edition.[M].2007.
[4]Keb K,Bach Knudsen K E.Carbohydrate and lignin contents of plant materials used in animal feeding[J].Animal Feed Science&Technology,1997,67(4):319~338.
[5]Bedford M R.Exogenous enzymes in monogastric nutrition-their current value and future benefits[J].Animal Feed Science&Technology,2000,86(1~2):1~13.
[6]Borel P,Lairon D,Senft M,et al.Wheat bran and wheat germ:effect on digestion and intestinal absorption of dietary lipids in the rat[J].American Journal of Clinical Nutrition,1989,49(6):1192~1202.
[7]Çakir R.Effect of water stress at different development stages on vegetative and reproductive growth of corn[J].Field Crops Research,2004,89(1):1~16.
[8]Danicke S,Dusel G,Jeroch H,et al.Factors affecting efficiency of NSP-degrading enzymes in rations for pigs and poultry[J].Agribiological Research,1999,52(1):1~24.
[9]Emiola I A,Opapeju F O,Slominski B A,et al.Growth performance and nutrient digestibility in pigs fed wheat distillers dried grains with solublesbased diets supplemented with a multicarbohydrase enzyme[J].Journal of Animal Science,2009,87(7):2315~2322.
[10]Fang Z F,Peng J,Liu Z L,et al.Responses of non-starch polysaccharidedegrading enzymes on digestibility and performance of growing pigs fed a dietbased on corn,soya bean meal and Chinese double-low rapeseed meal[J]. Journal of Animal Physiology and Animal Nutrition,2007,91(7~8):361~368.
[11]Grant R F,Jackson B S,Kiniry J R,et al.Water Deficit Timing Effects on Yield Components in Maize[J].Agronomy Journal,1989,81(1):61~65.
[12]Holst DO,Holst filtration apparatus for Van Soest detergent fiber analysis[J].Association of Official Analtyical Chemists,1973,56:1352~1356.
[13]Hudson J R,Morgan S L,Fox A.High resolution glass capillary columns for the gas chromatographic analysis of alditol acetates of neutral and amino sugars[J].Journal of High Resolution Chromatography,2005,5(6):285~290.
[14]Ji F,Casper D P,Brown P K,et al.Effects of dietary supplementation of an enzyme blend on the ileal and fecal digestibility of nutrients in growing pigs[J].Journal of Animal Science,2008,86(7):1533~1543
[15]Jones C K,Bergstrom J R,Tokach M D,et al.Efficacy of commercial enzymes in diets containing various concentrations and sources of dried distillers grains with solubles for nursery pigs[J].Journal of Animal Science,2010,88(6):2084~2091.
[16]Kerr B J,Shurson G C.Strategies to improve fiber utilization in swine[J]. Journal of Animal Science&Biotechnology,2013,4(2):112~123.
[17]Kornegay E T.Dietary fiber sources may affect mineral use in swine[J].Pigs &Poultry,1986.
[18]Leone J L.Collaborative study of the quantitative determination of titanium dioxide in cheese[J].Journal-Association of Official Analytical Chemists,1973,56(3):535~537.
[19]Lewis L L,Stark C R,Fahrenholz A C,et al.Effects of pelleting conditioner retention time on nursery pig growth performance[J].Journal of Animal Science,2015,93(3):1098~1102.
[20]Li S,Sauer W C,Mosenthin R,et al.Effect of β-glucanase supplementation of cereal-based diets for starter pigs on the apparent digestibilities of dry matter,crude protein and energy[J].Animal Feed Science&Technology,1996,59(4):223~231.
[21]Mccleary B V,Gibson T S,Mugford D C.Measurement of Total Starch in Cereal Products by Amyloglucosidase-α-Amylase Method:Collaborative Study[J].Journal of Aoac International,1997,80(3):571~579.
[22]Mod R R,Ory R L,Morris N M,et al.In vitro interaction of rice hemicellulose with trace minerals and their release by digestive enzymes[J]. Cereal Chemistry,1983,59(6):538~542.
[23]National Oceanic and Atmospheric Administration.Annual climatological summary:Atlantic,IA.National Climatic Data Center,Asheville,NC.2012a.
[24]National Oceanic and Atmospheric Administration.Annual climatological summary:Harlan,IA.National Climatic Data Center,Asheville,NC.2012b.
[25]Omogbenigun F O,Nyachoti C M,Slominski B A.Dietary supplementation with multienzyme preparations improves nutrient utilization and growth performance in weaned pigs[J].Journal of Animal Science,2004,82(4):1053~1061.
[26]Yi J Q,Piao X S,Li Z C,et al.The effects of enzyme complex on performance,intestinal health and nutrient digestibility of weaned pigs[J].Asian Australasian Journal of Animal Sciences,2013,26(8):1181~1188.
[27]Zinselmeier C,Boyer J S.Starch and the control of kernel number in maize at low water potentials[J].Plant Physiology,1999,121(1):25~36.
S816.7
A
1004-3314(2016)13-0039-06
10.15906/j.cnki.cn11-2975/s.20161310

