适体和蛋白质解离常数检测方法比较分析*
苏 雪,何逸婷,林俊生
(华侨大学 生物医学学院,福建 泉州 362021)
适体和蛋白质解离常数检测方法比较分析*
苏 雪,何逸婷,林俊生
(华侨大学 生物医学学院,福建 泉州 362021)
对基于石英晶体微天平(QCM)生物传感器的两种检测核酸适体与蛋白质解离常数方法进行了比较,提出来一种更加精确合理的检测流程。以凝血酶和凝血酶适体TBA15为模型,耗散型石英晶体微天平(QCM-D)为传感器,实时检测末端修饰巯基适体的固定、表面封闭剂对非特异性结合位点封闭以及两种不同的蛋白进样方式引起的频率响应,实验数据拟合得到解离常数。不同蛋白的进样方式得到的解离常数不同,非特异性位点的封闭也同样影响解离常数的检测。从低浓度到高浓度依次通入固定体积蛋白的进样方式,实验重复性高且消耗样品量小于1 μg,是较为理想的检测方式。
石英晶体微天平传感器; 核酸适体; 蛋白质; 解离常数
0 引 言
石英晶体微天平 (quartz crystal microbalance,QCM) 传感器是一种以压电效应为理论基础的压电传感器,能够实时检测分子与分子间、分子与细胞间的相互作用,检测限可达到ng级[1]。由于具备无需标记、灵敏度高、操作简单等优点[2],石英晶体微天平传感器已广泛应用于材料化学、高分子、分析化学、生物医学等领域[3],检测靶标涉及蛋白[4]、小分子[5]、细菌[6]等。
适体是一种新型的功能性分子,经过近30年的发展,由于其特异性和与靶标的亲和性可与现在广泛应用的抗体相媲美,同时具有分子量小、免疫原性低、稳定性高、易于修饰等特点,在传感器方面的应用[7]已越来越受到人们的关注。适体一般是短链的核酸分子或者多肽分子,靶标可为小分子化合物、蛋白质、细胞甚至特异性组织[8]。适体筛选传统方法是指数富集配体系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术或其改进技术,筛选完成后往往需要对适体的性能进行表征。亲和性是适体优劣评价的关键指标之一[9],不同的表征方法或者相同的方法不同的检测方案均会造成检测结果的差异。以蛋白质为靶标的适体分子的亲和力检测中,常用的方法有透析法、硝酸纤维素滤膜法、凝胶电泳法毛细管电泳(capillary electrophoresis,CE)、高效液相色谱法(high performance liquid chromatography,HPLC)等,表面等离子共振、石英晶体微天平、等温滴定量热法、荧光强度检测等,其中表面等离子共振、硝酸纤维素滤膜法、石英晶体微天平三种方法的检测限均在10-10~10-12mol,但硝酸纤维素滤膜法和表面等离子共振法的重复性较低,稳定性差,实验过程和制备样品复杂[10]。石英晶体微天平由于其实验过程简单,实验的重现性高,无需标记且可进行实时监测等优点,正在越来越受到关注[11]。现有的石英晶体微天平传感器检测适体和靶标蛋白的亲和力的方法中存在两种检测方法,一种是使用不同芯片,单次固定核酸适体在芯片上,通入不同浓度固定体积的靶标蛋白[12];另一种是使用同一芯片,从低浓度到高浓度依次通入固定体积的靶标蛋白[13]。
本文以凝血酶和凝血酶适体TBA15为模型,耗散型石英晶体微天平(quartz crystal microbalance with dissipation,QCM-D)传感器为表征方法,对现有的石英晶体微天平检测适体—蛋白的亲和性的两种方法进行了对比。文献查阅表明,Chen等人[14]和Jane Poloti等人[15]的研究中各使用了其中一种方法,但检测得到的解离常数相差近一个数量级,存在较大差异,本文就这两种方法及得到的结果差异进行了探究,提出了一种更加合理,更加精确的检测方法。
1 方法和材料
如图1所示,运用石英晶体微天平进行核酸适体和蛋白质接力常数检测。首先,采用金硫键自组装的方法进行功能化芯片构建,随后利用封闭剂进行封闭,最后通入靶标蛋白检测相互作用。
图1 传感器检测流程简图Fig 1 Flow chart of sensor detection
1.1 构建核酸适体适体功能化芯片
AT切割的标准芯片(瑞典百欧林),基频为5 Hz,在使用前用UV表面照射箱照射10 min后,用30 %过氧化氢:浓氨水:水= 2∶2∶10的溶液在75 ℃的条件下进行水浴10 min,用18.0 Ω的超纯水冷却重悬后,氮气吹干,置于耗散型石英晶体微天平(瑞典百欧林,E4)模块内,实验温度设置为20 ℃,流动泵流速为20 μL/min。设置后,通入超纯水稳定系统后,再通入适体与靶标蛋白结合用的缓冲溶液(20 mmol Tris,pH 7.4,140 mmol NaCl,5 mmol KCl,5 mmol MgCl2,1 mmol CaCl2),检测系统稳定后,在线通入300 μL(0.5 μmol)缓冲溶液配置的凝血酶特异性适体TBA15(SH—C6—TTT TTT TTT TTT TTT GGT TGG TGT GGT TGG,上海生工),通入完成后,通入10 min缓冲液去除未结合在芯片表面的适体,实时在线监测适体在芯片表面的固定量。
1.2 抗蛋白非特异性吸附表面构建
由于蛋白质在金芯片表面存在非特异性吸附,因此,需要在适体功能化的芯片表面进行封闭。经过文献查阅发现,常用的封闭剂为牛血清白蛋白(bovine serum albumin,BSA)[16]和6—巯基己醇(6—mercapto—1—hexanol,MCH)[17](sigma)。通入浓度为5 μM的BSA和MCH进行芯片表面非特异性结合位点的封闭,QCM-D实时表征封闭剂效果,并对比BSA、MCH和未封闭引起的信号差异。选择合适的封闭剂,以直接在芯片表面构建封闭剂组装膜为blank,溶解素(北京索莱宝)为阴性蛋白对照组,Control(SH—C6—ATA CGA GCT TGT TCA ATA CCG ATA GGC GCG TCA GGG AGA CTG AAT CTC TG,上海生工)为阴性适体对照组,buffer组为空白组,对封闭剂的性能进行表征。
1.3 适体与蛋白质解离常数的检测
运用石英晶体微天平传感器检测适体与靶标分子的解离常数,文献中常用的方法有两种,一种是使用不同芯片,单次固定核酸适体在芯片上,通入不同浓度固定体积的靶标蛋白,根据浓度依赖曲线计算适体与靶标的平衡力结合常数[18];另外一种是使用同一芯片,单次固定核酸适体在芯片上,通入不同浓度固定体积的靶标蛋白,根据浓度依赖曲线计算适体与靶标的平衡力结合常数[19]。本文以凝血酶为模型,分别用文献中已报道的两种方法进行凝血酶适体TBA15与靶标蛋白质凝血酶的亲和力进行检测,以此比较两种检测方法的优劣并对检测方法进行优化。
2 结果与讨论
2.1 核酸适体功能化芯片表征
石英晶体微天平可对适体在芯片表面的固定进行实时监控,如图1所示。石英晶体微天平是以压电效应为理论基础的传感器,根据Sauerbrey方程可知,其频率变化与芯片表面的质量变化存在线性关系,芯片表面固定的质量增大,其频率降低[20]。从图2中可看出,适体通入后在芯片固定,芯片表面的质量增加,频率下降,表示适体在芯片表面固定成功;本实验采用的是最经典的金硫键自组装膜的固定方法,末端—SH修饰的适体可在较短时间内(几分钟)在金表面进行固定,构建完成核酸适体功能化的芯片。

图2 适体固定实时检测Fig 2 Immobilization of aptamer monitored in real time
2.2 抗蛋白非特异性吸附表面表征
由于适体的进样量有限,核酸适体功能化的芯片表面仍存在裸露的结合部位,蛋白在这些区域容易进行非特异性的吸附,因此,需要加入封闭剂对这些区域进行封闭处理,本研究中探讨了石英晶体微天平中两种常用的封闭剂MCH、 BSA。本实验使用的是耗散型的石英晶体微天平,同时可实时监测芯片表面制备的膜的性能变化,芯片表面分子柔性越大,耗散因子增大。如图3(a)可知,与未封闭组相比,MCH组芯片表面结合的蛋白量比空白组少,但是耗散变化大于空白组,表面芯片表面形成的适体—蛋白的复合物的量大于空白组,反之,可以说明空白组中结合的一部分蛋白与芯片表面发生了非特异性结合。BSA组的效果比MCH组效果差,因此,本文实验结果表明,MCH是较理想的封闭剂。如图3(b)可知,buffer组,blank组,control组和溶解素组引起的信号响应明显低于TBA15实验组,因此MCH是较理想的封闭剂。
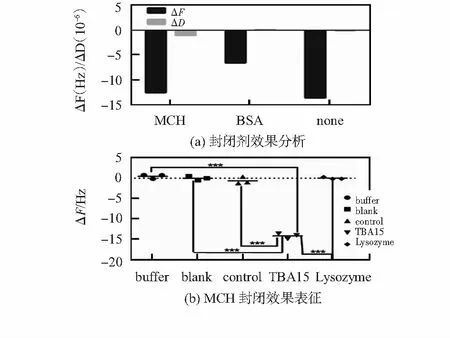
图3 非特异性位点封闭剂表征Fig 3 Representation of block agent for blocking non-specific binding site
2.3 解离常数的测定
适体与靶标的亲和力的表征一般的方法是检测适配体与靶标的解离常数KD值。利用两种不同的方法进行解离常数的检测,如图4(a)所示,利用第一种方法(binding assay 1),频率的变化随着蛋白浓度的变化而增大。但由于在检测过程中使用了不同的芯片,适体在芯片上的状态存在差异,如图4(c)所示,3次独立重复实验的误差较大。利用第二种方法(binding assay 2),由图4(b)所示,在同一核酸适体功能化的芯片表面依次通入不同浓度等体积的凝血酶蛋白,频率依次下降。随着浓度的增大,频率下降的幅度先减后增。由于在同一功能化的芯片表面进行,如图4(d)所示,在实验过程中的3次独立重复实验误差较小。此外。就实验次数和样品用量而言,第一种方法检测,需要进行的实验次数是15次,而第二方法检测需要的实验次数为 3次,大大缩短了实验时间。由于靶标分子为凝血酶蛋白,适体与蛋白的结合与其酶活有一定的关系,第一种检测方案中,每次需要使用新配置的蛋白,蛋白消耗量大,第二种方案需要使用的蛋白量小于1 μg。运用软件GraphPad Prism进行数据拟合结果发现,第一种方案检测得到的KD值为119 nmol,第二种检测方案得到的KD值为43.24 nmol。因此,这两种检测方法得到的KD值差异较大。
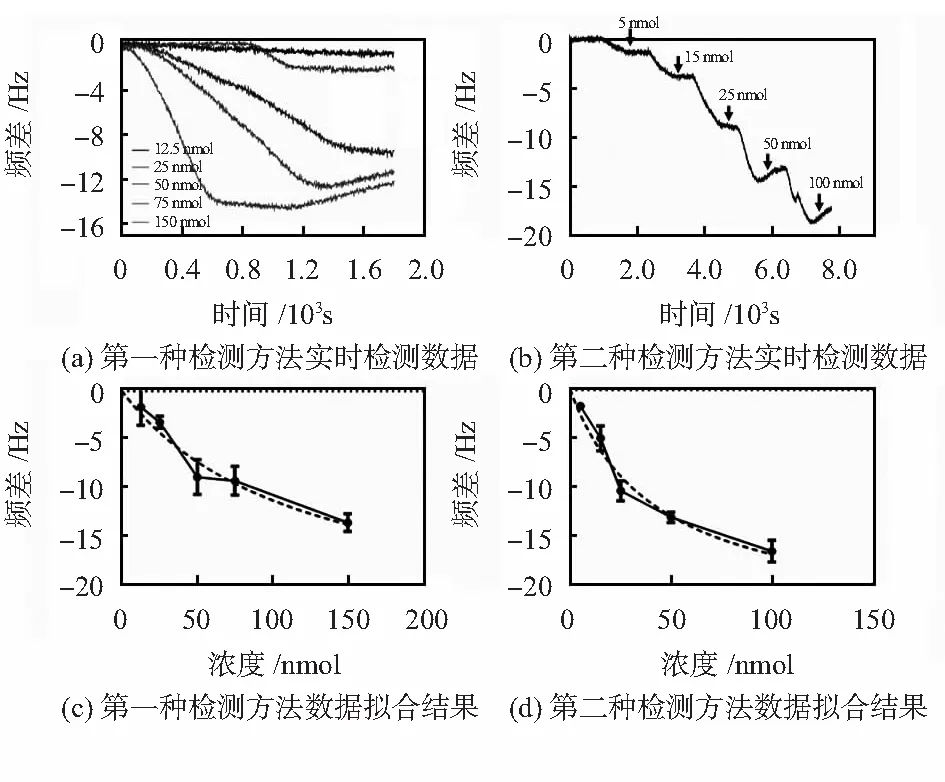
图4 解离常数检测Fig 4 Detecion of dissociated constant
2.4 分析与讨论
凝血酶与TBA15的亲和力检测使用的方法很多,KD值为2~170 nmol不等[21],结果差异较大。本文以石英微天平传感器为表征方法,检测后得到的解离常数分别为119,43.24 nmol。前者检测方法与2010年Chen等人利用石英晶体微天平表征方法相同,但比其得到的解离常数(159±30) nmol小,差异在于本研究使用的是将适体固定在芯片表面后进行非特异性位点的封闭,Chen的研究使用的是混合固定方法,封闭剂使用的是MCH,易挥发,因此,适体在芯片上固定量存在较大差异,导致解离常数较大。后者与Jane Poloti[15]检测结果存在差异,比其检测得到的(17.7±0.3) nmol大。对比实验过程,Jane Poloti在实验中没有进行非特异性位点封闭,因此,在适体功能化芯片上蛋白的结合量大于进行了非特异性位点封闭结果,导致其解离常数变小。本实验中,将适体固定的在线定量检测和高度精确的非特异性位点封闭方法结合,进行TBA15和凝血酶的解离常数检测,得到了一个较合理的解离常数,实验结果重现性高,实验时间短,能够迅速准确地得到精度较高的检测结果。
3 结 论
综上所述,QCM生物传感器检测核酸适体与蛋白质解离常数方法可因蛋白进样方式,封闭剂种类及封闭剂使用发生而存在差异,可能的原因是适体与蛋白在芯片表面形成的复合物和封闭剂与适体在芯片表面的分布由于空间位阻对蛋白的结合有影响。该研究可为基于石英晶体微天平检测适体与蛋白质靶标或者其他分子靶标检测方法的建立提供较有力的证据。
[1] Li J,Lei P,Ding S,et al.An enzyme-free surface plasmon resonance biosensor for real-time detecting microRNA based on allosteric effect of mismatched catalytic hairpin assembly[J].Biosensors and Bioelectronics,2016,77:435-441.
[2] 陈超杰,蒋海峰.石英晶体微天平的研究进展综述[J].传感器与微系统,2014,33(5):5-8.
[3] Song S,Wang L,Li J,et al.Aptamer-based biosensors[J].TrAC Trends in Analytical Chemistry,2008,27(2):108-117.
[4] 崔莹光,廉文静,黄加栋.赤芍801对白细胞介素—6与其受体相互作用影响的研究[J].传感器与微系统,2011,30(6):45-48.
[5] 张嘉琪,胡馨升,胡发志,等.ZnO纳米棒修饰的QCM气体传感器检测NH3研究[J].传感器与微系统,2014,33(4):14-16.
[6] Poitras C,Tufenkji N.A QCM-D-based biosensor for E.coli O157:H7 highlighting the relevance of the dissipation slope as a transduction signal[J].Biosensors and Bioelectronics,2009,24(7):2137-2142.
[7] 李晓霞,申丽华,漆红兰.适体电化学生物传感器研究进展[J].传感器与微系统,2007,26(12):8-11.
[8] Huang R,Xi Z,He N.Applications of aptamers for chemistry analysis,medicine and food security[J].Science China Chemistry,2015,58(7):1122-1130.
[9] Hasegawa H,Savory N,Abe K,et al.Methods for improving aptamer binding affinity[J].Molecules,2016,21(4):421.
[10] Jing M,Bowser M T.Methods for measuring aptamer-protein equilibria:A review[J].Analytica Chimica Acta,2011,686(1-2):9-18.
[11] Cheng C I,Chang Y P,Chu Y H.Biomolecular interactions and tools for their recognition:Focus on the quartz crystal microba-lance and its diverse surface chemistries and applications[J].Chem Soc Rev,2012,41(5):1947-1971.
[12] Xu X,Zhou J,Liu X,et al.Aptameric peptide for one-step detection of protein kinase[J].Analytical Chemistry,2012,84(11):4746-4753.
[13] Formisano N,Jolly P,Bhalla N,et al.Optimisation of an electrochemical impedance spectroscopy aptasensor by exploiting quartz crystal microbalance with dissipation signals[J].Sensors and Actuators B:Chemical,2015,220:369-375.
[14] Chen Q,Tang W,Wang D,et al.Amplified QCM-D biosensor for protein based on aptamer-functionalized gold nanoparticles[J].Biosens Bioelectron,2010,26(2):575-579.
[15] Politi J,Rea I,Nici F,et al.Nanogravimetric and optical characterizations of thrombin interaction with a self-assembled thiolated aptamer[J].Journal of Sensors,2016,2016:1-8.
[16] Yao C,Qi Y,Zhao Y,et al.Aptamer-based piezoelectric quartz crystal microbalance biosensor array for the quantification of IgE[J].Biosensors and Bioelectronics,2009,24(8):2499-2503.
[17] Dong Z,Zhao G.A theophylline quartz crystal microbalance biosensor based on recognition of RNA aptamer and amplification of signal[J].The Analyst,2013,138(8):24-56.
[18] Tombelli S,Minunni M,Luzi E,et al.Aptamer-based biosensors for the detection of HIV-1 Tat protein[J].Bioelectrochemistry,2005,67(2):135-141.
[19] Bayramoglu G,Ozalp V C,Yilmaz M,et al.Lysozyme specific aptamer immobilized MCM-41 silicate for single-step purification and quartz crystal microbalance(QCM)-based determination of lysozyme from chicken egg white[J].Microporous and Mesoporous Materials,2015,207:95-104.
[20] Famulok M,Mayer G.Aptamer modules as sensors and detector-s[J].Accounts of Chemical Research,2011,12(44):1349-1358.
[21] Trapaidze A,Bancaud A,Brut M.Binding modes of thrombin binding aptamers investigated by simulations and experiment-s[J].Applied Physics Letters,2015,106(4):43702.
林俊生,通讯作者,E—mail junshenglin@hqu.edu.com。
Comparative analysis of detection methods for dissociation constant of aptamer and protein*
SU Xue,HE Yi-ting,LIN Jun-sheng
(School of Biomedical Science,Huaqiao University,Quanzhou 362021,China)
Compare the two detection methods of dissociated constant of aptamer and protein based on quartz crystal microbalance(QCM)biosensor,a protocol with high accuracy and reasonability is introduced. Thrombin and thrombin aptamer named TBA15 are used as models.The immobilization of thiolated aptamer,the block of the non-specific site and the signal response induced by two different sampling methods are monitored by QCM with dissipation(QCM-D)biosensor in real time and dissociated constant are calculated by data fitting.Dissociated constant are different when different sampling methods are used,and different block agent applied,blocking of nonspecific site.The sampling method with fixed bulk of protein from low concentration to high concentration are proved ideal method with high repeatability and fewer regents needed which is less than 1 μg.
quartz crystal microbalance(QCM)sensor;aptamer;protein;dissociated constant
10.13873/J.1000—9787(2016)11—0047—04
2016—10—14
国家自然科学基金资助项目(81270734); 华侨大学高层次人才项目(13Y0391)
Q 31
A
1000—9787(2016)11—0047—04
苏 雪(1991-),女,江西抚州人,硕士研究生,研究方向为适体与靶标结合表征。

